
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная концентрация эквивалентаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Эквивалент – это реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях. Единицей количества вещества эквивалента является моль – n экв(B). Фактор эквивалентностиf экв(В) – число, показывающее, какая доля реальной частицы вещества В эквивалентна одному иону H+ в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности – безразмерная величина, f экв £ 1. Его рассчитывают из формулы кислоты, основания, соли, кристаллогидрата или по стехиометрии указанной реакции. Для кислоты
Например, f экв(HCl) = 1, f экв(H2SO4) = 1/2, f экв(H3PO4) =1/3. Но если многоосновная кислота в конкретной реакции проявляет себя как одноосновная кислота или двухосновная, то f экв ее будет меняться. Например, H3PO4 + NaOH ® NaH2PO4 + H2O; f экв(H3PO4) =1. H3PO4 + 2NaOH ® Na2HPO4 + 2H2O; f экв(H3PO4) =1/2. H3PO4 + 3NaOH ® Na3PO4 + 3H2O; f экв(H3PO4) = 1/3. Для основания
Например, f экв(NaOH) = 1; f экв(Al(OH)3) = 1/3. Для соли
Например, f экв(KBr) = 1;
Молярная масса эквивалентов вещества Мэкв(В) – это масса моля эквивалентов вещества В. Она равна произведению фактора эквивалентности на молярную массу вещества В:
Например: Mэкв(H2SO4) = 98 г/моль ´ 1/2 = 49 г/моль. Молярная концентрация эквивалента С экв(В) или упрощенно
Если объем раствора измеряется в миллилитрах, то
Молярная концентрация и молярная концентрация эквивалента связаны между собой соотношением: C В = C экв ´ f экв(В). Старое обозначение C экв – N (нормальность). Например, запись: 0,1N означает, что в 1 л раствора содержится 0,1 моль-эквивалентов растворенного вещества. Моляльная концентрация раствора Моляльная концентрация вещества В в растворе (символ С М, единица измерения моль/кг) – это отношение числа молей растворенного компонента к массе растворителя, выраженному в килограммах, т.е. количество вещества, содержащееся в килограмме растворителя:
m растворителя = m р-ра – m растворенного в-ва. Титр раствора Титр раствора вещества В (символ Т, единица г/мл) – это отношение массы вещества к объему раствора, т.е. это масса вещества в граммах, содержащаяся в 1 мл раствора:
Все виды концентраций пропорциональны друг другу, следовательно, можно от одного способа выражения концентрации перейти к другому. Так, например:
Обучающие задачи Задача 1. Навеску 5,63 г KBr растворили в 150 г воды, плотность полученного раствора r = 1,14 г/мл. Рассчитайте С В, С экв, Т и С % полученного раствора. Решение
Задача 2. Определите навеску соли и массу воды, необходимые для приготовления 500 мл 0,85%-го раствора NaCl (r = 1,005 г/мл). Решение 1. Находим массу раствора: m р-ра = 1,005 г/мл × 500 мл = 502,5 г. 2. Определяем массу NaCl, необходимую для приготовления 502,5 г раствора:
3. Находим массу воды, необходимую для приготовления раствора: m воды= 502,5 – 4,27 = 498,23 г. Задача 3. Сколько миллилитров 36%-го HCl c r = 1,18 г/мл нужно взять, чтобы приготовить 200 мл раствора с С экв = 0,1 моль/л? Решение 1. Определяем массу чистой HCl в 200 мл раствора:
М экв(HCl) = M (HCl) × f экв(HCl) = 36,5 г/моль. 2. Рассчитаем массу 36%-го раствора HCl, который содержит 0,73 г чистой HCl:
3. Определяем объем 36%-го раствора HCl:
Отмеряем цилиндром 1,72 мл 36%-го раствора HCl, помещаем в мерную колбу на 200 мл и доливаем до метки водой, закрываем колбу и тщательно перемешиваем раствор. Получаем раствор HCl с концентрацией С экв = 0,1 моль/л. Задача 4. Какой объем 35%-го раствора H2SO4 (r = 1,35 г/мл) нужно взять, чтобы приготовить 250 мл раствора с Т = 0,005 г/мл? Решение 1. Определяем массу безводной H2SO4 в 500 мл раствора:
2. Рассчитываем объем 35%-го раствора, который содержит 1,25 г безводной H2SO4:
Задача 5. В техническом KОН содержание основного вещества составляет 92 %. Сколько граммов технического KОН надо взять для приготовления 250 мл раствора с концентрацией С экв = 0,1 моль/л? Решение 1. Определяем молярную массу эквивалента KОН:
2. Определяем массу KОН в 250 мл раствора, который необходимо приготовить:
3. Расчитываем навеску технического KОН, содержащего 8 % примесей:
отсюда
Помещают навеску 1,5217 г KOH в мерную колбу на 250 мл, растворяют, доливают водой до метки и перемешивают раствор. Получают раствор KOH с приблизительной концентрацией C экв = 0,1 моль/л. Вопросы для самоконтроля 1. Основные понятия: раствор, растворенное вещество, растворитель, эквивалент, фактор эквивалентности. 2. Основные способы выражения концентраций растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента, титр, моляльная концентрация раствора. 4.1.4. Домашнее задание № 4 Решите задачу приготовления раствора заданной концентрации. Задание 1. Рассчитайте массу соли и объем воды, необходимые для получения 250 мл раствора с заданной молярной концентрацией (С B, моль/л) (см. свой вариант в табл. 9). Задание 2. Рассчитайте массовую долю (в %), молярную концентрацию эквивалента, моляльную концентрацию и титр этого раствора. Таблица 9
Задание 3. Рассчитайте ионную силу раствора, в котором содержится соль, указанная в вашем варианте (табл. 9) и BaCl2 c концентрацией 0,25 моль/кг. 4.2. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ. Теоретическая часть Метод нейтрализации позволяет по результатам титрования определить точную концентрацию компонента кислотного или основного характера в исследуемом растворе и вычислить его содержание в граммах. В основе метода лежит реакция нейтрализации между кислотой и основанием, кислотой и основной солью, основанием и кислой солью и др., т.е. реакция взаимодействия гидратированных ионов Н+ и ОН–: Н+ + ОН– → Н2О. Теоретической основой метода является закон эквивалентов: массы реагирующих веществ пропорциональны их молярным массам эквивалентов:
где m кислоты и m основания – массы реагирующих веществ кислотно-основного характера, г; Мэкв – молярные массы эквивалентов взаимодействующих веществ, г/моль; Мэкв(В) = M(В) × f экв. Следствие из закона эквивалентов позволяет оперировать объемами реагирующих веществ: С экв(к-ты) V (к-ты) = С экв(основ) V (основ) , где С экв –молярные концентрации эквивалентов реагирующих веществ, моль/л; V – объемы растворов реагирующих веществ, мл. В качестве рабочих растворов в методе нейтрализации используют: 1) титрованный раствор HCl (или H2SO4) C экв = 0,1 или 0,01 моль/л; 2) титрованный раствор NaOH (или KOH) C экв = 0,1 или 3) установочный раствор буры (Na2B4O7×10H2O) (для установления титра кислоты); 4) установочный раствор щавелевой кислоты H2C2O4×2H2O (для установления титра щелочи). Для установления точки эквивалентности в реакции нейтрализации используют индикаторы (метиловый оранжевый, фенолфталеин и др.). Например, для определения концентрации соляной кислоты в исследуемом растворе (С экв(HCl)) точный объем исследуемого раствора
содержание компонента кислотного или основного характера в определенном объеме раствора в граммах можно определить: а) m = C экв × Мэкв , г – масса в 1 л раствора; б) Зная С экв, всегда можно выразить концентрацию вещества в виде С (В), С м, С % и Т. Обучающие задачи Задача 1. Сколько граммов натрия тетрабората (буры) – Решение Запишем уравнения процесса нейтрализации буры соляной кислотой, учитывая, что натрия тетраборат подвергается в воде гидролизу с образованием NaOH, который затем вступает в реакцию с HCl: а) +
1. Определяем молярную массу эквивалента Na2B4O7 × 10H2O, учитывая, что: f экв(НСl) = 1; f экв(буры) = 1/2; Мэкв(Na2B4O7×10Н2O) = M(Na2B4O7×10H2O)× f экв(буры) = 190,71 г/моль 2. Рассчитывают массу буры, необходимую для приготовления
Взвешивают вычисленную навеску на аналитических весах, помещают ее в мерную колбу на 250 мл, растворяют и доливают водой до метки, закрывают пробкой и перемешивают. Получают 250 мл С экв = Задача 2. Определите молярную концентрацию эквивалента (С экв), титр, поправочный коэффициент (K) раствора HCl, если на титрование 10 мл его затрачено 10,4 мл C экв = 0,1 моль/л раствора буры? Решение 1. Запишем уравнения реакций гидролиза и нейтрализации, в которые вступает натрия тетраборат:
2. Расчитаем молярную концентрацию эквивалента С экв раствора HCl по следствию закона эквивалентов:
3. Определяем молярную массу эквивалента НСl: Мэкв(НСl) = М(НСl) × f экв(НСl) = 36,5 г/ моль × 1=36,5 г/ моль. 4. Определяем титр раствора HCl:
5. Определяем поправочный коэффициент:
Задача 3. Вычислить граммовое содержание NaOH в 250 мл и титр рабочего раствора NaOH, если на титрование 10 мл этого раствора было израсходовано 8,5 мл щавелевой кислоты (H2C2O4 × 2H2O) с С экв = Решение 1. Записываем уравнение реакции нейтрализации: 2NaOH + H2C2O4 = Na2C2O4 + 2H2O. 2. Определяем фактор эквивалентности, молярную массу эквивалента H2C2O4×2H2O и NaOH: f экв(NaOH) = 1; Мэкв(NaOH) = 40 г/моль; f экв(H2C2O4 × 2H2O) = 1/2;
3. Определяем С экв раствора NaOH:
4. Определяем титр раствора NaOH:
5. Определяют граммовое содержание NaOH в 250 мл раствора: m = V × T= 250 × 0,0034 = 0,85 г. Задача 4. В колбе на 250 мл растворили 1 г технического реактива NaOH, на титрование 10 мл этого раствора пошло 8 мл раствора HCl с С экв = 0,1 моль/л, поправочный коэффициент K (C экв) = 0,95. Определить массовую долю (в %) NaOH в навеске. Решение 1. Записываем уравнение реакции нейтрализации: HCl + NaOH = NaCl + H2O. 2. Определяем молярные массы эквивалентов веществ, вступающих в реакцию: Мэкв(HCl) = 36,5 г/моль; Мэкв(NaOH) = 40 г/моль. 3. Определяем практическую молярную концентрацию эквивалента (C экв) раствора HCl, зная поправочный коэффициент:
4. Расcчитываем С экв раствора NaOH:
5. Определяем граммовое содержание NaOH в 250 мл раствора:
6. Определяем массовую долю (С %) NaOH (в %) в исследуемом образце:
т.е. в техническом образце содержится 76 % химически чистого NaOH. Задача 5. Сколько граммов KОН оттитровывается 8 мл HCl с С экв(HCl)теор = 0,1 моль/л K (С экв) = 0,98? Решение 1. Записываем уравнение реакции и определяем молярные массы эквивалентов реагирующих веществ: KОН + HCl = KCl + H2O; Мэкв(KОН) = М(KОН) × f экв(KОН) = 56 г/моль × 1 = 56 г/моль; Мэкв(HCl) = М(HCl) × f экв(HCl) = 36,5 г/моль × 1 = 36,5 г /моль. 2. Определяем практическую молярную концентрацию эквивалента раствора KОН:
3. Определяем содержание в граммах HCl в 8 мл раствора:
4. Определяем массу KОН, пошедшую на реакцию с HCl по закону эквивалентов:
4.2.3. Домашнее задание № 5 Задание 1. Рассчитайте, сколько граммов HCl оттитровываются раствором NaOH с заданными значениями С экв и объмом (см. свой вариант в табл. 10) Таблица 10
Лабораторная работа № 4 ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ Цель работы. Приобретение практических навыков в приготовлении растворов различной концентрации, в использовании титриметрического метода анализа для определения точной концентрации исследуемого раствора. Опыт 1. Приготовление 30 г водного раствора кристаллогидрата натрия карбоната с массовой долей 15 % Задание. Рассчитайте массу кристаллогидрата натрия карбоната Na2CO3·10H2O, которую необходимо взять для приготовления 30 г раствора с массовой долей 15 % в пересчете на безводную соль Na2CO3. Рассчитайте массу воды, необходимую для приготовления 30 г этого раствора. Все вычисления приведите в своем отчете (оформите задачей). Сделайте вывод (укажите, какими должны быть навеска кристаллогидрата соли и объем воды для приготовления раствора). Выполнение опыта. Взвесьте на лабораторных технических весах навеску кристаллогидрата соли, которую получили в результате расчета, и количественно перенесите ее в стаканчик емкостью 50 мл. Мерным цилиндром отмерьте количество воды, которое необходимо для приготовления 30 г раствора. Влейте воду в станчик с солью (воду необходимо приливать постепенно, все время перемешивая раствор). Опыт 2. Приготовление 100 мл водного раствора кристаллогидрата хлорида железа (III) концентрацией С экв = 0,5 моль/л Задание. Рассчитайте навеску кристаллогидрата железа (III) хлорида FeCl3·6H2O, которую необходимо взять для приготовления 100 мл раствора с концентрацией С экв= 0,5 моль/л. Все вычисления приведите в своем отчете (оформите задачей). Сделайте вывод (укажите, какими должны быть навеска кристаллогидрата соли и объем воды для приготовления раствора). Выполнение опыта. Взвесьте на лабораторных технических весах навеску кристаллогидрата и перенесите ее через воронку в мерную колбу на 100 мл. Ополаскивание воронки водой продолжайте до тех пор, пока вся навеска соли не будет перенесена в мерную колбу. Раствор в колбе должен при этом занимать примерно две третьих части ее объема. Если все кристаллы соли растворились, перемешайте раствор круговыми движениями колбы и после этого долейте его до метки дистиллированной водой. Закройте колбу пробкой и снова перемешайте раствор, переворачивая колбу вверх то дном, то горловиной. Опыт 3. Установление точной концентрации соляной кислоты по буре Для установления точной концентрации раствора кислоты используют натрия тетраборат (буру) Na2B4O7×10H2O, соль сильного основания (NaOH) и слабой кислоты (H3BO3), которая в водном растворе подвергается гидролизу, и раствор имеет щелочную реакцию:
Процесс гидролиза обратим, но при добавлении HCl ионы H+ связываются с ОН– и гидролиз идет до конца. Именно по этой причине эта соль может использоваться как основной компонент кислотно-основного взаимодействия в методе нейтрализации: 2HCl + 2NaOH = 2NaCl + 2H2O. Суммарное уравнение взаимодействия буры с HCl: Na2B4O7 + 5H2O + 2HCl = 2NaCl + 4H3BO3. Количество NaOH, образовавшегося при гидролизе буры, эквивалентно количеству взятой буры, а также количеству HCl, пошедшему на нейтрализацию NaOH. Поэтому по количеству буры, пошедшей на титрование, можно определить точную концентрацию раствора HCl. В конце реакции накапливается слабая борная кислота, следовательно, pH раствора в точке эквивалентности будет несколько меньше 7 и для титрования следует взять индикатор метиловый оранжевый. Выполнение опыта а) Приведите в рабочее состояние бюретку, налейте в нее до отметки «0» приготовленный вами или лаборантами раствор HCl с приблизительной концентрацией С экв = 0,1 моль/л. б) В стаканчик для титрования с помощью другой бюретки (наполненной раствором буры) отмерьте 5 мл раствора буры с С экв = в) К раствору буры медленно, небольшими порциями из бюретки приливайте раствор соляной кислоты до точки эквивалентности. При этом окраска метилоранжа переходит из желтой в бледно-розовую. г) Заметьте по бюретке объем соляной кислоты, пошедшей на титрование. Титрование повторите три раза. Данные титрования занесите в табл. 11. Таблица 11
Задание. Запишите уравнение реакции. Заполните таблицу. а) На основании уравнения для следствия закона эквивалентов: C экв(буры)´ V (буры) = С экв(HCl) ´ V (HCl) расчитайте С экв(HCl), взяв V ср(HCl) как среднее значение по результатам трех титрований. б) Определите титр раствора соляной кислоты, используя формулу
в) Определите поправочный коэффициент (K) для исследуемого раствора HCl, учитывая, что C экв (теор) = 0,1 моль/л. 4.3. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. Теоретическая часть Электролитами называют вещества, которые в растворенном (или расплавленном) состоянии проводят электрический ток. Теория Аррениуса объясняет электропроводность растворов тем, что молекулы электролитов под действием полярных молекул растворителя диссоциируют на ионы. Эта способность электролитов к диссоциации на ионы служит мерой силы данного электролита. При растворении в полярных растворителях молекулы многих веществ практически полностью распадаются на ионы. Такие вещества называются сильными электролитами (NaCl, Na2SO4, HCl, KOH и др.). Однако электролитическая диссоциация многих других веществ в аналогичных условиях не доходит до конца. Процесс оказывается обратимым, причем равновесие наступает при распаде на ионы лишь небольшой части молекул, находящихся в растворе. Вещества подобного рода называются слабыми электролитами (СН3СООН, Н2СО3, NH4OH и др.). Отношение числа молекул, диссоциированных на ионы, к суммарному числу диссоциированных и недиссоциированных молекул называют степенью электролитической диссоциации, которую измеряют либо в долях единицы, либо в процентах.
Для сильных электролитов a > 30 %, для слабых a < 3 %. Рассмотрим процесс электролитической диссоциации в разбавленном растворе какого-либо слабого электролита, например, уксусной кислоты.
Согласно закону действия масс, скорость диссоциации СН3СООН выражается уравнением v 1 = k1×[СН3СООН], а скорость обратной реакции-ассоциации v 2 = k2×[СН3СОО–]×[Н+]. В растворе быстро устанавливается равновесие между процессами диссоциации и ассоциации, т.е. cкорости прямой и обратной реакции будут равны: v 1 = v 2 или k1 × [СН3СООН] = k2 × [СН3СОО–] × [Н+]. Преобразование последнего уравнения позволит выразить константу равновесия реакции диссоциации следующим образом:
Для растворов слабых бинарных электролитов Оствальд установил взаимосвязь между константой диссоциации (K дис), степенью диссоциации (a) и молярной концентрацией раствора (С В). Рассмотрим эту взаимозависимость на примере диссоциации уксусной кислоты. Полагая, что количество диссоциированных молекул кислоты и, следовательно, концентрация каждого из образовавшихся ионов Н+ и СН3СОО– в момент установления равновесия в системе равна [Н+] = [СН3СОО–] = С B·a. Тогда равновесная концентрация недиссоциированных молекул будет равна [СН3СООH] = С B – С B·a =
откуда
Это уравнение является математическим выражением закона разведения Оствальда. Поскольку степень диссоциации у слабых электролитов мала, то можно пренебречь этой величиной в знаменателе как слагаемым (им нельзя пренебречь в числителе как множителем). Тогда
Закон разведения Оствальда формулируется следующим образом.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 11710; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.014 с.) |

 .
.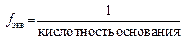 .
.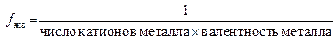 .
.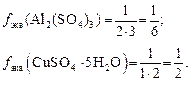

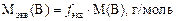 .
.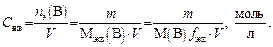
 .
. ;
;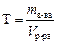 .
.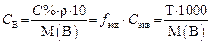 ;
;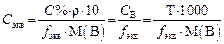 ;
; .
.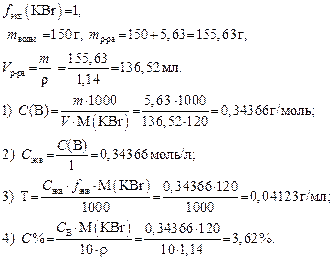

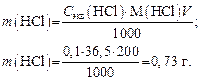
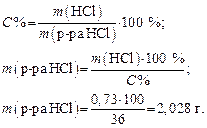
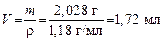 .
.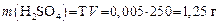 .
. .
.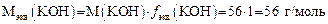 .
.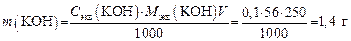 .
.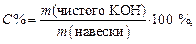
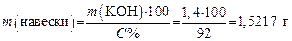 .
.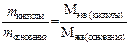 ,
,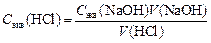 .
.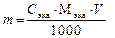 , г – масса в объеме (V), выраженном в мл.
, г – масса в объеме (V), выраженном в мл.
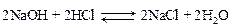

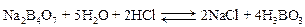


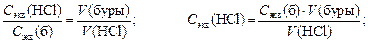
 .
. .
. .
.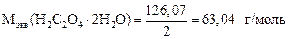 .
. ;
; .
.
 .
.
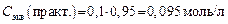 .
.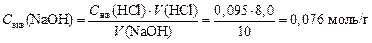 .
.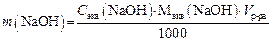 ;
; .
.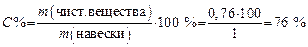 ,
,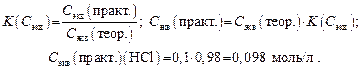


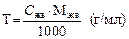 .
. .
.
 .
. ,
, .
.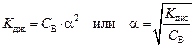 .
.


