
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Управление процессом гидролизаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Поскольку процесс гидролиза является обратимым, следовательно, на основании принципа Ле-Шателье им можно управлять, изменяя концентрации реагирующих веществ, продуктов или температуру. Так, разбавление раствора ведет к увеличению концентрации одного из реагирующих веществ (в данном случае воды). Следовательно, равновесие смещается вправо, т.е. гидролиз усиливается. В концентрированных растворах процесс гидролиза протекает значительно слабее. Влияние температуры на процесс гидролиза можно объяснить исходя из теплового эффекта процесса диссоциации воды. Так как реакция диссоциации воды эндотермическая, то повышение температуры ведет к сдвигу равновесия вправо, т.е. гидролиз усиливается. Обучающие задачи Задача 1. Определите рН раствора NaOH с С экв = 0,01 моль/л. Решение NaOH – сильный электролит, нацело диссоциирующий в растворе на ионы: NaOH → Na+ + OH–. Для этого электролита С экв = С В, так как фактор эквивалентности равен 1, следовательно, С В(OH–) = С В(NaOH) = 0,01 моль/л. Вычислим рОН = –lg С В(OH–) = –lg 10–2 = 2. Так как из ионного произведения воды рН + рОН = 14 следует, что рН = 14 – 2 = 12. Ответ: рН = 12. Задача 2. Определите рН 0,001 моль/л раствора HCN, если степень ее диссоциации 1 %. Решение. Цианистоводородная кислота является слабым электролитом, следовательно, диссоциирует обратимо: [Н+] = a × С HCN , где a – в долях, т.е. 0,01, а С HCN – концентрация в моль/л. [Н+] = 0,01 × 0,001 = 10–5 моль/л. рН = –lg 10–5 = 5. Ответ: рН = 5. Задача 3. Константа диссоциации NH4OH в 0,01 моль/л растворе равна 1,85×10-5. Запишите уравнение диссоциации этого электролита, определите его степень диссоциации, концентрацию гидроксидных ионов и рН раствора. Решение NH4OH ↔ NH4+ + OH–, [OH–] = a × С В, но
Ответ: 10,6335. Задача 4. Напишите уравнение гидролиза соли Al2(SO4)3 в молекулярной и ионно-молекулярной форме и укажите реакцию ее водного раствора. Анионы SO42–, являясь ионами сильного электролита (H2SO4), не принимают участия в реакциях, поскольку не образуют с водой слабого электролита. А поскольку заряд катиона алюминия равен (3+), то стадий гидролиза будет также три. Водный раствор соли в результате гидролиза будет иметь кислую реакцию. 1-я ступень гидролиза: краткое ионно-молекулярное уравнение: Al3+ + HOH ↔ AlOH2+ + H+. Поскольку сульфат-ионы, которые необходимо добавить в левую и правую части уравнения, чтобы получить молекулярное уравнение, имеют заряд 2–, умножим ионно-молекулярное уравнение на 2: 2Al3+ + 2H2O ↔ 2AlOH2+ + 2H+. Тогда молекулярное уравнение: Al2(SO4)3 + 2HOH ↔ 2Al(OH)SO4 + H2SO4. 2-я ступень гидролиза: краткое ионно-молекулярное уравнение: AlOH2++HOH↔Al(OH)2++H+; молекулярное уравнение: 2Al(OH)SO4+2HOH↔[Al(OH)2]2SO4+H2SO4. 3-я ступень гидролиза: краткое ионно-молекулярное уравнение: Al(OH)2+ +HOH↔Al(OH)3+ H+; молекулярное уравнение: [Al(OH)2]2SO4+ 2HOH ↔ 2Al(OH)3 + H2SO4. Вопросы для самоконтроля 1. Общие понятия о сильных и слабых электролитах. Степень и константа диссоциации. 2. Закон разведения Оствальда для бинарных электролитов. 3. Уравнение ионного произведения воды. Понятие о рН, рОН, их взаимосвязь. 4. Гидролиз солей: общие понятия, уравнения гидролиза, константа гидролиза, степень гидролиза, факторы, влияющие на гидролиз. 5. Понятие об активности, коэффициенте активности, ионной силе раствора, произведении растворимости. 4.3.4. Домашнее задание № 6 Задание 1. Напишите ионно-молекулярные и молекулярные уравнения гидролиза соли (см. свой вариант в табл. 12). Выведите и рассчитайте K гидр по 1- и 2-й ступени, а также степень гидролиза и pH раствора при заданной концентрации (см. табл. 12). Задание 2. Как повлияет на глубину гидролиза охлаждение раствора и разбавление его водой? Дайте объяснение. Предложите условия, при которых гидролиз бы проходил максимально глубоко. Задание 3. Рассчитайте pH и pOH растворов c заданной молярной концентрацией (см. свой вариант в табл. 13). Таблица 12
Таблица 13
Лабораторная работа № 5 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. Цель работы. экспериментально изучить влияние одноименных ионов на процесс диссоциации, изменение рН раствора в результате гидролиза солей и влияние температуры на процесс гидролиза. Опыт 1. Влияние одноименных ионов на диссоциацию слабого электролита Выполнение опыта. На два предметных стекла нанесите пипеткой подве капли 0,1 М раствора аммония гидроксида, добавьте к ним по одной капле фенолфталеина. Какова окраска растворов? Дайте объяснение. Каков интервал pH перехода окраски фенолфталеина? Один раствор оставьте в качестве контрольного, а к другому добавьте 2 капли 1 М раствора ацетата аммония. Объясните наблюдаемое изменение окраски раствора. Задание. Напишите уравнение диссоциации аммония гидроксида, выразите константу диссоциации. Сделайте вывод (укажите, как влияет на диссоциацию слабого электролита добавление в его раствор одноименных ионов). Опыт 2. Смещение равновесия реакции гидролиза при изменении температуры Выполнение опыта. Внесите в пробирку несколько кристалликов ацетата натрия, 1 – 1,5 мл дистиллированной воды и 1 – 2 капли фенолфталеина. Заметьте интенсивность окраски. Содержимое пробирки разделите на две части, одну из них оставьте для сравнения, другую – нагрейте в пламени спиртовки до кипения. Как изменится интенсивность окраски? Дайте пробирке охладиться и снова сравните окраску индикатора в обеих пробирках. Задание. Составьте уравнение реакции гидролиза соли, назвав предварительно гидролизующийся ион. Опишите и поясните свои наблюдения. Сделайте вывод (отметьте среду раствора и влияние температуры на гидролитическое равновесие). Опыт 3. Гидролиз солей Выполнение опыта. Проведитеэксперимент поочередно с каждой из предложенных ниже солей. Для этого на предметное стекло нанесите две капли заданной соли. Далее самостоятельно выберите индикатор (лакмус или метиловый оранжевый, или фенолфталеин, или универсальную индикаторную бумагу), который будет определять характер среды для данной соли. Наблюдайте изменение окраски раствора. Соли: а) натрия хлорид (NaCl); б) аммония ацетат (CH3COONH4); в) натрия карбонат (Na2CO3); г) железа (III) хлорид (FeCl3); д) натрия ортофосфат (Na3PO4); е) натрия гидрофосфат (Na2HPO4); ж) натрия дигидрофосфат (NaH2PO4). Результаты и наблюдения занесите в табл. 14 Таблица 14
Задание. Заполните таблицу. Напишите в молекулярной и ионно-молекулярной форме уравнения ступенчатого гидролиза для каждой соли. Сделайте вывод (приведите определение гидролиза солей, отметьте, на какой ступени гидролиз протекает лучше, на какой – слабее). КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Теоретическая часть Комплексными или координационными называют сложные соединения, в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному существованию в растворе. Часть комплексного соединения, заключенная в квадратные скобки, называется внутренней сферой. Ионы, находящиеся вне квадратных скобок, называют внешней сферой. В молекуле комплексного соединения, например K3[CoF6], различают следующие структурные элементы: 1) центральный ион внутренней сферы, удерживающий около себя определенное число других ионов или молекул – ион-комплексо-образователь Со3+; 2) с комплексообразователем связаны (координированы вокруг него) полярные молекулы или ионы F–, которые называют лигандами. Ион-комплексообразователь вместе с лигандами образует внутреннюю сферу комплексного соединения или комплексный ион. Заряд комплексного иона представляет собой алгебраическую сумму зарядов комплексообразователя и лигандов: [Co3+F6–]х– : +3 + 6(–1) = х, х = –3, т.е. [Co3+F6–]3– ; 3) внешняя сфера соединения – три иона K+; 4) координационное число (к.ч.) показывает, какое количество лигандов координирует вокруг себя данный комплексообразователь – в данном случае к.ч. = 6.
Лиганд, образующий с комплексообразователем две связи, называется бидентантным. Например, оксалат-ион С2О42– образует с катионом Сu2+, координационное число которого равно 4, соединение K4[Cu(C2O4)2]. Таким образом, дентантность лиганда – это число электронных пар, которые предоставляет данный лиганд на образование связей с центральным атомом или число координационных мест, которые он занимает во внутренней сфере комплекса. Бидентатными являются ионы: SO42–, CO32–, а также молекулы глицина (:NH2 – CH2 – COOН) и этилендиамина (H2N: – CH2 – CH2 –: NH2). Комплексные соединения характеризуются наличием ковалентной связи, возникающей либо по обменному, либо по донорно-акцептор-ному механизму, при этом лиганд является донором, а центральный атом – акцептором электронной пары. Например, электронная конфигурация атома кобальта: 1s22s22p63s23p6 3d74s24p0. Электронная конфигурация иона кобальта: Co3+ 1s22s22p63s23p6 3d64s04p0. Таким образом, в ионе кобальта полностью вакантны 4s и 4p-орби-тали, а также на 3d-орбитали возможно разместить еще четыре электрона, в сумме на свободных орбиталях кобальта может разместиться 12 электронов. В образовании комплекса K3[CoF6] участвуют шесть ионов фтора с электронной конфигурацией: F– 1s22s22p6, таким образом, от каждого из шести ионов фтора по паре электронов с р-орбитали по донорно-акцепторному механизму перемещаются на свободные орбитали иона кобальта, поэтому связи внутри координационной сферы ковалентные полярные. Между внешней и внутренней сферами связь ионная, поэтому комплексные соединения диссоциируют в полярных растворителях на K3[CoF6] → 3K+ + [CoF6]3–. А вот комплексный ион диссоциирует как слабый электролит постадийно, так как комплексообразователь и лиганды связаны ковалентной полярной связью: [CoF6]3– ↔ [CoF5]2– + F– [CoF5]2– ↔ [CoF4]– + F– ………………………………………….. [CoF]2+ ↔ Co3+ + F– Условно диссоциацию комплексного иона слабого электролита записывают суммарным уравнением диссоциации: [CoF6]3– ↔ Co3+ +6F– Диссоциация комплексных ионов имеет количественную характеристику – константу нестойкости (K нест):
В зависимости от константы нестойкости комплексные ионы подразделяются: на нестойкие, устойчивые, очень устойчивые (табл. 15). Таблица 15
Чтобы разрушить комплексный ион, необходимо сместить его равновесие диссоциации в прямом направлении. Так как при разбавлении растворов диссоциация усиливается, для разрушения неустойчивых комплексных ионов достаточно просто разбавить раствор водой. Устойчивые комплексные ионы разрушают химическим воздействием либо на комплексообразователь, либо на лиганды. Это означает, что или комплексообразователь, или лиганды надо удалить из раствора в виде труднорастворимого соединения (приложение 14) либо в виде более прочного комплексного иона. Например, надо разрушить устойчивый комплексный ион [Ag(NH3)2]+, имеющий K нест = 10–8. Если на раствор, содержащий данный ион, воздействовать раствором йодида калия, то ионы серебра будут удалены из раствора в виде AgI, имеющего произведение растворимости, равное 10–17. Если воздействовать азотной кислотой, то лиганды молекулы NH3 будут связаны в комплексный ион [H(NH3)]+, K нест = 10–14. В обоих случаях понизится концентрация продуктов реакции: [Ag(NH3)2]+ ↔ Ag+ + 2NH3, по принципу Ле-Шателье равновесие реакции сместится в прямом направлении, в сторону разрушения комплексного иона. Обучающие задачи Задача 1. Определите заряд комплексного иона, его координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: а) K[Pt(NH3)Cl5], б) [Cr(H2O)5Cl]Cl2, в) K2[Cu(CN)4]. Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно сумме лигандов, координированных вокруг него, умноженное на дентатность лигандов. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Например, для комплексных соединений (см. таблицу).
Задача 2. Вычислите концентрацию ионов комплексообразователя и лиганда в 1М растворе K[Ag(CN)2], если K нест [Ag(CN)2]– = 1,0 ∙ 10–21. Решение 1. Запишем уравнения диссоциации комплексного соединения: K[Ag(CN)2]→ [Ag(CN)2]– + K+; [Ag(CN)2]– «Ag+ + 2 CN–. 2. Напишем уравнение для константы нестойкости:
3. В полученном уравнении константы нестойкости примем [Ag+] = = x. Тогда [CN–] = 2 x, а [Ag(CN)2]– = 1 – x. 4. Подставим найденные выражения концентраций в уравнение константы нестойкости и получим:
Поскольку величина х в знаменателе по сравнению с концентрацией комплексного иона очень мала, то можно значение 1 – х приравнять к 1. Тогда получим 4 х 3 = 1,0 ∙ 10–21. Откуда х = [Ag+] = 6,3 ∙ 10–8 моль/л, [CN–] = 6,3 ∙ 10–8 ∙ 2 = 1,26 ∙ 10–7 моль/л. Задача 3. Произойдет ли разрушение комплекса и выпадет ли осадок AgI, если к 0,5 л 0,01М раствора K[Ag(CN)2] прилить равный объем 0,01 М раствора KI? K нест [Ag(CN)2]– = 1,0 · 10–21, а ПРAgI = 1,5 · 10–16. Решение 1. При приливании к 0,5л 0,01М раствора K[Ag(CN)2] равного объема 0,01М раствора KI общий объем раствора будет равен 1 л, вследствие чего начальные концентрации реагентов уменьшатся вдвое и будут равны: с K[Ag(CN)2] = 0,005 моль/л, с KI = 0,005 моль/л. 2. В результате ионизации комплексного иона [Ag(CN)2]– часть ионов Ag+ перейдет в раствор. Молярную концентрацию ионов Ag+ в растворе можно вычислить, исходя из уравнения константы нестойкости: [Ag(CN)2]– ↔ Ag+ + 2CN–,
Принимая, что [Ag+] = x, [CN–] = 2 x, и [Ag(CN)2]– = 0,005 моль/л, и подставляя их в уравнение константы нестойкости, найдем:
Концентрация ионов [I–] по условию задачи равна 5,0 ∙ 10–3 моль/л. 3. Подставляем найденные концентрации ионов [Ag+] и [I–] в формулу произведения растворимости и получим: [Ag+]∙[I–] = 1,08 ∙ 10–8 ∙ 5,0 ∙ 10–3 = 5,4∙10–11, а ПРAgI = 1,5 · 10–16. Следовательно, произведение концентраций ионов серебра и йода в растворе значительно больше, чем произведение растворимости йодида серебра AgI. Значит, осадок йодида серебра выпадет и комплекс K[Ag(CN)2] разрушится. Задача 4. Какова структура комплексного соединения платины, если при действии раствора нитрата серебра на водный раствор PtCl4·6NH3 весь содержащийся в этом соединении хлор осаждается в виде хлорида серебра? Решение Очевидно, что все четыре иона хлора, поскольку они легко отщепляются в растворе, находятся во внешней сфере комплексного соединения, а внутренняя сфера включает только аммиак NH3. Формула соединения: [Pt(NH3)6]Cl4. Вопросы для самоконтроля 1. Какие виды химической связи существуют в молекулах комплексных соединений? 2. Какие частицы могут быть комплексообразователями? Лигандами? Почему? Рассмотрите на конкретном примере. 3. Определите заряд комплексного иона в соединениях [Co(NH)3NO2]Cl2, K[Co(NH3)2(NO2)4]. 4. Что такое константа нестойкости, каково ее значение? От каких факторов зависит константа нестойкости? Запишите выражение K нест для комплексного иона: [Pt(NH3)4Cl2]2+. 5.4. Домашнее задание № 7 Задание 1. Для комплексного соединения (см. свой вариант в 1) внешнюю и внутреннюю сферы, 2) комплексообразователь и его степень окисления, 3) лиганды, 4) величину координационного числа комплексообразователя, 5) заряд комплексного иона, 6) запишите диссоциацию и математическое выражение константы нестойкости, найдите ее численное значение в справочнике. Задание 2. Вычислите концентрацию ионов комплексообразователя и лигандов (см. свой вариант в табл. 16), если концентрация комплексного иона равна 0,5 моль/л. Таблица 16
Лабораторная работа № 6 ПОЛУЧЕНИЕ И СВОЙСТВА КОМПЛЕКСНЫХ Цель работы. Изучить способы получения, устойчивость и диссоциацию комплексных соединений. Опыт 1. Получение комплексного катиона Выполнение опыта. Налейте в пробирку 8 – 10 капель раствора сульфата меди (II), добавьте по каплям раствор NaOH до образования осадка. Запишите уравнение реакции в молекулярном и ионном виде. К полученному осадку осторожно по каплям прибавьте концентрированный раствор аммиака до растворения осадка и изменения цвета раствора. Запишите уравнения образования комплексного катиона [Сu(NH3)4] 2+ в молекулярном и ионном виде. Задание. Записать все уравнения реакций в молекулярном и ионном виде. В выводе опишите состав и строение комплексного соединения. Опыт 2. Диссоциация комплексного соединения Выполнение опыта. В пробирку налейте 5 – 6 капель раствора соли K3[Fe(CN)6]. Если соль диссоциирует на внутреннюю внешнюю сферу, то в растворе должны присутствовать ионы K+. Проведите качественную реакцию на ион K+. Для этого в другую пробирку налейте 7 – 8 капель раствора KCl и добавьте сухой соли Na3[Co(NO2)6]. Образование ярко-желтого осадка K2Na[Co(NO2)6] является признаком присутствия ионов K+. Затем этот же реактив добавьте в пробирку с K3[Fe(CN)6]. Задание. Запишите уравнения: а) диссоциации комплексного соединения K3[Fe(CN)6]; б) в молекулярном и ионном виде реакцию взаимодействия K3[Fe(CN)6] с Na3[Co(NO2)6]. В выводе отметьте степень диссоциации комплексного соединения на внешнюю и внутреннюю сферу. Опыт 3. Устойчивость комплексного иона Выполнение опыта. Запишите диссоциацию комплексного соединения K3[Fe(CN)6] и комплексного иона. Если K нест комплексного иона большая величина, то равновесие диссоциации смещено в сторону образования ионов комплексообразователя и лигандов, и в растворе можно открыть ион Fe 3+. Если же K нест – малая величина, то открыть этот ион в растворе с помощью качественных реакций практически не удается. Проведите качественные реакции на ион Fe 3+ в растворе соли K3[Fe(CN)6]. Для этого в две пробирки налейте по 1 – 2 мл раствора K3[Fe(CN)6]. В одну пробирку добавьте щелочи. Образуется ли осадок Fe(OH)3? В другую пробирку добавьте раствор NH4CNS. Образуется ли кроваво-красное окрашивание от соли Fe(CNS)3? Задание. Приведите выражение K нест комплексного иона и цифровое значение этой величины (из таблицы). Сделайте вывод об устойчивости этого иона. 6. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Теоретическая часть Коллигативными (или взаимосвязанными, т.е. коллективными) свойствами называются свойства, которые определяются количеством частиц растворенного вещества, а не их массой или размером. Установление численного значения любого из коллигативных свойств дает возможность расчета всех остальных. К коллигативным свойствам относятся следующие. · Закон Рауля. Относительное понижение давления насыщенного пара растворителя (p 0 ) над раствором (p) нелетучего неэлектролита пропорционально мольной доле (N 2 ) растворенного вещества.
· Повышение температуры кипения раствора по сравнению с температурой кипения растворителя. Т кип(раствора) = Т кип(растворителя) + D Т кип. Для растворов неэлектролитов расчитывается по уравнению D Т кип = = K эб´ С м, где K эб – эбулиоскопическая постоянная растворителя; С м – моляльная концентрация раствора (моль/кг). Изменение температуры кипения для растворов электролитов рассчитывается с учетом изотонического коэффициента (i) по уравнению: D Т кип = i ´ K эб´ С В. · Понижение температуры замерзания раствора по сравнению с температурой замерзания растворителя. Т крист(раствора) = Т крист(растворителя) – D Т крист . Для растворов неэлектролитов: D Т крист = K кр´ С м, где K кр – криоскопическая постоянная растворителя, С м – моляльная концентрация раствора. Для растворов электролитов изменение температуры кристаллизации рассчитывается по уравнению: D Т = i ´ K кр´ С м. Осмотическое давление – это минимальное гидростатическое давление, которое надо приложить к раствору, чтобы предотвратить осмос. Осмос – это процесс самопроизвольного проникновения молекул растворителя через полупроницаемую мембрану из чистого растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией. Расчет осмотического давления для растворов неэлектролитов осуществляется по уравнению Вант-Гоффа: П = С В´R´ T, где С В – молярная концентрация (моль/л), R – универсальная газовая постоянная, T – температура в единицах Кельвина. Для растворов электролитов расчет осмотического давления осуществляется также по уравнению Вант-Гоффа, но с учетом изотонического коэффициента (i): П = i ´ С В´R´ T. Изотонический коэффициент показывает, насколько коллигативные свойства раствора электролита отличаются от свойств раствора неэлектролита при одинаковых концентрациях и других условиях:
где N – начальное число молекул; n – число частиц, на которые распалась каждая молекула. Изотонический коэффициент связан со степенью диссоциации следующим соотношением:
Рассчитать изотонический коэффициент можно из соотношений:
Обучающие задачи Задача 1. Вычислите осмотическое давление при Т = 45 °С, обусловленное растворением 15 г сахарозы C12H22O11 (М = 342,3 г/моль) в 125 г воды, при условии что мембрана пропускает только молекулы воды (R = 0,082 (л × атм)/(К × моль)). Решение 1. Определим молярную концентрацию раствора сахарозы:
2. Согласно уравнению Вант-Гоффа осмотическое давление (П) раствора: П = C ВR T, где С В – молярная концентрация раствора, моль/л; R – универсальная газовая постоянная, л × атм./К × моль; Т – температура, К. Вычислим осмотическое давление раствора сахарозы:
Ответ: 9,28 атм. Задача 2. Определите температуру кипения Т кип раствора 7,5 г KCl в 100 мл воды. М(KCl) = 74,5 г/моль, rводы = 1,00 г/мл. Эбулиоскопическая постоянная K эб(воды) = 0,516 (К´кг)/моль. Решение 1. Определим моляльную концентрацию раствора KCl (С м):
2. Вычислим величину изотонического коэффициента по уравнению i = 1+a(n – 1), учитывая, что KCl является сильным электролитом, следовательно, a~1, и диссоциирует на два иона, значит, n = 2: i = 1+1(2 – 1) = 2. 3. Рассчитаем по следствию закона Рауля, насколько температура будет отличаться от температуры кипения растворителя:
Задача 3. Определите молярную массу растворенного вещества, если известно, что раствор, содержащий 1,5 г этого вещества на 1000 г воды, замерзает при температуре –0,189 °С. Решение 1. Вычислим моляльную концентрацию растворенного вещества, используя следствие закона Рауля:
где С м – моляльность раствора, моль/кг; K кр – криоскопическая постоянная;
2. Рассчитаем молярную массу вещества, учитывая, что 15 г вещества растворено в 1 кг воды. Следовательно, молярная масса кислоты равна:
Вопросы для самоконтроля 1. Сформулируйте 1-й закон Рауля. К каким растворам применим этот закон? 2. Какие свойства растворов относятся к коллигативным и почему? 3. Почему можно уберечь в кастрюле ее содержимое от выкипания, если в «последний момент» бросить туда щепотку соли? 4. Какое из следующих веществ, образующих водный раствор с одинаковой моляльной концентрацией, должно сильнее понизить его температуру замерзания: HNO3, NaCl, C6H12O6, CaCl2? Ответ поясните. Лабораторная работа № 7 ОПРЕДЕЛЕНИЕ ИЗОТОНИЧЕСКОГО КОЭФФИЦИЕНТА Цель работы. определить температуру замерзания воды, 25,5 % раствора сахарозы, 15 % раствора глюкозы и 5,5 % раствора хлористого натрия. Выполнение опыта 1. Произведите пересчет концентрации исследуемых растворов, выраженной в массовых долях, в моляльную концентрацию. 2. В четыре отдельные пробирки налейте 5 – 7 мл растворов сахарозы, глюкозы и хлористого натрия заданной концентрации. 3. Наполните стакан охладительной смесью. 4. В пробирку 1 опустите термометр и поместите пробирку в стакан с охладительной смесью. Отметьте температуру замерзания в момент появления кристаллов. 5. Тщательно промойте термометр, вытрите фильтровальной бумагой. 6. Таким же образом определите температуру замерзания каждого из исследуемых растворов сахарозы, глюкозы и хлористого натрия в пробирках 2, 3, 4. 7. Полученные результаты оформите в виде таблицы. Таблица 17
8. Сделайте вывод о влиянии концентрации и природы растворенного вещества на температуру замерзания. Примечание. правила работы с ртутным термометром: 1. При измерении термометр должен находиться на одинаковом расстоянии от стенок сосуда. 2. Термометр держат в жидкости до тех пор, пока ртутный столбик не остановится. 3. Ртутным термометром нельзя перемешивать рабочий раствор. 4. После работы термометр тщательно вытирают от остатков раствора вещества.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 801; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.43.200 (0.011 с.) |

 .
.
 Количество химических связей между комплексообразователем и лигандами определяет координационное число комплексообразователя. Если один лиганд образует с комплексообразователем одну связь, то координационное число совпадает с количеством лигандов. Такие лиганды называются монодентантными. Например, лиганды CN–, OH–, CNS–, NO3–, H2O, NH3, NO–2 – монодентантные, следовательно, координационное число центрального иона Сr3+ в соединении [Сr(Н2О)5С1]С13 равно 6.
Количество химических связей между комплексообразователем и лигандами определяет координационное число комплексообразователя. Если один лиганд образует с комплексообразователем одну связь, то координационное число совпадает с количеством лигандов. Такие лиганды называются монодентантными. Например, лиганды CN–, OH–, CNS–, NO3–, H2O, NH3, NO–2 – монодентантные, следовательно, координационное число центрального иона Сr3+ в соединении [Сr(Н2О)5С1]С13 равно 6.
 .
. .
. ,
, .
.
 .
. ,
, .
.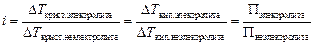
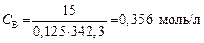 .
.
 .
.
 ,
,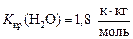 ;
; .
. .
.


