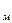Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обменные реакции В растворах электролитов. Гидролиз водыСодержание книги
Поиск на нашем сайте Сущность процессов, протекающих в растворах электролитов, наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. В таких уравнениях слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а находящиеся в растворе сильные электролиты - в виде составляющих их ионов. Например, уравнения реакций нейтрализации сильных кислот сильными основаниями: HClO 2HNO выражаются одним и тем же ионно-молекулярным уравнением: Н+ + ОН+ из которого следует, то сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита - воды. Из рассмотренных уравнений следует, что обменные реакции в растворах электролитов протекают в направлении связывания ионов, приводящего к образованию малорастворимых веществ (осадка или газов) или молекул слабых электролитов. В тех случаях, когда малорастворимые вещества (или слабые электролиты) имеются как среди исходных веществ, так и продуктов реакции, равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ. Например, при нейтрализации слабой кислоты сильным основанием: СН или СН3 СООН + ОН¯ в реакции участвуют два слабых электролита - слабая уксусная кислота и вода. При этом равновесие смещается в сторону образования более слабого электролита - воды, константа диссоциации которой (1,8* 10-16) значительно меньше константы диссоциации уксусной кислоты (1,8* 10-5). Однако до конца реакция протекать не будет, так как в растворе останется небольшое количество недиссоциированных молекул уксусной кислоты и гидроксид-ионов, а реакция раствора будет не нейтральной, а слабощелочной. Аналогично при нейтрализации слабого основания сильной кислотой: Zn(OH) Zn(OH)2 + 2 H+ = Zn2++ 2 H равновесие будет сильно смещено вправо, в сторону образования более слабого электролита (воды), но при достижении равновесия в растворе останется небольшое количество недиссоциированных молекул основания и ионов Н+; реакция раствора будет слабокислой. Следовательно, реакции нейтрализации, в которых участвуют слабые кислоты или основания, являются обратимыми. Это означает, что при растворении в воде соли, в состав которой входит анион слабой кислоты или катион слабого основания, протекает процесс Гидролиза - обменного взаимодействия соли с водой, в результате которого образуется слабая кислота или слабое основание. Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза в растворе образуются гидроксид-ионы и он приобретает щелочную реакцию. При гидролизе соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли; при этом в растворе возрастает концентрация ионов водорода, и он приобретает кислую реакцию. При взаимодействии с водой соли, образованной слабым основанием и слабой кислотой, гидролизу подвергается как катион, так и анион соли Pb(CH параллельно протекают два процесса: Pb CH В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Если К кислоты Гидролиз соли, образованной слабой кислотой НА и сильным основанием, характеризуется константой гидролиза Кг:
Кг = Здесь Кг воды - ионное произведение воды. Последнее соотношение показывает, что чем слабее кислота, т.е. чем меньше константа ее диссоциации, тем больше константа гидролиза образованной ею соли. Аналогично для соли слабого основания МОН и сильной кислоты К г = Отсюда следует, что Кг тем больше, чем меньше Кг основания, т.е. чем слабее основание МОН. Степенью гидролиза h называют долю электролита, подвергшуюся гидролизу. Она связана с константой гидролиза приближенным соотношением: Кг = h Из этого уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация или при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. ЗАДАЧИ 53-55 53. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO 54. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора. 55. В каком направлении будет смещено равновесие реакции Ag J(к)+ NaCl (водн.) D AgCl (к.)+ Na J (водн.)? Дать обоснованное объяснение.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

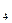 + NaOH = NaClO
+ NaOH = NaClO 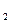 O,
O, + Ca(OH)
+ Ca(OH)  = Н2О,
= Н2О, = СН
= СН  + H
+ H  + H
+ H  К основания, то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной.
К основания, то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной. =
= 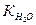 /
/ 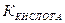

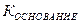
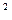 × C
× C