
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Степень окисленности. Окисление и восстановление.Содержание книги
Поиск на нашем сайте
Степень окисленности элемента в соединении определяется как число электронов, смещенных от атома данного элемента к другим атомам (при положительной окисленности) или от других атомов к атому данного элемента (при отрицательной окисленности). Для вычисления степени окисленности элемента в соединении следует исходить из следующих положений: 1 степени окисленности элементов в простых веществах принимаются равными нулю; 2 алгебраическая сумма степеней окисленности всех атомов, входящих в состав молекулы, равна нулю; 3 постоянную степень окисленности в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы 11А группы; цинк, кадмий (+2); 4 водород проявляет степень окисленности +1 во всех соединениях, кроме гидридов металлов (NaH, CaH Окислительно-восстановительными называются такие реакции, в результате которых изменяется степень окисленности одного или нескольких элементов, входящих в состав реагирующих веществ. Отдача атомом электронов, сопровождающаяся повышением его степени окисленности, называется окислением. Присоединение атомом электронов, приводящее к понижению его степени окисленности, называется восстановлением. Вещество, в которое входит окисляющийся элемент, называется восстановителем; вещество, содержащее восстанавливающийся элемент, называется окислителем. Так, в реакции: 4Al + 3 O алюминий повышает степень окисленности от 0 до +3 и служит восстановителем; в результате реакции восстановленная форма алюминия (свободный алюминий) окисляется и превращается в сопряженную с ней окисленную форму (алюминий в степени окисленности +3). Кислород в этой реакции понижает степень окисленности от 0 до -2 и служит окислителем; в результате реакции окисленная форма кислорода (свободный кислород) восстанавливается и превращается в сопряженную с ней восстановленную форму (кислород в степени окисленности -2). Оба процесса: окисление и восстановление - протекают одновременно. При этом общее число электронов, отданных восстановителем, равно общему числу электронов, принятых окислителем. В рассмотренной реакции взаимодействуют два вещества, из которых кислород - окислитель, а алюминий - восстановитель. Такие реакции относят к реакциям межмолекулярного окисления-восстановления. Реакция 4 Н служит примером реакций самоокисления-самовосстановления, в которых одновременно образуются соединения, содержащие данный элемент в более окисленном и в более восстановленном состоянии по сравнению с исходным; при этом исходное вещество проявляет функции как окислителя, так и восстановителя. В последней реакции фосфористая кислота (степень окисленности фосфора +3) выступает одновременно в роли окислителя, причем фосфор восстанавливается до степени окисленности -3 (РН Существуют еще реакции внутримолекулярного окисления-восстановления, в которых оба элемента: окислитель и восстановитель - находятся в одном и том же соединении. К таким реакциям относятся многие реакции термического разложения сложных веществ. ЗАДАЧИ 56-58 56.Определить степень окисленности серы в следующих соединениях; SO 57. Установить, какие из приведенных процессов представляют собой окисление и какие восстановление: S K 58. До каких продуктов может быть окислена вода: а) до О Окислители и восстановители Элементы, находящиеся в высшей степени окисленности, могут только восстанавливаться, так как их атомы способны лишь принимать электроны: сера в степени окисленности +6, азот в степенеи окисленности +5, марганец в степени окисленности +7, хром в степени окисленности +6. Элементы, находящиеся в низшей степени окисленности, могут только окисляться, поскольку их атомы способны лишь отдавать электроны: сера в степени окисленности -2, азот в степени окисленности -3 (аммиак и его производные), йод в степени окисленности -1 (НI и иодиды). Вещества, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью. Такие вещества способны и принимать и отдавать электроны, в зависимости от партнера, с которым они взаимодействуют, и от условий проведения реакции. Окислители 1. Окислительные свойства характерны для типичных неметаллов- галогенов, кислорода, серы в элементарном состоянии. Галогены, выступая в качестве окислителей, приобретают степень окисленности -1, причем от фтора к иоду окислительные свойства ослабевают. Кислород, восстанавливаясь, переходит в состояние окисленности (вода и гидроксид-ион). 2. Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся KMnO Перманганат калия, проявляя окислительные свойства за счет Mn (+7), восстанавливается до разных продуктов в зависимости от кислотности среды: в кислой среде - до Mn (+2), в нейтральной и слабощелочной - до Мn (+4), в сильнощелочной - до Мn (+6). Хромат и дихромат калия выступают в роли окислителей в кислой среде, восстанавливаясь до иона хрома (3+). Концентрированная серная кислота проявляет окислительные свойства за счет серы в степени окисленности +6, которая может восстанавливаться до степени окисленности +4 (диоксид серы), (свободная сера), -2 (сероводород). Состав продуктов восстановления определяется активностью восстановителя, а также соотношением количеств восстановителя и серной кислоты, концентрацией кислоты и температурой системы. Чем активнее восстановитель и выше концентрация кислоты, тем глубже протекает восстановление. Так, малоактивные металлы (Cu, Sb и др.), а также бромоводород и некоторые неметаллы восстанавливают серную кислоту до SO Активные металлы (Mg, Zn и др.) восстанавливают серную кислоту до свободной серы или сероводорода. Азотная кислота проявляет окислительные свойства за счет азота в степени окисленности +5, причем окислительная способность ее усиливается с ростом концентрации. В концентрированном состоянии азотная кислота окисляет большинство элементов до их высших степеней окисленности. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя и концентрации кислоты. Чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление азота: концентрация кислоты ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ NO ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® активность восстановителя Кислородсодержащие кислоты галогенов (НOCl, HClO 3. Водород в степени окисленности +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, стоящими в ряду напряжений до водорода): Mg + H 4. Ионы металлов, находящиеся в высшей степени окисленности, выполняя функцию окислителя, превращаются в ионы с более низкой степенью окисленности. Восстановители 1. Среди элементарных веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, цинк, алюминий, железо и др.), а также некоторые неметаллы- водород, углерод, фосфор, кремний. При этом в кислой среде металлы окисляются до положительно заряженных ионов, а в щелочной среде металлы, которые образуют амфотерные гидроксиды (например, цинк, алюминий, олово), входят в состав отрицательно заряженных анионов или гидроксокомплексов. Углерод чаще всего окисляется до СО или углекислого газа, а фосфор, при действии сильных окислителей, - до ортофосфорной кислоты. 2. В бескислородных кислотах (HCl, HBr, HI, H 3. Гидриды щелочных и щелочноземельных металлов, содержащие ион Н 4. Металлы в низшей степени окисленности (ионы Sn ЗАДАЧИ 59-60 59. На основе электронного строения атомов указать, могут ли быть окислителями: атомы натрия, катионы натрия, кислород в степени окисленности -2, иод в степени окисленности 0, фторид-ионы, катионы водорода, нитрит-ионы, гидрид-ионы. 60. Какие из перечисленных ниже веществ и за счет каких элементов проявляют обычно окислительные свойства, а какие - восстановительные? Указать те из них, которые обладают окислительно-восстановительной двойственностью: H
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 374; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.250.187 (0.008 с.) |

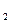 и др.), где его степень окисленности равна -1; 5 степень окисленности кислорода в соединениях равна -2, за исключением пероксидов (-1) и фторида кислорода OF
и др.), где его степень окисленности равна -1; 5 степень окисленности кислорода в соединениях равна -2, за исключением пероксидов (-1) и фторида кислорода OF 
 РО
РО 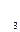 РО
РО  + РН
+ РН 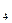 .
. SO
SO 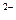 , S
, S  ,
, , Br
, Br  .
. CrO
CrO  .
. = MgSO
= MgSO  , Fe
, Fe 


