
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простейшие стехиометрические расчетыСодержание книги
Поиск на нашем сайте
Эквивалент. Закон эквивалентов. Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода в химических реакциях. Эквивалентной массой называется масса 1 эквивалента вещества. Для определения эквивалента (эквивалентной массы) необязательно исходить из его соединения с водородом. Их можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен. Согласно закону эквивалентов эквивалентные массы сложных веществ определяют по следующим формулам:
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества. Эквивалентный объем водорода равен 11,2 л/моль. ПРИМЕР 1. Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/ 2 моля и 1/ 3 моля. Исходя из мольных масс атомов этих элементов, находим эквивалентные массы этих элементов: у Br она равна 79,9 г/ моль, у кислорода – 16 × 1/2 = 8 г/ моль, у азота- 14 × 1/3 = 4,67 г / моль. ПРИМЕР 2. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти эквивалентную массу железа и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/ моль. Решение. Из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится 8,8 - 5,6 = 3,2 г серы. Согласно закону эквивалентов, массы взаимодействующих веществ, пропорциональны их эквивалентным массам. Тогда: 5,6 г железа эквивалентны 3,2 г серы, Э Из соотношения следует, что эквивалентная масса железа равна: 5,6 х 16/ 3,2= 28 г/ моль. Эквивалент железа равен: 28 г/моль: 56 г/ моль = 1/ 2. ПРИМЕР 3. Некоторое количество металла, эквивалентная масса которого равна 28 г/ моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла. Решение. Зная, что эквивалентный объем водорода равен 11,2 л/моль, составляем пропорцию: 28 г металла эквивалентны 11,2 л водорода Х г металла эквивалентны 0,7 л водорода. Тогда Х = 0,7 × 28 / 11,2 = 1,75 г. РЕШИТЬ САМОСТОЯТЕЛЬНО ЗАДАЧИ 1-3 1. При сгорании 5 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла. Ответ: 9,01 г/ моль. 2. Мышьяк образует два оксида, из которых один содержит 65,2%, а другой - 75,7% мышьяка. Определить эквивалентные массы As в обоих случаях. Ответ: 15 и 24,9 г / моль. 3. Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла? ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ. Состояние газа характеризуется его температурой, давлением и объемом. Если температура равна 273 К, а давление равно нормальному атмосферному (760 мм ртутного столба или 101, 325 кПа), то условия, при которых находится газ, называются нормальными. Закон Бойля-Мариотта формулируется так; При постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа: P ПРИМЕР 1. При некоторой температуре давление газа, занимающего объем 3 л, равно 93,3 кПа (700 мм рт. ст.). Каким станет давление газа, если, не изменяя температуры, уменьшить объем газа до 2,8 л? Решение. Обозначив искомое давление через P P Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре Т: V ПРИМЕР 2. При 27 Решение. По условию задачи V Подставляя эти значения в уравнение Гей-Люссака, получим: 600/ 300 = V Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля - Мариотта и Гей-Люссака: PV/ T = P В уравнении буквенные обозначения с индексом “0” относятся к нормальным условиям существования газа, а без индексов - к любым условиям.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.78.203 (0.006 с.) |

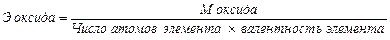 ;
; ;
; ;
; .
. O, NH
O, NH  .
. г/ моль 16 г серы.
г/ моль 16 г серы. V
V  / P
/ P  = V
= V  С объем газа 600 мл. Какой объем займет газ при 57
С объем газа 600 мл. Какой объем займет газ при 57  = 600 × 330/ 300 = 660 мл.
= 600 × 330/ 300 = 660 мл. V
V 


