
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Слабые электролиты. Константа и степень диссоциацииСодержание книги
Поиск на нашем сайте
При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы - катионы и анионы. Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие: СН константа которого (константа диссоциации) связана с концентрациями соответствующих частиц соотношением: К= Степенью диссоциации В случае электролита АХ, диссоциирующего на ионы А К = a Здесь СМ - молярная концентрация электролита, моль/ л. Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять 1- a К= Последнее соотношение показывает, что при разбавлении раствора с уменьшением концентрации степень диссоциации электролита возрастает. Если в растворе электролита АХ степень его диссоциации равна [ A Для расчетов, связанных с диссоциацией кислот, часто пользуются не константой К, а так называемым константы диссоциации рК, который определяется соотношением: рК = -lg K. Очевидно, что с возрастанием К, т.е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислоты. ПРИМЕР 1. Степень диссоциации уксусной кислоты в 0,1 М раствораравна 1,32 × 10 Решение. Проведем расчет по приближенной формуле и подставим в нее известные из условия величины: К = Откуда: рК = - lgK = 4,76 При введении в раствор слабого электролита одноименных ионов равновесие нарушается и смещается в сторону образования недиссоциированных молекул, так что степень диссоциации уменьшается.
В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие отдельным стадиям диссоциации. Так, диссоциация ортофосфорной кислоты протекает в три ступени, а серной - в две ступени. Каждой ступени отвечает своя константа диссоциации. ЗАДАЧИ 46-47 46. Степень диссоциации угольной кислоты Н 47. Вычислить концентрацию ионов Н
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 299; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.217.176 (0.009 с.) |

 СООН
СООН 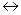 Н
Н  + СН
+ СН 


 электролита называется доля его молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
электролита называется доля его молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.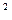 × С
× С  / (1-a).
/ (1-a). 1. Тогда выражение закона разбавления упрощается:
1. Тогда выражение закона разбавления упрощается:
 . Найти константу диссоциации кислоты и значение рК.
. Найти константу диссоциации кислоты и значение рК. .
.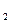 СО
СО  . Вычислить К
. Вычислить К  .
.


