
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетика химических реакций.Содержание книги
Поиск на нашем сайте
К важнейшим величинам, характеризующим химические системы, относятся внутрення энергия U, энтальпия Н, энергия Гиббса (изобарно-изотермический потенциал) G. Все эти величины представляют собой функции состояния, т.е. зависят только от состояния системы, а не от способа, которым это состояние достигнуто. Протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (DU<0), то реакция протекает с выделением энергии (экзотермическая реакция). Если же внутренняя энергия системы возрастает (DU>0), то процесс сопровождается поглощением энергии из внешней среды (эндотермическая реакция). Если в результате протекания химической реакции система поглотила количество теплоты Q и совершила работу А, то изменение внутренней энергии определяется уравнением: DU = Q - A Согласно закону сохранения энергии, DU зависит от начального и конечного состояния системы, но не зависит от способа осуществления реакции. Если реакция протекает при постоянном объеме (DV=0, изохорный процесс), то работа расширения системы (А= Р* DV) равна нулю. Если при этом не совершаются и другие виды работ (например, электрическая), то DU=Qn, где Q n-тепловой эффект реакции, (т.е. количество поглощенной системой теплоты), протекающей при постоянном объеме. В случае экзотермической реакции тепловой эффект меньше нуля, а для эндотермической реакции тепловой эффект больше нуля. Для реакций, протекающих при постоянном давлении (изобарный процесс), можно записать уравнение: DН= DU + P* DV, т.е. изменение энтальпии равно сумме изменения внутренней энергии и совершенной работы расширения. Если при этом никакие другие виды работ не совершаются, то DН = Qр. Для экзотермической реакции тепловой эффект меньше нуля, а для эндотермической реакции - больше нуля. Стандартным состоянием вещества при данной температуре называется его состояние при давлении, равном атмосферному давлению (101,325 кПа = 760 мм рт.ст.). Условия, при которых все участвующие в реакции вещества находятся в стандартном состоянии, называются стандартными условиями протекания реакции. Отнесенные к стандартным условиям изменения соответствующих величин называются стандартными изменениями и их обозначения имеют верхний индекс 0. Стандартная энтальпия реакции образования 1 моля данного вещества из простых веществ называется стандартной энтальпией образования этого вещества, имеющeй размерность кДж/ моль. Химические реакции, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, уравнение: Рb О (к) + СО (г) = Рb (к) + СО2 (г) + 64 кДж Закон Гесса для термохимических расчетов: Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса. ПРИМЕР 1. Исходя из теплоты образования газообразного диоксида углерода (DНо= - 393,5 кДж/ моль) и термохимического уравнения: С (графит)+2 N2 O (г) = СО2 (г)+2 N Вычислить теплоту образования N Решение. Обозначив искомую величину через Х, запишем термохимическое уравнение образования N2 О из простых веществ: N Запишем также термохимическое уравнение образования СО С(графит) + О2 (г) = СО2 (г); DН Из уравнений (2) и (3) можно получить уравнение (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из уравнения (3). Имеем: С(графит) + 2 N DН Сравнивая уравнения (1) и (4), находим: -393,5 - 2Х = - 557,5, откуда Х= 82,0 кДж/ моль. ПРИМЕР 2. Определить знаки DН, DS, DG для реакции: АВ (к) + В протекающей при температуре 298 К в прямом направлении. Как будет изменяться значение DG с ростом температуры? Решение. Самопроизвольное протекание реакции указывает на то, что для нее DG < 0. В результате реакции общее число частиц в системе уменьшается, причем расходуется газ В ЗАДАЧИ 27-30 27. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать теплоту образования сульфида железа.. 28. При восстановлении 12,7 г оксида меди (11) углем (с образованием СО) поглощается 8,24 кДж. Определить D Н0298 образования CuO. 29. Сожжены с образованием воды (газ) равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? 30. Объяснить, почему процессы растворения веществ в воде могут самопроизвольно протекать не только с экзотермическим, но и с эндотермическим эффектом?
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 677; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.100 (0.007 с.) |

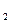 (г); DН
(г); DН  = -557,5 кДж (1)
= -557,5 кДж (1) (к),
(к),


