
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические источники электрической энергии. Электродные потенциалыСодержание книги
Поиск на нашем сайте
Если окислительно-восстановительную реакцию (ОВР) осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то по внешней цепи возникнет направленное перемещение электронов - электрический ток. При этом энергия химической ОВР превращается в электрическую энергию. Устройства, в которых происходит такое превращение называются химическими источниками электрической энергии - гальваническими элементами. Всякий гальванический элемент состоит из двух электродов - металлов, погруженных в растворы электролитов; последние сообщаются друг с другом - обычно через пористую перегородку. Электрод, на котором происходит процесс окисления, называется анодом; электрод, на котором осуществляется процесс восстановления, - катодом. При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов - двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция Zn + 2 AgNO изображается следующим образом: Zn Эта же схема может быть изображена в ионной форме: Zn В данном случае металлические электроды непосредственно участвуют в происходящей реакции. На аноде цинк окисляется Zn = Zn и в форме ионов переходит в раствор, а на катоде серебро восстанавливается Ag и в виде металла осаждается на электроде. Складывая уравнения электродных процессов (с учетом числа принимаемых и отдаваемых электронов), получаем суммарное уравнение реакции: Zn + 2 Ag В других случаях металл электрода не претерпевает изменений в ходе электродного процесса, а участвует лишь в передаче электронов от восстановленной формы вещества к его окисленной форме. Так, в гальваническом элементе: Pt роль инертных электродов играет платина. На платиновом аноде окисляется железо (II): Fe а на платиновом катоде восстанавливается марганец (VII): MnO Умножив первое из этих уравнений на пять и сложив со вторым, получаем суммарное уравнение протекающей реакции: 5 Fe Максимальное напряжение гальванического элемента (ГЭ), отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (э.д.с.) элемента. если реакция осуществляется в стандартных условиях, т.е, если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то э.д.с. называется стандартной электродвижущей силой Е Э.д.с. ГЭ может быть представлена как разность двух электродных потенциалов, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Так для рассматриваемого серебряно-цинкового элемента э.д.с. выражается разностью: E = При вычислении э.д.с. меньший (в алгебраическом смысле) электродный потенциал вычитается из большего. Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста:
Здесь Например, для электродного процесса Fe z= 1; [Ox]= [Fe Для полуреакции MnO z= 5, [Ox] = [MnO При осуществлении процесса в стандартных условиях концентрация (активность) каждого вещества, участвующего в реакции равна единице, так что логарифмический член уравнения Нернста обращается в нуль и, следовательно:
Таким образом, стандартным электродным потенциалом называется потенциал данного электрода при концентрациях (активностях) всех веществ, участвующих в электродном процессе, равных единице. Применительно к рассмотренным выше примерам электродных процессов уравнение Нернста после подстановки в него значений R, F и T приобретает следующий вид:
В последнем из приведенных примеров, как и в других случаях, когда в электродном процессе участвует вода, электродный потенциал зависит от концентрации ионов Н В качестве электрода сравнения, стандартный потенциал которого считается равным нулю, принят стандартный водородный электрод, на котором осуществляется процесс: 2Н При активности (концентрации) ионов водорода, равной единице (рН = 0), и парциальном давлении газообразного водорода, равном нормальному атмосферному давлению, условно принимаемому за единицу. При изменении концентрации ионов водорода при постоянстве парциального давления водородного электрода изменится и при температуре 298 К его величина будет равна из уравнения Нернста
(рН =7)
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |

 = Zn(NO
= Zn(NO  )
) 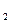 + 2 Ag,
+ 2 Ag, Zn (NO
Zn (NO 

 Ag
Ag 

 Fe
Fe 
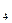 , Mn
, Mn  ,
, данного элемента.
данного элемента.
 -
-  .
.
 lg
lg  .
. , [Red] = [Mn
, [Red] = [Mn  I Zn
I Zn
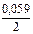 lg [Zn
lg [Zn 


 -,Mn
-,Mn 

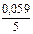 ´
´ lg
´
´ lg 
 или без учета коэффициента активности
или без учета коэффициента активности


