
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения содержания растворенного вещества в растворе. РастворимостьСодержание книги
Поиск на нашем сайте
Содержание растворенного вещества в растворе может быть выражено либо безразмерными величинами-долями или процентами, либо величинами размерными - концентрациями. Далее приведены употребляемые в химии способы выражения содержания растворенного вещества в растворе:
ПРИМЕР 1. Найти массы воды и медного купороса CuSO4× 5Н2О, необходимые для приготовления одного литра раствора, содержащего 8% (масс.) безводной соли. Плотность 8% раствора СuSO4 равна 1,084 г/ мл. Решение. Масса 1 л полученного раствора будет составлять 1,084 × 1000 = 1084 г. В этом растворе должно содержаться 8% безводной соли, т. е. 1084 × 0,08 = 86,7 г. Массу CuSO 249,7: 159,6 = Х: 86,7; Х = 249, 7 × 86,7 / 159,6 = 135,6 г. Необходимая для приготовления масса воды составит: 1084 - 135,6 = 948,4 г. ПРИМЕР 2. Найти моляльность, нормальность и молярность 15%-ного (по массе) раствора Н Решение. Для вычисления моляльности найдем сначала массу серной кислоты, приходящуюся на 100 г воды: 1000: 85 = Х: 15; X = 15 × 1000/ 85 = 176,5 г. Мольная масса серной кислоты равна 98г/ моль; следовательно: m = 176,5 / 98 = 1,80 моль/ кг. Для расчета нормальности и молярности раствора найдем массу серной кислоты, содержащуюся в 1000 мл (т.е. в 1000 × 1,1 = 1100 г) раствора: 1100: 100 = У: 15; У = 1100 × 15/ 100 = 165 г Эквивалентная масса серной кислоты равна 49 г./ моль. Следовательно: С Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твердых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. Растворимость газов часто характеризуют коэффициентом абсорбции, который выражает объем газа, растворяющегося в одном объеме растворителя с образованием насыщенного раствора. Согласно закону Генри, объем растворяющегося газа (а, значит, и коэффициент абсорбции) не зависит при данной температуре от парциального давления газа. ПРИМЕР 3. Коэффициенты абсорбции кислорода и азота при 273 К равны соответственно 0,049 и 0,023. Газовую смесь, содержащую 20% (об.) кислорода и 80% (об.) азота, взболтали с водой при 273 К до получения раствора. Найти процентное соотношение по объему растворенных в воде газов. Решение. По условию задачи в 1 л воды растворяется 49 мл кислорода и 23 мл азота. Однако непосредственно сравнивать эти объемы нельзя, так как парциальные давления растворенных газов различны и составляют соответственно 0,2 и 0,8 от общего давления газовой смеси. Если принять последнее за единицу, то объемы растворенных кислорода и азота, приведенные к этому давлению, будут равны: 49 × 0,2= 9,8 мл О тогда общий объем растворенных газов составит: 9,8 + 18,4 = 28,2 мл. Находим процентное содержание каждого газа: 9,8 × 100 / 28,2 = 35 % (об.) O ЗАДАЧИ 37-42 37. Сколько граммов Na 38. Сколько граммов 30%-ного (по массе) раствора NaCl нужно добавить к 300 г воды, чтобы получить 10%-ный раствор соли? 39.Плотность 26%-ного (по массе) раствора КОН равна 24 г/ мл. Сколько молей КОН находится в 5 л раствора? 40. Растворимость хлорида кадмия при 293 К равна 114,1 г в 100 г воды. Вычислить массовую долю и моляльность CdCl 41. Сколько граммов Na 42. Газовую смесь, содержащую 40% (об.) N
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 310; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.198 (0.008 с.) |

 )
)
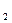 = n
= n 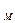 или М)
или М)
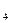 × 5 Н
× 5 Н  = 165/ 49 = 3,37 н. и См = 165/ 98 = 1,68 моль/ л.
= 165/ 49 = 3,37 н. и См = 165/ 98 = 1,68 моль/ л. потребуется для приготовления 5 л 8%-ного (по массе) раствора (плотность r= 1,075 г/ мл)?
потребуется для приготовления 5 л 8%-ного (по массе) раствора (плотность r= 1,075 г/ мл)?


