
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составление уравнений окислительно-восстановительныхСодержание книги
Поиск на нашем сайте
Реакций При составлении уравнений окислительно-восстановительных реакций рекомендуется придерживаться такого порядка: 1. Составить схему реакции с указанием исходных и образующихся веществ, отметить элементы, изменяющие в результате реакции степень окисленности, найти окислитель и восстановитель. 2. Составить схему полуреакций окисления и восстановления с указанием исходных и образующихся реально существующих в условиях реакции ионов или молекул. 3. Уравнять число атомов каждого элемента в левой и правой частях полуреакций; при этом нужно помнить, что в водных растворах в реакциях могут участвовать молекулы воды, ионы Н 4. Уравнять суммарное число зарядов в обеих частях каждой полуреакции: для этого прибавить к левой и правой частям полуреакций необходимое число электронов. 5. Подобрать множители (основные коэффициенты) для полуреакций так, чтобы число электронов отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении. 6. Сложить уравнения полуреакций с учетом найденных основных коэффициентов. 7. Расставить коэффициенты в полном уравнении реакции. Следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных - молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде - за счет гидроксид-ионов с образованием молекул воды. ПРИМЕР 1. Составить уравнение реакции восстановления оксида железа (III) углем. Реакция протекает по схеме: Fe Решение. Железо восстанавливается, понижая степень окисленности с +3 до 0; углерод окисляется повышая степень окисленности от 0 до +2. Составим схемы эти процессов, указывая степень окисленности элементов римскими цифрами (в отличие от зарядов ионов): Fe+3 + 3 e C Отношение числа электронов, участвующих в восстановлении и окислении равно 3: 2. Следовательно, в реакции каждые два атома железа восстанавливаются тремя атомами углерода. Конечная реакция будет иметь вид:
Fe ЗАДАЧИ 61-63 61. Составить уравнения полуреакций окисления и восстановления для следующих реакций и определить, в каких случаях водород служит окислителем и в каких - восстановителем: a) 2 Al + 6 HCl = 3 AlCl б) 2 H в) 2 Na + 2 H г) BaH 62. Закончить уравнения реакций, в которых окислителем служит концентрированная серная кислота: a) HBr + H в) Mg + H 63. Закончить уравнения реакций внутримолекулярного окисления-восстановления. Какой атом или ион выполняет в каждом случае роль окислителя, какой - восстановителя? a) CuI в) KClO
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.107.223 (0.005 с.) |

 или ОН
или ОН  .
.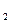 O
O  + C
+ C  Fe + CO.
Fe + CO. ½ 2
½ 2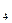
 Br
Br  CuI + I
CuI + I 


