
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В задачниках и справочниках по химии приведены таблицы электродных потенциалов для некоторых электрохимических систем, измеренных по отношению к стандартному водородному электроду.Содержание книги
Поиск на нашем сайте Чем меньше в алгебраическом смысле значение ПРИМЕР 1. Определить э.д.с. гальванического элемента: Ag В каком направлении будут перемещаться электроны по внешней цепи при работе этого элемента? Решение. Стандартный электродный потенциал системы Ag
Вычисляем э.д.с. элемента: Е = Поскольку ЗАДАЧИ 64-66 64. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO 65. Э.д.с. элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли э.д.с., если взять 0,001 М растворы? Ответ обосновать. 66. Гальванический элемент состоит из стандартного водородного электрода, погруженного в раствор с рН = 12. На каком электроде водород будет окисляться при работе элемента, а на каком - восстанавливаться? Рассчитать э.д.с. элемента. При работе гальванического элемента электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, а с более низким - в качестве восстановителя. Как и в любых других самопроизвольно протекающих процессах, реакция в ГЭ сопровождается уменьшением энергии Гиббса. Это означает, что при непосредственном взаимодействии реагирующих веществ реакция будет протекать в том же направлении. Таким образом, сопоставляя электродные потенциалы соответствующих систем можно заранее определять направление, в котором будет протекать окислительно-восстановительная реакция. 67. Указать, в каком направлении могут самопроизвольно протекать следующие реакции: a) H б) 2НJO в) J
Ответы к задачам контрольного задания
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |


 , тем сильнее выражены восстановительные свойства соответствующей электрохимической системы; напротив, чем больше это значение, тем более сильными окислительными свойствами характеризуется система.
, тем сильнее выражены восстановительные свойства соответствующей электрохимической системы; напротив, чем больше это значение, тем более сильными окислительными свойствами характеризуется система. AgNO
AgNO  (0,001M)
(0,001M)  AgNO
AgNO  /Ag равен 0,80 В. Обозначив потенциал левого элемента через
/Ag равен 0,80 В. Обозначив потенциал левого элемента через  , а правого - через
, а правого - через 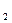 , находим:
, находим:
 , 56%
, 56% 
 г
г



 =0,0164 моль/л
=0,0164 моль/л  =0,0045 моль/л
=0,0045 моль/л

 моль/л
моль/л
 моль/л
моль/л

 = 0,0144;
= 0,0144;
 моль/л
моль/л
 моль/л
моль/л

 моль/л
моль/л

 моль/л
моль/л  моль/л
моль/л
 , 0,6 г
, 0,6 г 
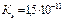 ; рН=7,59; h=
; рН=7,59; h= 
 ;рН=5,63 h=
;рН=5,63 h= 
 ; 1,92 Дебай
; 1,92 Дебай
 -
-
 =-2100,3 кДж/моль
=-2100,3 кДж/моль
 моль/л
моль/л



