
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химических реакций. Химическое равновесиеСодержание книги
Поиск на нашем сайте
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема (в гомогенной реакции) или на единицу площади поверхности раздела фаз (для гетерогенных реакции). В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени. Скорость зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул и атомов), зависимость скорости реакции от концентрации определяется. Законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, для реакции типа А + В V = k [A] × [B В этом уравнении [A] и [B При гетерогенных реакциях концентрации веществ, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс. ПРИМЕР 1. Написать выражения закона действия масс для реакций: а) 2 NO (г) + Cl в) CaCO Решение: а) V= к[NO] × [Cl б) Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид: V = к, т.е. в данном случае скорость реакции при определенной температуре постоянна. Зависимость скорости реакции (или константы скорости) от температуры может быть выражено уравнением: V Здесь V ПРИМЕР 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75 Решение. Поскольку разность температур V Это значит, что скорость реакции увеличится в 287 раз при подъеме температуры на 55 градусов. При изменении условий протекания реакции (температуры, давления, концентрации какого либо компонента из участвующих в реакции веществ) скорости прямого и обратного процессов в обратимых реакциях изменяются неодинаково, химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесному состоянию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено. Так, повышение температуры проводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции. ПРИМЕР 3. В каком направлении сместится равновесие в системах: а) СО (г) + Сl б) Н если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси? Решение. а) Протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакции. б) Протекание реакции не сопровождается изменением числа молей газа и не приводит, следовательно, к изменению давления. В данном случае изменение давления не вызывает смещения равновесия. Константа равновесия Кт химической реакции связана со стандартным изменением энергии Гиббса DG 0т уравнением: DG 0т = - 2,3 RT lg Kт. При 298 К (25 DG 0 где изменение энергии Гиббса выражено в кДж / моль. ЗАДАЧИ 31-36 31. Во сколько раз изменится скорость реакции 2А + В 32. При 423 К некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если ее проводить: а) при 473 К; б) при 353 К. 33. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации ее уменьшить на 4 кДж/ моль? 34. Константа равновесия реакции А(г) + В (г) «С(г) + Д(г) равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В? 35.Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции: СО 36. Почему во многих случаях реакция практически не протекает, хотя изменение энергии Гиббса реакции отрицательно? Какими способами можно добиться в таких случаях протекания реакции? РАСТВОРЫ
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.166.207 (0.007 с.) |

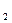
 АВ
АВ  (к)
(к)  / V
/ V  = k t+10/ k t = g.
= k t+10/ k t = g. C?
C? t = 55
t = 55 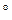 , получим:
, получим: = - 5,69 lg K
= - 5,69 lg K 


