
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь. Типы химической связиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Описание химической связи в любой молекуле есть, по существу, описание характера распределения в ней электронной плотности. По характеру этого распределения химические связи подразделяют на ковалентную, ионную и металлическую. Ковалентная связь - химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов (Н Ионная связь - результат электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками (Cs + F-, Na + Cl -). Чисто ионная связь представляет собой предельный случай. В большинстве молекул химические связи имеют промежуточный характер между чисто ковалентными и чисто ионными связями. Если смещение общей пары электронов невелико от каждого атома, то связь по своему характеру ближе к ковалентной, а при большом смещении пары электронов к какому-либо атому связь ближе к ионной связи. Для оценки способности атома данного элемента притягивать к себе электроны, осуществляющие связь, пользуются значением относительной электроотрицательности (c). Чем больше электроотрицательность атома, тем сильнее притягивает он обобществленные электроны. Существует правило: чем больше разность электроотрицательностей элементов в молекуле, тем выше ионность связи. Значения электроотрицательностей атомов некоторых элементов по отношению к электроотрицательности фтора, принятой равной 4,0, приведены в таблице 1.
Таблица 1. Относительная электроотрицательность атомов
ПРИМЕР 1. Вычислить разность относительных электроотрицательностей атомов для связей Н-О и О-Э в соединениях Э (ОН) Решение. По данным таблицы 1 вычисляем для связей О- Э разность электроотрицательностей: Dc MgO = 3,5- 1,2= 2,3; Dc СaO = 3,5- 1,04= 2,46; Dc SrO = 3,5-0,99 = =2,51. Разность электроотрицательностей для связи О-Н составляет 1,4.
Таким образом: а) во всех рассмотренных молекулах связь Э-О более полярна, то-есть характеризуется большей степенью ионности; б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой: Э (ОН) +2 ОН ЗАДАЧИ 19-21 19. Вычислить разность электроотрицательностей для связей K-Cl, Ca-Cl, Fe-Cl, Ge-Cl. Какая из связей характеризуется наибольшей степенью ионности? 20. Вычислить разность относительных электроотрицательностей атомов для связей Н- О и О- As. Какая из этих связей более полярна? К какому классу гидроксидов относится As (OH) 21.Объяснить с позиций метода валентных связей способность оксидов NO и NO
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 680; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.75.92 (0.011 с.) |

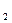 , Cl
, Cl  +
+ ; следовательно, все рассматриваемые соединения будут диссоциировать по типу оснований.
; следовательно, все рассматриваемые соединения будут диссоциировать по типу оснований. ?
?


