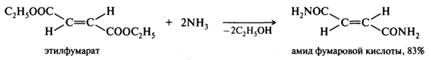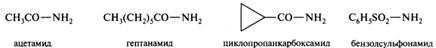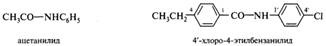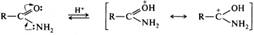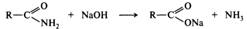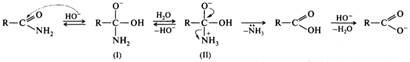Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сложными эфирами называются функциональные производные карбоновых кислот обшей формулы RC(О)ОR'. Сложные эфиры карбоновых кислот (а также сульфоновых кислот) называют аналогично солям, только вместо названия катиона употребляют название соответствующего алкила или арила, которое помещается перед названием аниона и пишется с ним слитно. Наличие сложноэфирной группы —COOR также можно отразить описательным способом, например, «R-овый эфир (такой-то) кислоты» (такой способ менее предпочтителен ввиду его громоздкости):
Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости, с приятным запахом, плохо растворимые в воде и хорошо — в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов, благодаря чему в пищевой промышленности из них готовят эссенции, имитирующие фруктовые запахи. Повышенную летучесть сложных эфиров используют в аналитических целях. Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
Реакция осуществляется как в кислой, так и в щелочной среде. Кислотно-катализируемый гидролиз сложных эфиров — реакция, обратная этерификации, протекает по тому же самому механизму ААС2:
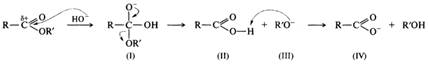
Нуклеофилом в этой реакции является вода. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды. Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т. е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Гидролиз сложных эфиров в щелочной среде протекает по бимолекулярному ацильному механизму В АС2 через стадию образования тетраэдрического интермедиата (I). Необратимость щелочного гидролиза обеспечивается практически необратимым кислотно-основным взаимодействием карбоновой кислоты (II) и алкоксид-иона (III). Образовавшийся анион карбоновой кислоты (IV) сам является довольно сильным нуклеофилом и потому не подвергается нуклеофильной атаке.
Аммонолиз сложных эфиров. Амиды получают с помощью аммонолиза сложных эфиров. Например, при действии водного аммиака на диэтилфумарат образуется полный амид фумаровой кислоты:
При аммонолизе сложных эфиров аминами с низкой нуклеофильностью последние предварительно превращают в амиды щелочных или щелочно-земельных металлов:
Амиды карбоновых кислот: номенклатура; строение амидной группы; кислотно–основные свойства; кислотный и щелочной гидролиз; расщепление гипобромитами и азотистой кислотой; дегидратация в нитрилы; химическая идентификация. Амидами называются функциональные производные карбоновых кислот обшей формулы R—С(О)—NH2-nR'n, где п = 0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, в N-замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N,N-замещенных — двумя. Соединения, содержащие одну, две или три ацильные группы, присоединенные к атому азота, носят родовое название амиды (соответственно первичные, вторичные и третичные). Названия первичных амидов с незамещенной группой — NH2 производят от названий соответствующих ацильных радикалов заменой суффикса -оил (или -ил) на -амид. Амиды, образованные от кислот с суффиксом -карбоновая кислота, получают суффикс -карбоксамид. Амиды сульфоновых кислот также называют по соответствующим кислотам, используя суффикс -сулъфонамид.
Названия радикалов RCO—NH— (как и RSО2—NH—) образуют от названий амидов, изменяя суффикс -амид на -амидо-. Они применяются в том случае, если в остальной части молекулы имеется более старшая группа или замещение происходит в более сложной структуре, чем радикал R:
В названиях N-замещенных первичных амидов RCO—NHR' и RCO—NR'R" (а также подобных сульфонамидов) названия радикалов R' и R" указывают перед названием амида с символом N-:
Амиды такого типа часто называют вторичными и третичными амидами, что ИЮПАК не рекомендуется. N-Фенилзамещенные амиды получают в названиях суффикс -анилид. Положение заместителей в остатке анилина указывается цифрами со штрихами:
Сохранились, кроме того, полусистематические названия, в которых суффикс -амид соединен с основой латинского названия карбоновой кислоты (формамид, ацетамид), а также некоторые тривиальные названия, такие, как «анилиды» (ацилированные анилины) или «толуидиды» (ацилированные толуидины).
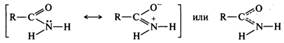
Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из них в качестве производных для идентификации карбоновых кислот. В редких случаях являются жидкостями, например, амиды муравьиной кислоты — формамид и N,N-диметилформамид — известные диполярные апротонные растворители. Низшие амиды хорошо растворимы в воде. Амиды являются одними из самых устойчивых к гидролизу функциональных производных карбоновых кислот, благодаря чему широко распространены в природе. Многие амиды применяются в качестве лекарственных средств. Уже около века используются в медицинской практике парацетамол и фенацетин, являющиеся замещенными амидами уксусной кислоты. Строение амидов. Электронное строение амидной группы в значительной степени сходно со строением карбоксильной группы. Амидная группа является p,π-сопряженной системой, в которой неподеленная пара электронов атома азота сопряжена с электронами π-связи С=O. Делокализация электронной плотности в амидной группе может быть представлена двумя резонансными структурами:
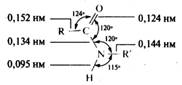
За счет сопряжения связь С—N в амидах имеет частичнодвоесвязанный характер, длина ее существенно меньше длины одинарной связи в аминах, тогда как связь С=O несколько длиннее, чем связь С=O в альдегидах и кетонах. Амидная группа из-за сопряжения имеет плоскую конфигурацию. Ниже приведены геометрические параметры молекулы N-замещенного амида, установленные с помощью рентгеноструктурного анализа:
Важным следствием частично двоесвязанного характера связи С—N является довольно высокий энергетический барьер вращения вокруг этой связи, например, для диметилформамида он составляет 88 кДж/моль. По этой причине амиды, имеющие у атома азота разные заместители, могут существовать в виде π-диастереомеров. N-Замещенные амиды существуют преимущественно в виде Z-изомеров:
В случае N,N-дизамещенных амидов соотношение Е- и Z-изомеров зависит от объема радикалов, соединенных с атомом азота. Стереоизомеры амидов конфигурационно неустойчивы, их существование доказано в основном физико-химическими методами, в индивидуальном виде они выделялись лишь в отдельных случаях. Это связано с тем, что барьер вращения для амидов все-таки не такой высокий, как у алкенов, у которых он составляет 165 кДж/моль. Кислотно-основные свойства. Амиды обладают слабыми как кислотными, так и основными свойствами. Основность амидов лежит в пределах значений РkBH+ от -0,3 до -3,5. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот. Такого рода взаимодействие лежит в основе кислотного катализа в реакциях гидролиза амидов:
Незамещенные и N-замещенные амиды проявляют слабые NH-кислотные свойства, сравнимые с кислотностью спиртов и отщепляют протон только в реакциях с сильными основаниями. Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров. Преобладание того или иного типа определяется строением амида. Например, N-метилацетамид, для которого предпочтительна Z-конфигурация, образует линейный ассоциат, а лактамы, имеющие жестко зафиксированную E-конфигурацию, образуют димеры:
N, N-Дизамещенные амиды образуют димеры за счет диполь-дипольного взаимодействия 2х полярных молекул:
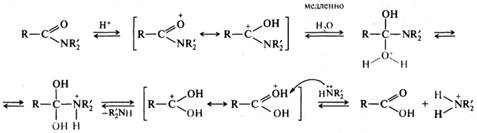
Реакции ацилирования. Вследствие наличия в сопряженной системе амидов сильной электронодонорной аминогруппы электрофильность карбонильного атома углерода, а следовательно, и реакционная способность амидов в реакциях ацилирования очень низкая. Низкая ацилирующая способность амидов объясняется также и тем, что амид-ион NH2- — плохая уходящая группа. Из реакций ацилирования значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров. Кислотный гидролиз амидов — необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
В большинстве случаев кислотный гидролиз амидов протекает по механизму бимолекулярного кислотного ацилирования ААС2, т. е. похож на механизм кислотного гидролиза сложных эфиров. Необратимость реакции обусловлена тем, что аммиак или амин в кислой среде превращаются в ион аммония, не обладающий нуклеофильными свойствами:
Щелочной гидролиз тоже необратимая реакция; в результате ее образуются соль карбоновой кислоты и аммиак или амин:
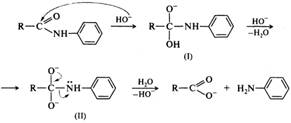
Щелочной гидролиз амидов, как и гидролиз сложных эфиров, протекает по тетраэдрическому механизму В АС2. Реакция начинается с присоединения гидроксид-иона (нуклеофила) к электрофильному атому углерода амидной группы. Образовавшийся анион (I) протонируется по атому азота, и далее в биполярном ионе (II) формируется хорошая уходящая группа — молекула аммиака или амина. Полагают, что медленная стадия - распад тетраэдрического интермедиата (II).
Для анилидов и других амидов с электроноакцепторными заместителями у атома азота распад тетраэдрического интермедиата (I) может проходить через образование дианиона (II):
Расщепление азотистой кислотой. При взаимодействии с азотистой кислотой и другими нитрозирующими агентами амиды превращаются в соответствующие карбоновые кислоты с выходами до 90%:
Дегидратация. Незамещенные амиды под действием оксида фосфора(V) и некоторых других реагентов (РОС13, РС15, SOCl2) превращаются в нитрилы:
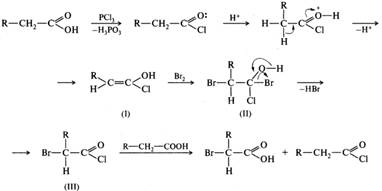
47. Карбоновые кислоты: галогенирование по Геллю-Фольгарду-Зелинскому, использование реакции для синтеза a -гидрокси и a -аминокислот. Галогенирование алифатических карбоновых кислот. Алифатические карбоновые кислоты галогенируются в α-положение хлором или бромом в присутствии каталитических количеств красного фосфора или галогенидов фосфора (реакция Гелля-Фольгарда-Зелинского). Например, при бромировании гексановой кислоты в присутствии красного фосфора или хлорида фосфора(III) с высоким выходом образуется 2-бромогексановая кислота, например:
Бромированию подвергается не сама карбоновая кислота, а образующийся из нее in situ хлорангидрид. Хлорангидрид обладает более сильными, чем карбоновая кислота, СН-кислотными свойствами и легче образует енольную форму. Енол (I) присоединяет бром с образованием галогенопроизводного (II), которое в дальнейшем отщепляет галогеноводород и превращается в α-галогенозамещенный галогенангидрид (III). На последнем этапе происходит регенерирование галогенангидрида незамещенной карбоновой кислоты.
Из образующихся α-галогенозамещенных кислот с помощью реакций нуклеофильного замещения синтезируют другие гетерофункциональные кислоты.
|
||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 2895; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.53.35 (0.011 с.) |