Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства аминокислот с удаленными функциональными группами.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Аминокислоты этого типа по химическим свойствами во многом напоминают гидроксикислоты с аналогичным расположением функциональных групп. γ- и δ-Аминокислоты. Специфической реакцией, протекающей при нагревании γ- и δ-аминокислот, является внутримолекулярное взаимодействие функциональных групп с образованием циклических амидов — лактамов. Этому способствует возможность для исходных аминокислот принимать клешневидную конформацию, а также термодинамическая устойчивость образующихся пяти- и шестичленного циклов.
В номенклатуре лактамов применяется тот же принцип, что и для лактонов, только с использованием суффикса -лактам (вместо -лактон или -олид). Кроме того, лактамы часто называются как оксопроизводные азотсодержащих гетероциклов. γ- и δ-Лактамы являются типичными амидами и могут быть гидролизованы в соответствующие аминокислоты нагреванием с растворами сильных кислот или щелочей.
β-Аминокислоты. Эти соединения при нагревании до 200 °С отщепляют молекулу аммиака, превращаясь в α,β-ненасыщенные кислоты. Элиминирование аммиака наблюдается в щелочной среде уже при 37 °С.
В этом отношении β-аминокислоты напоминают β-гидроксикислоты. Внутри- и межмолекулярное ацилирование аминогруппы здесь также не происходит вследствие неустойчивости четырех- или восьмичленного циклов. Однако четырехчленные циклические амиды (β-лактамы) образуются в мягких условиях при внутримолекулярном ацилировании в присутствии карбодиимидов:
Несмотря на гидролитическую нестабильность β-лактамного цикла, он является структурным фрагментом природных антибактериальных средств пенициллинов и цефалоспоринов, относящихся к группе β-лактамных антибиотиков.
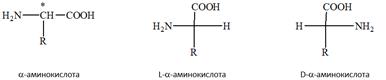
54. α – Аминокислоты, входящие в состав белков, номенклатура. Классификация, стереоизомерия. Амфотерность, биполярная структура; химические свойства как гетерофункциональных соединений; реакции определения аминокислот. Наиболее распространенными в природе и биологически значимыми являются α-аминокислоты, имеющие общую формулу и отличающиеся друг от друга только строением радикала R.
Они представляют собой структурные элементы многих природных соединений, главным образом белков. В настоящее время известно свыше 300 природных α-аминокислот, из которых только около 25 обнаружены в белках, а 20 аминокислот входят практически во все белковые молекулы, они получили название протеиногенных. Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе трансляции.
Все алифатические аминокислоты, за исключением глицина (аминоуксусной кислоты) и ω-аминокислот (буква ω означает положение заместителя на конце углеродной цепи), содержат асимметрический атом углерода и могут поэтому существовать в виде стереоизомеров (в простейшем случае — энантиомеров). В номенклатуре α-аминокислот прочно укрепились тривиальные названия, принятые номенклатурой ИЮПАК. Систематические названия α-аминокислот практически не применяются, хотя они, безусловно, допустимы. Сокращенное трехбуквенное обозначение аминокислот используется при записи строения пептидных и белковых молекул.
Классификация протеиногенных аминокислот. Современная классификация аминокислот основана на полярности радикалов (R), т. е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Выделяют две группы аминокислот: 1) α-аминокислоты с неполярными (гидрофобными) радикалами; 2) α -аминокислоты с полярными (гидрофильными) радикалами; Аминокислоты с неполярными радикалами. К аминокислотам с гидрофобным радикалом относятся аминокислоты с алифатическими и ароматическими боковыми радикалами. В структуре белков эти радикалы стремятся располагаться внутри глобул и участвуют в гидрофобном взаимодействии. Аминокислоты с неполярным алифатическим радикалом: · глицин · аланин · валин · лейцин · изолейцин · пролин Аминокислоты с неполярным ароматическим радикалом: · фенилаланин · тирозин · триптофан Аминокислоты с полярными (гидрофильными) радикалами. Для гидрофильных радикалов α-аминокислот характерно наличие в них функциональных ионогенных или неионогенных групп. В структуре белков ионогенные группы α-аминокислот, как правило, располагаются на поверхности макромолекулы и обуславливают электростатические (ионные) взаимодействия. В полярных неионогенных радикалах α-аминокислот содержатся либо спиртовые, либо амидные группы. Эти неионогенные радикалы могут располагаться как на поверхности, так и внутри белковых молекул, участвуя в образовании водородных связей с другими полярными группами или молекулами.
Аминокислоты с полярным неионизирующимся радикалом: · Серин · Треонин · Цистеин · Метионин · Аспарагин · глутамин Аминокислоты с полярным ионизирующимся положительно радикалом: · Лизин · Аргинин · гистидин Аминокислоты с полярным ионизирующимся отрицательно радикалом: · аспарагиновая кислота · глутаминовая кислота Многие α-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков α-аминокислоты не синтезируются в организме и должны поступать с пищей, такие аминокислоты называют незаменимыми. К ним относятся: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Аргинин и гистидин являются незаменимыми только для детей первого года жизни; в организме взрослого человека они синтезируются. Стереохимия аминокислот. Важнейшим свойством аминокислот, образующихся в процессе гидролиза природных белков, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за исключением глицина) в α-положении асимметрического атома углерода. Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и оптически неактивного рацемата.
Относительная конфигурация α-аминокислот определяется по конфигурационному стандарту — глицериновому альдегиду — с использованием «гидроксикислотного ключа». Расположение в проекционной формуле Фишера аминогруппы слева соответствует L-кон-фигурации (подобно ОН-группе в L-глицериновом альдегиде), справа — D-конфигурации хирального атома углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежат к L-ряду. Величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическую плотность. Изолейцин и треонин содержат в молекуле по два хиральных центра и могут существовать в виде четырех диастереомеров (две пары энантиомеров).
Из этих четырех стереоизомеров только один используется для построения белков человеческого организма. В состав белков входит L-изолейцин. В названии той пары энантиомеров, стереоизомер которой не является структурным элементом белков, используется приставка алло -. В белках микроорганизмов и пептидах могут встречаться и D-аминокислоты. Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий. Согласно R,S - системе асимметрический атом углерода у α-аминокислот L-ряда имеет S-конфигурацию (исключение цистеин). Химические свойства аминокислот. Свойства α-аминокислот. Кислотно-основные свойства. Аминокислоты являются амфотерными соединениями, что обусловлено одновременным присутствием в молекуле основной (NH2) и кислотной (СООН) групп. Однако привычное написание формул аминокислот как соединений, содержащих амино- и карбоксильную группы — RCH(NH2)COOH, является условным и не отражает их истинного строения. И в кристаллическом состоянии, и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли — диполярного иона, называемого также цвиттер-ионом. В сильнокислой среде (pH 1—2) в аминокислотах полностью протонирована аминогруппа и не диссоциирована карбоксильная группа. В сильнощелочной среде (pH >12), напротив, свободна аминогруппа и полностью ионизирована карбоксильная:
Заметим, что при написании этого же кислотно-основного взаимодействия, исходя из «классической» формулы аминокислот, структуры ионных форм были бы такими же, как в приведенной схеме. Поэтому в записи схем реакций чаще используют формулы аминокислот в неионизированной форме. α-Aминокислоты образуют соли как со щелочами, так и с кислотами:
Кроме солей, которые образуют α-аминокислоты с сильными кислотами или щелочами, известны комплексные соли многих аминокислот с ионами двухвалентных металлов. Наиболее устойчивы комплексы с ионами Сu2+, Ni2+, Zn2+, Со2+ (в порядке снижения стабильности). Так, с гидроксидом меди(II) получаются кристаллические хелатные соли синего цвета, которые используются для выделения и очистки аминокислот (качественная реакция):
Для каждой аминокислоты существует определенное значение pH, называемое изоэлектрической точкой (обозначается pI или pHi), при котором содержание диполярного иона максимально. Для алифатических аминокислот это 6,0, т. е. находится в слабокислой области. Это объясняется тем, что кислотность группы —NH3+ в диполярном ионе выше основности группы —СОO—. Для кислот с дополнительными слабокислотными функциональными группами (SH-группа цистеина и ОН-группы серина, треонина и тирозина) значения рI лежат в более кислой области (5,0-5,7). Аспарагиновая и глутаминовая кислоты, содержащие дополнительную карбоксильную группу, относятся к кислым аминокислотам (рI ~3) и превосходят по кислотности уксусную кислоту. Напротив, диаминокислота лизин, а также аргинин, где дополнительным центром основности служит гуанидиновая группировка, являются представителями основных аминокислот (рI 9,6 и 10,8). Их основность сопоставима с основностью аммиака и алифатических аминов. Кислотно-основные свойства обусловливают возможность разделения и идентификации методами ионообменной хроматографии и электрофореза.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.147.141 (0.012 с.) |