Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминокислоты в медицине используются в качестве лекарствСодержание книги
Поиск на нашем сайте
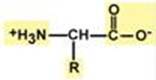
Лекция 1 Аминокислоты. Белки http://biokhimija.ru/aminoikislota/peptidnaja-svjaz.html Что такое аминокислоты? Аминокислоты по строению являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу.
Аминокислоты - это строительные блоки белковых молекул, но необходимость их изучения кроется не только в данной функции. Такие аминокислоты как гистидин, триптофан, глутаминовая кислота, тирозин являются источником для образования нейромедиаторов в ЦНС (соответственно гистамин, серотонин, гамма-аминомасляная кислота, дофамин и норадреналин), а глицин и глутаминовая кислота сами являются нейромедиаторами. Те или иные аминокислоты необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др.). Аминокислота тирозин целиком входит в состав гормонов щитовидной железы (тироксин, трийодтиронин) и мозгового вещества надпочечников (адреналин, норадреналин). С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма, таких как цистиноз,гомоцистеинемия, лейциноз, тирозинемии и др. Самым известным примером являетсяфенилкетонурия. Аминокислоты в медицине используются в качестве лекарств Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин (" Ациметион ") и его активные производные (как вещество "адеметионин" в составе препарата " Гептрал ") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов. Глутаминовая кислота – это предшественник гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сама по себе глутаминовая кислота также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновыхипиримидиновыхоснований, играет ведущую роль в обмене остальных аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте в несколько раз выше потребности в других аминокислотах.
Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния. Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты. Комплексный препарат глутаминовой кислоты, цистеина и глицина " Вицеин " используют в виде глазных капель. Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. В организме гистидин превращается в медиатор гистамин. Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п. Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), фибриносол (гидролизат фибрина крови). Классификация аминокислот Классификация аминокислот может проводиться в зависимости от какого-либо свойства или качества аминокислот. Выделяют следующие классы аминокислот: 1. В зависимости от положения аминогруппы по отношению к С2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др. 2. По абсолютной конфигурации молекулы на L- и D-стереоизомеры. 3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие. 4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные.
5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH2-группы. 6. По кислотно-основным свойствам – нейтральные, кислые, основные. 7. По необходимости для организма – заменимые и незаменимые. Строение протеиногенных аминокислот По полярности бокового радикала Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные).
По незаменимости По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей. Две конформации тетраэдра В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.
L- и D-формы аланина Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Данное обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
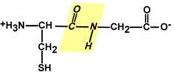
Образование пептидной связи При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным. Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион). К свойствам пептидной связи относятся: 1. Копланарность
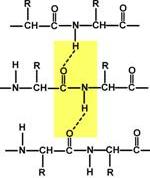
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Две равнозначные формы
Пептидная связь имеет кетоформу и енольную форму. 4. Способность к образованию водородных связей.
Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами. Белки Функции белков Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций. Определение Ф.Энгельса "Жизнь есть способ существования белковых тел" до сих пор, по прошествии полутора веков, не потеряло своей правильности и актуальности. Структурная функция Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны. Ферментативная функция Все ферменты являются белками.
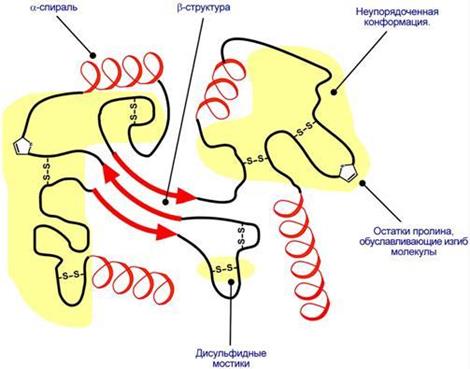
Гормональная функция Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон. Рецепторная функция Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная функция Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. Транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры. Резервная функция В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. Сократительная функция Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитная функция Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента, пропердин, при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту и поддержку клеток осуществляют протеогликаны. К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови. Белковая буферная система участвует в регуляции кислотно-щелочного состояния. Свертывание белка в глобулу Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
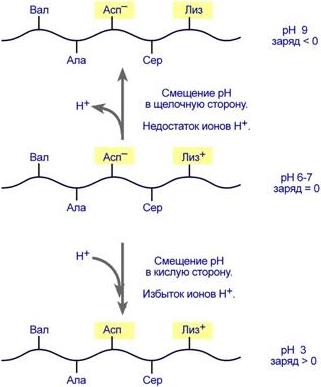
Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Если в белке преобладают основные аминокислоты (лизин и аргинин) – то при нейтральных рН заряд белка положительный и обусловлен этими, положительно заряженными, аминокислотами. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативной (живой) конформации. Влияние рН на заряд белка При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость
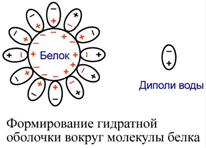
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: · наличием заряда и взаимоотталкиванием заряженных молекул белка, · наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды. Денатурация Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами.
Химическая денатурация Зависит от природы денатурирующего реагента: · кислоты и щелочи образуют водородные связи с пептидными группами, · органические растворители образуют водородные связи и вызывают дегидратацию, · алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, · тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. На эффекте химической денатурации основаны немного устаревшие, но простые и наглядные тимоловая проба и проба Вельтмана, используемые в клиникo-лабораторной диагностике для оценки состояния белкового обмена. Высаливание Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Например, раньше в диагностических целях так определяли соотношение белковых фракций альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8. Изменение рН Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, одновременному уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы. Классификация по функции В соответствии с биологическими функциями выделяют: · структурные белки (коллаген, кератин), · ферментативные (пепсин, амилаза), · транспортные (трансферрин, альбумин, гемоглобин), · пищевые (белки яйца, злаков), · сократительные и двигательные (актин, миозин, тубулин), · защитные (иммуноглобулины, тромбин, фибриноген), · регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).
Классификация по строению
Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумины, миоглобин, к полимерным -гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы), По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты (нуклеопротеины,фосфопротеины, металлопротеины, липопротеины, хромопротеины, гликопротеины). Альбумины Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в "осадочных" пробах (тимоловая, Вельтмана). Часто содержат углеводные компоненты. При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины.
Гистоны
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются сдезоксирибонуклеиновой кислотой(ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, H2b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%). Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков. Можно выделить две функции гистонов: 1. Регуляция активности генома, а именно – они препятствуют транскрипции. 2. Структурная – стабилизируют пространственную структуру ДНК. Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, H2b, НЗ, Н4. Между нуклеосомами располагается гистон H1, также связанный с молекулой ДНК. ДНК обвивает нуклеосому 2,5 раза и переходит к гистону H1, после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз. Далее такие "бусы" нуклеосом могут складываться в суперспираль и более сложные структуры. Протамины Это белки массой от 4 кДа до 12 кДа, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная. Коллаген
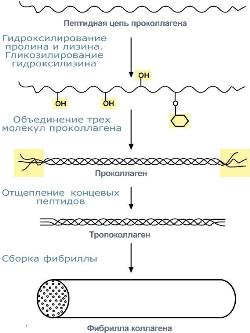
Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях. Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина. Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [ Гли-А-В ], где А и В – любые, кроме глицина, аминокислоты. В основном это аланин, его доля составляет 11%, доля пролина и гидроксипролина – 21%. Таким образом, на другие аминокислоты приходится всего 33%. Структура пролина и гидроксипролина не позволяет образовать α-спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка. При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины. В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген. Эластин
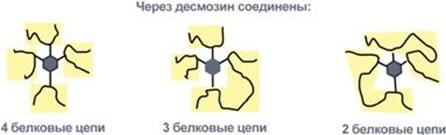
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обуславливает наличие спиральных эластичных участков. Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4-мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях. α-Аминогруппы и α-карбоксильные группы десмозина включаются в образование пептидных связей одного или нескольких белков.
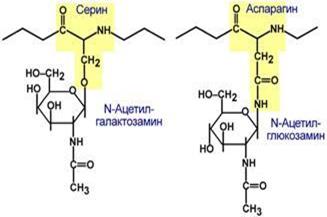
Этапы организации хроматина Гликопротеины Для собственно гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина, треонина, гидроксилизина. Углевод имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, их аминопроизводные, N-ацетилнейраминовую кислоту.
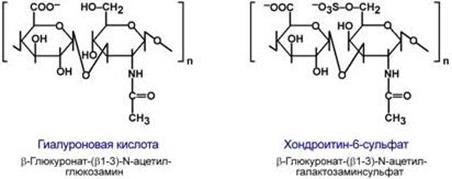
Протеогликаны Другая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков. Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. Для углеводной части встречаются другие названия – кислые гетерополисахариды (т.к. имеют много кислотных групп), гликозаминогликаны (содержат аминогруппы). Избыток анионных групп (сульфатных, карбоксильных) придает молекулам гликозаминогликанов высокий отрицательный заряд. Основными представителями структурных гликозаминогликанов являются гиалуроновая кислота,хондроитинсульфаты,кератансульфаты и дерматансульфаты. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур.
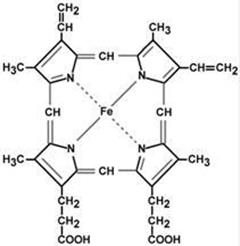
Гемопротеины
Строение гема Подразделяются на неферментативные (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями. Цитохромы Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи и цепимикросомального окисления. Флавопротеины Являются ферментами окислительно-восстановительных реакций, содержат производные витамина В2флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Лекция 1 Аминокислоты. Белки http://biokhimija.ru/aminoikislota/peptidnaja-svjaz.html Что такое аминокислоты? Аминокислоты по строению являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу.
Аминокислоты - это строительные блоки белковых молекул, но необходимость их изучения кроется не только в данной функции. Такие аминокислоты как гистидин, триптофан, глутаминовая кислота, тирозин являются источником для образования нейромедиаторов в ЦНС (соответственно гистамин, серотонин, гамма-аминомасляная кислота, дофамин и норадреналин), а глицин и глутаминовая кислота сами являются нейромедиаторами. Те или иные аминокислоты необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др.). Аминокислота тирозин целиком входит в состав гормонов щитовидной железы (тироксин, трийодтиронин) и мозгового вещества надпочечников (адреналин, норадреналин). С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма, таких как цистиноз,гомоцистеинемия, лейциноз, тирозинемии и др. Самым известным примером являетсяфенилкетонурия. Аминокислоты в медицине используются в качестве лекарств Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени. Метионин (" Ациметион ") и его активные производные (как вещество "адеметионин" в составе препарата " Гептрал ") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов. Глутаминовая кислота – это предшественник гамма-аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сама по себе глутаминовая кислота также является нейромедиатором, стимулирующим передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновыхипиримидиновыхоснований, играет ведущую роль в обмене остальных аминокислот, что активно используется в спортивной медицине. Потребность организма в глутаминовой кислоте в несколько раз выше потребности в других аминокислотах. Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния. Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты. Комплексный препарат глутаминовой кислоты, цистеина и глицина " Вицеин " используют в виде глазных капель. Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. В организме гистидин превращается в медиатор гистамин. Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п. Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), фибриносол (гидролизат фибрина крови).
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2039; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.106.211 (0.021 с.) |



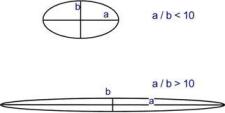 В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин,альбумин, глобулины плазмы крови.
В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин,альбумин, глобулины плазмы крови.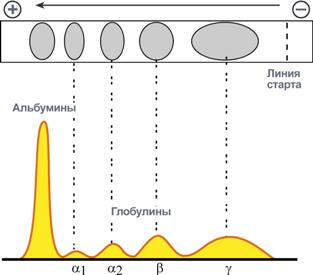
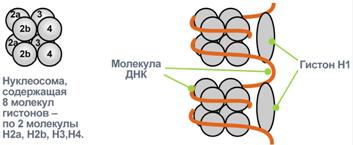 Взаимодействие гистонов и ДНК
Взаимодействие гистонов и ДНК
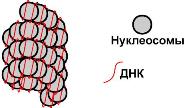 Участок суперспирали ДНК
Участок суперспирали ДНК
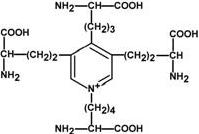 Строение десмозина
Строение десмозина