
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: белки 2. Тканевой обмен аминокислот. Обезвреживание продуктов обмена.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Тема: Белки 2. Тканевой обмен аминокислот. Обезвреживание продуктов обмена. Время 3ч.
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ, МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ; ТРЕБОВАНИЕ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ. Цель занятия: сформировать представления об основных путях метаболизма свободных аминокислот в тканях. Изучить механизмы и значение реакций детоксикации аммиака в норме и при патологии. Освоить методику определения концентрации мочевины в сыворотке крови и моче. В результате проведения занятия студент должен: 1) Знать общие пути превращения аминокислот в клетке; источники и пути обезвреживания аммиака в организме. ЦТК, реакции, ферменты, механизмы регуляции 2) Научиться проводить исследование на колориметре
2. КОНТРОЛЬНЫЕ ВОПРОСЫ ИЗ СМЕЖНЫХ ДИСЦИПЛИН. 2.1. Строение, классификация и свойства аминокислот (биоорганическая химия). 2.2. Строение витамина В6 и его активных форм (биоорганическая химия). 2.3. Физико-химические свойства аммиака (неорганическая химия).
3.КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ. 1. Основные реакции обмена аминокислот: 1.1. Реакции на радикал: а) гидроксилирование (про, лиз, фен). Механизм микросомального окисления (роль аскорбата, NADPH, цитохрома P450 и др.), примеры, биологическое значение; б) разрыв (механизм, биологическое значение); в) метилирование и др. Кроме индивидуальных путей обмена, известен ряд превращений, общий почти для всех а/к. Это реакции: 1) на радикал (R): - гидроксилирование; - разрыв радикала; - метилирования
Гидроксилирование: 1. При синтезе коллагена одновременно с трансляцией происходит гидроксилирование остатков пролина и лизина, катализируется этот процесс проколлаген-гидроксилазами, имеющими в активном центре атомы железа, в качестве кофермента используется аскорбат (витамин С). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов. Гидроксилирование пролина и лизина происходит в микросомальной дыхательной цепи при помощи цитохрома Р450, при этом один атом кислорода включается в вещество, а другой, связывая водород из среды, входит в состав воды (см. микросомальную дыхательную цепь)
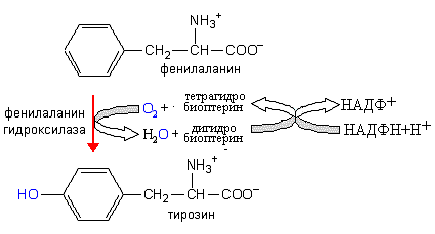
2. При гидроксилировании фенилаланина образуется аминокислота тирозин. Эта реакция катализируется фенилаланингидроксилазой.
Нарушение функции фенилаланин гидроксилазы – причина фенилкетонурии.
Реакции метилирования: Метионин на пути своего распада взаимодействует с АТФ с образованием S-аденозилметионина (SАМ). Эту молекулу называют «активный метионин», поскольку он является донором метильной группы в синтезе многих важных для клетки соединений.
После передачи метильной группы образуется S-аденозилгомоцистеин, который путем гидролиза S—С-связи распадается на L-гомоцистеин и аденин.
Реакции разрыва цепи можно рассмотреть на примере триптофана и аригинина:
Распад молекулы триптофана до промежуточных продуктов проходит в основном по кинуренин-антранилатному пути, в результате которого после ряда реакций из триптофана образуется никотинамид (витамин РР).
Разрыв цепей аргинина приводит к образованию орнитина и мочевины в цикле синтеза мочевины:
2. Реакции на карбоксильную группу: а) декарбоксилирование (на примере гис, тир, трп, глу) – механизм, ферменты, биологическая роль; б) восстановление – ферменты, биологическая роль. Сульфиновая К-та
│___ CO2 │____ CO2 │ │
CH2-SO2H [O] CH2-SO3H │ -----> │ CH2-NH2 CH2-NH2 Гипотаурин таурин (используется для Синтеза парных желчных к-т). При декарбоксилировании триптофана образуется биогенный амин триптамин, обладающий сосудосуживающим действием.
При декарбоксилировании тирозина происходит синтез катехоламинов.
Реакция восстановления. Реакцию восстановления карбоксильной группы можно рассмотреть на примере глутаминовой кислоты: образующийся при этом глутамат-гамма-полуальдегид используется в различных реакциях, например, в реакции синтеза пролина из глутаминовой кислоты.
3. Реакции на аминогруппу: а) виды дезаминирования (окислительное, восстановительное, гидролитическое, внутримолекулярное), их медико-биологическое значение; б) прямое окислительное дезаминирование – механизм, ферменты, коферменты, биологическое значение; в) реакции переаминирования – ферменты, коферменты, биологическое значение;
г) непрямое окислительное дезаминирование – механизм, ферменты, коферменты, биологическое значение. Виды дезаминирования Возможны четыре механизма прямого дезаминирования:
Окислительное дезаминирование (см. ниже) Восстановительное дезаминирование характерно для микроорганизмов, гидролитическое – для аспарагина и глутамина (в результате образуются аспартат и глутамат), внутримолекулярное – для гистидина (с образованием урокаиновой кислоты). Прямое окислительное дезаминирование характерно для глутаминовой кислоты:
АсАТ К = ----------- = 1,5 - 2 (в норме). АлАТ Если К > 2 (возрастает активность АсАТ) -- инфаркт миокарда. Если К < 0,6 (возрастает активность АлАТ) -- болезнь Боткина.
ГДГ
2. Образование амидов дикарбоновых кислот: NH3; АТФ ГЛУ -------------------> ГЛН Глутамин- синтетаза
NH3; АТФ АСП ------------------> АСН Аспарагин- синтетаза
Поскольку ГЛН и АСН выделяются с мочой в небольших количествах, то они являются транспортными формами аммиака. 3. Аммониогенез Основная масса ГЛН (и АСН) захватывается почками, где под влиянием глутаминазы от него отщепляется аммиак. Потом аммиак реагирует с H+ и дает ион аммония NH4+, который экскретируется с мочой. При ацидозе экскреция NH4+ с мочой возрастает, т.к. ацидоз активирует глутаминазу и она активнее отщепляет аммиак от ГЛН, который в свою очередь активнее захватывает H+ и тем самым и тем самым ликвидирует ацидоз. Кроме того при ацидозе происходит потеря Na+ и K+ с мочой. Это приводит к понижению осмотического давления и обезвоживанию ткани. Но этот процесс не развивается благодаря образованию NH4+, который обладает близкими физико-химическими свойствами к свойствам Na+ и K+ и тем самым как бы замещает их, предотвращая нарушение водно-электролитного баланса. Аналогичный процесс может происходить при отщеплении NH3 от АСП под действием аспарагиназы.
Биосинтез мочевины.
Печень - единственный орган, клетки которого содержат все ферменты синтеза мочевины и, следовательно, являются главным местом синтеза мочевины в организме. Ферменты, участвующие в ее синтезе расположены в митохондриях и цитозоле. Синтез мочевины – пример циклического метаболического пути. Расходуются в процессе мочевинообразования аспарагиновая кислота и ион аммония (источники аминогрупп молекулы мочевины), диоксид углерода (из бикарбоната) и АТФ. Синтез 1 моля мочевины требует 3 молей АТФ. Энергетическая емкость ЦСМ.
Суммарная реакция синтеза мочевины:
На синтез одной молекулы мочевины расходуется 4 макроэргических связи 3-х молекул АТФ: 2 АТФ – на стадии синтеза корбомоилфосфата и одна АТФ – на стадии синтеза аргинино-сукцината (если учитывать, что в данной реакции образуется АМФ, то можно считать энергозатраты этой реакции равной 2 АТФ, т.е. энергетическая емкость ЦСМ равна 4 АТФ).
Биологическая роль ЦСМ. 1. Механизм детоксикации NH3. 2. Механизм регуляции КЩС 3. ЦСМ - поставщик орнитина.
4. Имея митохондриальную локализацию, регулирует потоки а/к по различным путям ---------> ГНГ, биосинтез белка, липогенез. Между циклом мочевинообразования и циклом трикарбоновых кислот устанавливается тесная связь на уровне субстратов
Связь ЦСМ с ЦТК и обменом аминокислот (цикл Кребса-Гензелейта ("трехколесный велосипед").
Ферменты: 1 - карбамоилфосфатсинтетаза-1. │ 2 - карбамоилфосфаттрансфераза. │ ферменты 3 - аргининосукцинатсинтетаза. │ ЦСМ 4 - аргининосукцинатлиаза. │ 5 - аргиназа. │
6 - фумараза. │ ферменты 7 - малатдегидрогеназа │ ЦТК
8 - АсАТ│ ферменты 9 - ГДГ │ обмена а/к
Регуляция ЦСМ. 1. Краткосрочная: на уровне 1-го фермента, который вместе с 8-ым направляет азот ГЛУ (а значит и всех а/к) в карбамоилфосфат. 2. Долгосрочная: определяется уровнем липолиза, Ац-КоА. Ац-КоА при недостатке углеводов, является наиболее предпочтительным субстратом, чем липиды. Косвенные доводы позволяют предположить, что углеводы и белки (а/к) способны полностью обеспечить энергетический потенциал клетки. Врожденные дефекты ферментов ЦСМ, основные клинические проявления. Дефицит ферментов орнитинового цикла встречается в популяции с частотой 1 случай на 25000 новорожденных и начинает проявляться в неонатальный период. К настоящему времени описаны врожденные дефекты каждого фермента, участвующего в синтезе мочевины. Все дефекты (за исключением дефицита аргиназы) сопровождаются тяжелой гипераммониемией. Высокий уровень аммиака оказывает токсическое действие на центральную нервную систему. Не поддающаяся лечению гипераммонийемия завершается тяжелым нарушениями психики.
Роль ЦСМ в регуляции КОС.
Тема: Белки 2. Тканевой обмен аминокислот. Обезвреживание продуктов обмена. Время 3ч.
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ, МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ; ТРЕБОВАНИЕ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ. Цель занятия: сформировать представления об основных путях метаболизма свободных аминокислот в тканях. Изучить механизмы и значение реакций детоксикации аммиака в норме и при патологии. Освоить методику определения концентрации мочевины в сыворотке крови и моче. В результате проведения занятия студент должен: 1) Знать общие пути превращения аминокислот в клетке; источники и пути обезвреживания аммиака в организме. ЦТК, реакции, ферменты, механизмы регуляции 2) Научиться проводить исследование на колориметре
2. КОНТРОЛЬНЫЕ ВОПРОСЫ ИЗ СМЕЖНЫХ ДИСЦИПЛИН.
2.1. Строение, классификация и свойства аминокислот (биоорганическая химия). 2.2. Строение витамина В6 и его активных форм (биоорганическая химия). 2.3. Физико-химические свойства аммиака (неорганическая химия).
3.КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ. 1. Основные реакции обмена аминокислот: 1.1. Реакции на радикал: а) гидроксилирование (про, лиз, фен). Механизм микросомального окисления (роль аскорбата, NADPH, цитохрома P450 и др.), примеры, биологическое значение; б) разрыв (механизм, биологическое значение); в) метилирование и др. Кроме индивидуальных путей обмена, известен ряд превращений, общий почти для всех а/к. Это реакции: 1) на радикал (R): - гидроксилирование; - разрыв радикала; - метилирования
Гидроксилирование: 1. При синтезе коллагена одновременно с трансляцией происходит гидроксилирование остатков пролина и лизина, катализируется этот процесс проколлаген-гидроксилазами, имеющими в активном центре атомы железа, в качестве кофермента используется аскорбат (витамин С). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов. Гидроксилирование пролина и лизина происходит в микросомальной дыхательной цепи при помощи цитохрома Р450, при этом один атом кислорода включается в вещество, а другой, связывая водород из среды, входит в состав воды (см. микросомальную дыхательную цепь)
2. При гидроксилировании фенилаланина образуется аминокислота тирозин. Эта реакция катализируется фенилаланингидроксилазой.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 531; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.119.140 (0.01 с.) |









 Биосинтез мочевины - основной механизм обезвреживания аммиака в организме. 90% азота из организма выводится в виде мочевины, причем в норме количество экскретируемой мочевины зависит от количества потребленного белка и обычно составляет 25-30 г в сутки.
Биосинтез мочевины - основной механизм обезвреживания аммиака в организме. 90% азота из организма выводится в виде мочевины, причем в норме количество экскретируемой мочевины зависит от количества потребленного белка и обычно составляет 25-30 г в сутки. Аспарагиновая кислота + NH3 + CO2 + 3АТФ + 2 H2O
Аспарагиновая кислота + NH3 + CO2 + 3АТФ + 2 H2O мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн
мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн



