Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ч. 3. Обмен белков и аминокислотСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
ДИНАМИЧЕСКАЯ БИОХИМИЯ Ч. 3. ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ ОБМЕН НУКЛЕОПРОТЕИДОВ И НУКЛЕОТИДОВ УЧЕБНОЕ ПОСОБИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ Караганда 2003 Особая роль белков в питании В отличие от углеводов и жиров, белки являются незаменимым компонентом пищи. Пищевые белки - это главный источник азота для организма. Впервые М.Рубнер определил, что 75% азота в организме находится в составе белков, и составил азотистый баланс (определил, сколько азота человек теряет за сутки и сколько азота прибавляется). У взрослого здорового человека наблюдается азотистое равновесие - «нулевой азотистый баланс» (суточное количество выведенного из организма азота соответствует количеству усвоенного). Положительный азотистый баланс (суточное количество выведенного из организма азота меньше, чем количество усвоенного). Наблюдается только в растущем организме или при восстановлении белковых структур (например, в периоде выздоровления при тяжелых заболеваниях или при наращивании мышечной массы). Отрицательный азотистый баланс (суточное количество выведенного из организма азота выше, чем количество усвоенного). Наблюдается при белковой недостаточности в организме. Причины: недостаточное количество белков в пище; заболевания, сопровождающиеся повышенным разрушением белков. Отсутствие в пищевых белках незаменимых аминокислот (даже одной) нарушает синтез белков, поскольку в состав практически всех белков входит полный набор аминокислот. Полноценность белкового питания зависит от аминокислотного состава белков и определяется наличием незаменимых аминокислот. Суточная потребность в каждой незаменимой аминокислоте - 1-1.5 гр., а всего организму необходимо 6-9 граммов незаменимых аминокислот в сутки. Дипептидазы Расщепляют пептидные связи только в дипептидах. Все описанные ферменты относятся к МАЛОСПЕЦИФИЧНЫМ ПРОТЕИНАЗАМ. Они характерны для желудочно-кишечного тракта (рис.2). Желудочный сок содержит соляную кислоту, которая вырабатывается обкладочными клетками желудка и выполняет следующие функции: оказывает бактерицидное действие; денатурирует белки пищи; создает оптимум рН для пепсина; активирует пепсиноген путем частичного протеолиза. рН желудочного сока в норме 1,5-2,0. НСl и пепсин способны разрушать клетки эпителия желудка. В норме этого не происходит, так как существуют защитные факторы слизистой оболочки желудка, основными из которых являются: образование слизи на поверхности; секреция эпителиальными клеткамиионов НСО-3, создающих в пристеночном слое среду с рН 5,0-6,0; наличие на наружной поверхности мембран клеток слизистой оболочки гетерополисахаридов, которые не являются субстратами пептидаз; быстрая регенерация поврежденного эпителия. Конечным результатом переваривания белков» является образование свободных аминокислот, поступающих в клетки слизистой оболочки кишечника путем активного транспорта за счет градиента концентрат натрия (симпорт). Свободные аминокислоты в отличие от белков пищи лишены видовой специфичной и не обладают антигенными свойствами. Аминокислоты попадают в портальный кровоток - в печень и в общий кровоток. Печень и почки поглощают аминокислоты интенсивно, мозг избирательно поглощает метионин, гистидин, глицин, аргинин, глутамин, тирозин. В толстом отделе кишечника не всосавшиеся по каким-либо причинам (недостаток или низкая активность протеолитических фрементов, нарушение процессов транспорта аминокислот) пептиды и аминокислот подвергаются процессам гниения. При этом образуются такие продукты как: фенол, крезол, сероводород, меркаптоэтанол, индол, скатол, а также группа соединений под общим названием «трупные яды» - кадаверин и путресцин. Эти вещества всасываются в кровь и поступают в печень, где подвергаются конъюгации с глюкуроновой кислотой и другим процессам обезвреживания. Затем они выводятся из организма с мочой. Тотальный протеолиз - один из общих биологических процессов, необходимый не только для внутриклеточного пищеварения, но и для обновления стареющих белков клетки, и организма в целом (рис.2). Но этот процесс находится под строгим контролем, который обеспечивают специальные механизмы, защищающие белки от избыточного действия протеаз. МЕХАНИЗМЫ, ЗАЩИЩАЮЩИЕ БЕЛКИ ОТ ДЕЙСТВИЯ ПРОТЕИНАЗ: 1. Защита типа "клетки" - пространственная изоляция протеиназ от тех белков, на которые они могут подействовать. Внутриклеточные протеиназы сосредоточены внутри лизосом и отделены от белков, которые они могут гидролизовать. 2. Защита типа "намордника". Заключается в том, что протеиназы вырабатываются в виде неактивных предшественников (проферментов): например, пепсиноген (в желудке) трипсиноген и химотрипсиноген (в pancreas) Во всех этих предшественниках активный центр фермента прикрыт фрагментом полипептидной цепи. После гидролиза определенной связи эта цепочка отрывается и фермент становится активным. 3. Защита типа “кольчуги“. Защита белка-субстрата путем включения в его молекулу каких-либо химических структур (защитные группы, прикрывающие пептидные связи). Протекает следующими способами: а) Гликозилирование белка. б) Ацетилирование аминогрупп. Присоединение остатков уксусной кислоты к свободным аминогруппам в молекуле белка. в) Амидирование карбоксильной группы. Защитный эффект аналогичен. г) Фосфорилирование радикалов серина или тирозина 4. Защита типа “сторожа“. Это защита белков с помощью эндогенных ингибиторов протеиназ.
Эндогенные ингибиторы протеиназ - это особые белки или пептиды, которые могут взаимодействовать с протеиназой и блокируют ее. Хотя в связывании участвуют слабые типы связей, связывание протеиназы с эндогенным ингибитором прочное. Обычно такие ингибиторы протеиназ являются специфическими по отношению к определенному классу протеиназ. Самый активный ингибитор плазмы - альфа1-антитрипсин. Его концентрация в крови примерно 35 нмоль/л. Ингибирует в первую очередь эластазу, а при больших концентрациях ингибитора угнетает трипсин. При дефиците альфа1-антитрипсина или при нарушении его процессинга этого белка. В результате не выделяется в активной форме в кровь. Это генетический дефект, и у гомозиготных по этому признаку больных могут развиться нарушения со стороны легких, а затем в печени (развиваются эмфизема и гепатит). У гетерозигот - склонность к развитию хронических воспалительных процессов. В плазме крови есть и другие ингибиторы сериновых протеиназ: альфа1-антихимотрипсин, антитромбин, альфа2-антиплазмин. Другим не менее важным ингибитором является альфа2- макроглобулин. альфа2-макроглобулин - универсальный ингибитор (блокирует протеиназы разных типов). Он не блокирует активные центры ферментов, а лишь захватывает протеиназу в ловушку, которая есть на поверхности макроглобулина. Как только альфа2-макроглобулин захватывает в ловушку протеиназу, то он сразу изменяется и в результате освобождается участок, для которого многие клетки (лейкоциты, макрофаги) обладают специфическими рецепторами. Поэтому они связываются с комплексом “альфа2-макроглобулин-фермент”, фагоцитируют его и в лизосомах поглощенные белки полностью гидролизуются до аминокислот. КАТАБОЛИЗМ АМИНОКИСЛОТ. 80% аминокислот, которые поступают в организм из желудочно-кишечного тракта, используются для синтеза белков. Остальные 20% вступают в метаболические процессы. Все эти процессы можно разделить на 2 группы: 1. Общие пути катаболизма аминокислот (для всех аминокислот они одинаковы). В них принимает участие общая часть молекулы аминокислоты. 2. Специфические пути метаболизма для каждой отдельной аминокислоты (разные для разных аминокислот) - участвуют радикалы аминокислот. Это - особенности обмена отдельных аминокислот. ОБЩИЕ ПУТИ КАТАБОЛИЗМА АМИНОКИСЛОТ 1. Декарбоксилирование 2. Дезаминирование 3. Трансаминирование (переаминирование)
ДЕКАРБОКСИЛИРОВАНИЕ
В организме человека происходит только окислительное декарбоксилирование. Ферменты - декарбоксилазы. Их простетическая группа представлена пиридоксальфосфатом - это активная форма витамина В6. Продукты реакции – биогенные амины и углекислый газ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ АМИНОКИСЛОТ 1. Реакции необратимы - приводят к необратимому распаду аминокислот. 2. Образуется значительное количество СО2 - конечного продукта метаболизма, который выводится из организма. 3. Образуются амины, которые обладают высокой биологической активностью. Поэтому такие амины называют биологически активными или биогенными аминами. Они являются медиаторами, с помощью которых сигнал передается от одной клетки к другой и от одной молекулы к другой. Субстратная специфичность декарбоксилаз очень разная.
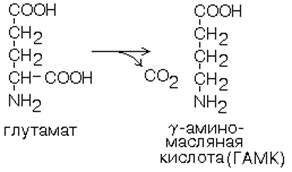
1. Глутаматдекарбоксилаза - высокоспецифичный фермент. Работает в клетках серого вещества головного мозга. Катализирует реакцию превращения глутаминовой кислоты в гамма-аминомасляную кислоту (ГАМК). ГАМК является медиатором тормозных импульсов в нервной системе. ГАМК и ее аналоги применяются в медицине как нейротропные средства для лечения эпилепсии и других заболеваний. 2. Орнитиндекарбоксилаза - высокоспецифичный фермент. Катализирует превращение орнитина в путресцин:
Образующийся путресцин (диаминобутан) является трупным ядом. В результате присоединения остатков пропиламина из путресцина могут образоваться спермин и спермидин, содержащие 3 (у спермина) или 4 (у спермидина) имино- или аминогруппы.
Полиамины принимают участие в процессах пролиферации клеток и роста тканей, а также в регуляции биосинтеза белка. Они являются ингибиторами некоторых ферментов, в том числе протеинкиназ. Спермин и спермидин относятся к группе биогенных полиаминов. Введение полиаминов в организм снижает температуру тела и кровяное давление. При раковых заболеваниях обнаружено резкое увеличение секреции полиаминов и повышение их экскреции с мочой. Гистидиндекарбоксилаза Этот фермент имеет абсолютную субстратную специфичность - превращает гистидин в гистамин:
Гистамин является медиатором и содержится в нервных клетках и в тучных клетках. Обладают сильным сосудорасширяющим действием. Гистамин хранится в секреторных гранулах и секретируется в кровь при повреждении ткани (удар, ожог и т.д.). Особенно много его выделяется в очаге воспаления. Гистамин играет важную роль в проявлении аллергических реакций. Известно 2 типа рецепторов к гистамину:H1 и H2. Эффекты гистамина: - расширение капилляров и повышение сосудистой проницаемости; - понижение артериального давления; - повышение тонуса (спазм) гладких мышц - в том числе гладкой мускулатуры бронхов; - усиление секреции желудочного сока; Некоторые из этих эффектов позволяют гистамину принимать участие в формировании аллергических проявлений. Антигистаминные препараты применяются с целью предотвратить образование гистамина и обладают противовоспалительным и антиаллергическим действием. По механизму действия некоторые из них являются ингибиторами гистидиндекарбоксилазы, а другие конкурируют с гистамином за взаимодействие с рецепторами клеток. Блокаторы Н1-рецепторов используются в основном как противоаллергические средства - димедрол, супрастин и т.д. 4. Сериндекарбоксилаза. Катализирует первую реакцию синтеза ацетилхолина из серина. Ацетилхолин – возбуждающий медиатор вегетативной нервной системы. 5. Декарбоксилаза ароматических аминокислот Имеет широкую субстратную специфичность. Превращает несколько разных аминокислот: а) триптофан - в триптамин б) 5-окситриптофан - в триптамин (серотонин) в) 3,4-диоксифенилаланин - в дофамин
Серотонин вырабатывается в нервной ткани. Некоторые виды головных болей (мигрени) связаны с избыточной выработкой серотонина. Серотонин сужает сосуды, регулирует свертывание крови. Обладает антиаллергическим действием. Триптамин обладает сходным эффектом. Аминокислота фенилаланин может в результате окисления присоединять две ОН-группы в кольце и превращаться в диоксифенилаланин (ДОФА). Из него под действием декарбоксилазы ароматических аминокислот образуется дофамин. Дофамин является предшественником катехоламинов - норадреналина и адреналина.
Кроме функции предшественника, ДОФАмин имеет свои специфические функции.
ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ В организме имеются механизмы, позволяющие разрушать биогенные амины.
1. Метилирование по оксигруппам тех аминов, которые такие группы содержат, либо включают оксигруппы в свою молекулу после гидроксилирования. Источник метильного радикала: S-Аденозилметионин. Реакцию катализируют ферменты - О-метилтрансферазы. Они переносят метильную группу на кислород. После присоединения аденильного остатка АДФ к сере метионина, метильная группа метионина становится очень мобильной и легко переносится на разные вещества. В том числе и на кислород оксигрупп. 2. Окисление амина по аминогруппе с целью дезаминирования. Главный путь инактивации биогенных аминов - их окисление под действием оксидаз с отщеплением аминогруппы. В результате исчезает биологическая активность амина.
Оксидазы биогенных аминов: моноаминооксидаза (МАО), диаминооксидаза (ДАО), полиаминооксидаза. Оксидазы отнимают два протона и два электрона и передают их сразу на кислород. Образуется перекись водорода, а амин превращается в ИМИН. Этот имин легко гидролизуется без участия фермента и превращается в альдегид. Простетической группой ферментов оксидаз является ФАД или ФМН, т.е. они являются флавопротеинами. Вторая реакция (гидролиз) необратима. Образовавшийся в итоге альдегид легко окисляется до карбоновой кислоты, которая распадается до СО2 и H2O. МАО в клетке больше, чем ДАО. Угнетение МАО приволит к замедлению распада биогенных аминов. Такие лекарства продлевают период существования биогенных аминов, что особенно важно при их недостатке. Эти вещества играют роль антидепрессантов и используются, в частности, при лечении шизофрении. Аминокислоты декарбоксилируются в цитоплазме, а окисление аминов происходит в наружной мембране митохондрий. Поскольку реакция декарбоксилирования аминокислот и разрушение биогенных аминов происходят не одновременно, то биогенные амины могут некоторое время существовать и выполнять свою биологическую функцию. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ У человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов: - оксидаза Д-аминокислот - оксидаза L-аминокислот
Эти ферменты обладают групповой стереоспецифичностью. Оксидазы отнимают протоны и электроны от аминокислот с помощью такого же механизма, как и оксидазы, обеспечивающие дезаминирование биогенных аминов. Эти ферменты являются флавопротеинами и содержат в качестве простетической группы ФАД или ФМН: На первой стадии образуется иминокислота, а затем, после спонтанного гидролиза образуется альфа-кетокислота. Кроме оксидаз имеется еще один фермент, катализирующий окислительное дезаминирование глутаминовой кислоты - глутамат-дегидрогеназа (глутаматДГ). Этот фермент является НАД-зависимым и обладает высокой активностью (как и другие НАД-зависимые дегидрогеназы). В этом его отличие от оксидаз аминокислот, которые медленно превращают аминокислоты в физиологических условиях (поэтому в клетке сохраняется большинство аминокислот). Так как глутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ.
Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ 1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот. 2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма. 3. Другой продукт реакции дезаминирования - альфа-кетокислота. Все образующиеся альфа-кетокислоты легко расщепляются дальше до СО2 и Н2О (например, аланин превращается в ПВК (путем дезаминирования; аспартат - в ЩУК; глутаминовая кислота - в альфа-кетоглутаровую). Большинство альфа-кетокислот тем или иным путем превращаются в кислоты, которые являются промежуточными метаболитами ЦТК: - в альфа-кетоглутаровую; - в янтарную; - фумаровую; -щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется глюкогенными аминокислотами (их 17). Только 3 аминокислоты не могут превращаться в пируват, но превращаются в Ацетил-КоА – кетогенные аминокислоты: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров. ТРАНСАМИНИРОВАНИЕ Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой. Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль). ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ: 1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот. В этот цикл вступает одна аминокислота и кетокислота. Образуются другая альфа-кетокислота и аминокислота. 2. Все стадии этого процесса обратимы. Поэтому весь цикл в целом может протекать как в прямом, так и в обратном направлении. Направление этого цикла зависит от соотношения концентраций участников реакции - всех четырех кислот. Резко повысив концентрацию какой-либо одной из кислот, можно направить реакцию по определенному направлению. 3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. По участникам процесса для данного фермента дают ему название: Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)). 4. Трансаминазы обычно обладают высокой субстратной специфичностью и высокой активностью. Наиболее активными в клетках являются те трансаминазы, для которых хотя бы один из субстратов является дикарбоновой альфа-кетокислотой - это АлТ - аланинаминотрансфераза (ГПТ) и АсТ - аспартатаминотрансфераза (ГЩТ). Определение активности этих ферментов в сыворотке крови имеет важное значение в ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ таких заболеваний, как ВИРУСНЫЙ ГЕПАТИТ и ИНФАРКТ МИОКАРДА. АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов. В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ. Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза. БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ. 1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты. Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток). При избытке какой-либо из кислот соотношение быстро восстанавливается трансаминазой за счет другой пары. Недостающее количество какой-либо из кислот может быть взято клеткой из других метаболических путей (например, альфа-кетоглутарат может быть взят из ЦТК). Избыток какой-либо из кислот может быть ликвидирован другими ферментами (например, избыточное количество глутамата окисляется глутаматдегидрогеназой). 2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ. 3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ Катаболизм аминокислот ускоряется при: поступлении с пищей больших количеств белка, гак как аминокислоты не могут запасаться в организме; голодании, так как распадаются белки тканей; сахарном диабете и других длительно протекающих тяжелых заболеваниях. Катаболизм аминокислот чаще всего начинается с реакции дезаминирования - удаления a-аминогруппы. В отличие от трансаминирования при дезаминировании общее количество аминокислот уменьшается. a -Аминогруппа отщепляется в виде аммиака. Аммиак - токсичное соединение, поэтому в клетках подвергается обезвреживанию. Безазотистый остаток представляет собой a --кетокислоту, которая включается (рис.3): • в реакции трансаминирования для синтеза заменимых аминокислот; • в анаплеротические реакции для восполнения убыли метаболитов ОПК, используемых для синтеза других соединений; • в глюконеогенез; • в кетогенез; • в реакции окисления до СО2, и Н20.
Рисунок 3 Дезаминированию подвергаются все аминокислоты, кроме лизина. Реакции дезаминирования: а) окислительное - для Глу; б) неокислительное - для Сер, Тре, Гис и Цис; в) непрямое - для остальных аминокислот. Окислительное дезаминирование глутамата происходит в присутствии кофермента NAD+. Реакция происходит в митохондриях многих тканей, наиболее активно в печени. Прямому окислительному дев минированию подвергается только глутамат. Фермент, катализирующий эту реакцию глутаматдегидрогеназа. Г лутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ. Прямому неокислительному дезаминированию подвергаются: • серии и треонин - дезаминирование происходит с отщеплением воды; • гистидин дезаминируется внутримолекулярным способом; • цистеин дезаминируется с выделением H2S и с использованием Н2О. Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает двестадии: • трансаминирование с a - -кетоглутаратом, образование Глу в цитозоле клетки; • окислительное дезаминирование Глу в митохондриях. Центральную роль в непрямом дезаминированини иг рают глутамат и a -кетоглутарат. ОБМЕН АММИАКА Основным источником аммиака является катаболизм аминокислот, однако аммиак может образовываться при распаде других азотсодержащих соединений(биогенных аминов, нуклеотидов) в тканях (рис.4). Часть аммиака образуется в кишечнике в результате жизнедеятельности микрофлоры кишечника (гниение белков) и всасывается в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке.
Рисунок 4 Катаболизм аминокислот и, следовательно, образование аммиака происходят во всех тканях. Концентрация аммиака в крови очень мала, так как он является токсичным веществом и быстро обезвреживается в клетках. Содержание аммиака в крови в норме 0.4 -0,7мг/л, или 25-40 мкмоль/л. Токсичность аммиака связана с его действием на центральную нервную систему. Образовавшийся в клетках аммиак связывается (обезвреживается) и выводится почками в виде конечных продуктов азотистого обмена: • мочевины - синтезируется в печени; • аммонийных солей - образуются в почках. Существует несколько способов обезвреживания и выведения аммиака в разных тканях (рис.5). Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина действием глутаминсинтетазы: Глутаминсинтетаза обладает высоким сродством к аммиаку, и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3. Глутамин является транспортной формой аммиака, так как представляет собой нейтральную аминокислоту, способную легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутаминовой кислоты, требующей механизмов активного транспорта). Из многих органов глутамин поступает в кровь, в наибольшем количестве - из мышц и мозга. Образовавшийся в тканях глутамин транспорти руется в почки и кишечник. В клетках кишечника Глн отщепляется амидная группа в виде NH3, образовавшийся глутамат трансаминируется с образованием аланина. В энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - в аминогруппу аланина. В почках глутамин также подвергается действию глутаминазы и расщепляется на аммиак и глутамат, который реабсорбируется и аозвращается в клетки тканей. Глутаминаза почек активируется при ацидозе, когда полученный аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей, которые экскретируются с мочой. Эта реакция защищает организм от потери с мочой ионов натрия и калия, которые также могут быть использованы для выведения избытка анионов. Еще одной реакцией обезвреживания аммиака в мозге и некоторых других органах является восстановительное аминирование a-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, хотя, если учитывать последующее образование глутамина, является выгодным для клеток, так как способствует обезвреживанию сразу 2 молекул NH3 Из мышц и некоторых других тканей избыток аммиака выводится в виде аланина. Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, источником которого служат безазотистые остатки аминокислот, а также глюкоза. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот ОРНИТИНОВЫЙ ЦИКЛ Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота. Экскреция мочевины в норме составляет около 25 г/сут. Синтезируется только в печени. Катаболизм аминокислот и образование аммиака происходят во многих тканях. Для транспорта азота из тканей в печень используется 3 соединения: глутамин, аланин и аммиак. Орнитиновый цикл в печени выполняет 2 функции: • превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; • синтез аргинина и пополнение его фонда в организме. Полный набор ферментов орнитинового цикла есть только в гепатоцитах (рис.6). В последней реакции цикла, которая происходит только в печени, под действием аргиназы аргинин распадается на мочевину и орнитин. Орнитин вновь поступает в митохондрии и повторно включается в цикл синтеза мочевины. Молекула мочевины содержит 2 атома азота: • первый атом N* поступает в цикл в виде аммиака, образующегося в митохондриях. Реакция катализируется митохондриальной карба-моилфосфатсинтетазой I. • второй атом N** вводится в мочевину из аспарагиновой кислоты. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень главным образом из кишечника с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутаминовой кислоты, существенно меньше. Аспарагиновая кислота, необходимая для синтеза аргининосукцината, образуется в печени с использованием аминогруппы аланина, который поступает главным образом из мышц и клеток кишечника. Oбразующийся в орнитиновом цикле фумарат в результате 2 реакций превращается в оксалоацетат, из которого путем трансаминирования образуется аспартат. Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фум арата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза. Еще один источник аспартата для орнитинови цикла - трансаминирование глутамата с оксалоацетатом.
Рисунок 6 В орнитиновом цикле расходуются 4 макроэргичес кие связи 3 молекул АТР на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину обеспечивает сам себя энергией: - при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез 3 макроэргических связей (рис.7); - при окислительном дезаминироваиии глутамата в разных органах также образуется NADH, который может обеспечить образование 3 макроэргичес-ких связей. Затраты энергии происходят и при трансмембранном п ереносе веществ, связанном с синтезом и экскрецией мочевины. Первые 2 реакции орнитинового цикла исходят в митохондриях, а последующие 3 - в цитоплазме. Цитруллин, образующийся в митохондрии, должен бьпъ перенесен в цитозоль, а орнитин, образующийся цитозоле, должен быть перенесен в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К+, Na+- АТРазой.
Рисунок 7 Отдельные ферменты орнитинового цикла обуживаются не только в печени, но и в других тканях. В энтероцитах, например, имеется 2 первых фермента и, следовательно, может синтезироваться цитруллин. В почках обнаружены 3-й и 4-й ферменты цикла. Цитруллин, образовавшийся в энгероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих водящихся в разных органах ферментов значимо ниже, чем в печени. ОБМЕН НУКЛЕОПРОТЕИНОВ Нуклеопротеины - это сложные белки, небелковым компонентом которых являются нуклеиновые кислоты - ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота). В живом организме нуклеиновые кислоты находятся в диссоциированном состоянии. В составе белковых компонентов очень много положительно заряженных аминокислот - аргинина и лизина, поэтому их можно отнести к поликатионам (гистоны). Белковые компоненты подвергаются обмену, как простые белки. ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ Нуклеиновые кислоты в организме постоянно обновляются. В норме синтез и распад находятся в состоянии динамического равновесия. КАТАБОЛИЗМ НУКЛЕИНОВЫХ КИСЛОТ Начинается с гидролиза 3',5'-фосфодиэфирной связи под действием ферментов нуклеаз: - ДНКазы - расщепляют ДНК - РНКазы - расщепляют РНК Среди ДНКаз и РНКаз различают: - экзонуклеазы (5' и 3'); эндонуклеазы - специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы - используются в генной инженерии. Далее происходит отщепление фосфата от мононуклеотида с участием ферментов нуклеотидаз с образованием нуклеозидов. Нуклеозид может расщепляться путем гидролиза под действием фермента нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз - при этом нуклеозид расщепляется на азотистое основание и фосфорибозу.
Нуклеазы очень многообразны. Различают ДНКазы и РНКазы. Отличаются друг от друга по месту действия. Бывают эндонуклеазы (расщепляют внутренние 3’5'-фосфодиэфирные связи) и экзонуклеазы (отщепляют концевые мононуклеотиды). Встречается 2 типа экзонуклеаз: 3'-экзонуклеазы - отщепляют мононуклеотид с 3'-конца молекулы, и 5'-экзонуклеазы - отщепляют 5'-концевой мононуклеотид. Нуклеазы могут отличаться друг от друга и по специфичности. Пищеварительные нуклеазы и нуклеазы лизосомальные отличаются низкой специфичностью, у них упрощенное строение активного центра. У высокоспецифичных нуклеаз очень сложное строение активного центра. Они способны «узнавать» целую последовательность нуклеотидов из 4-10 пар и расщеплять одну-единственную связь в строго определенном месте (если «узнаваемый» участок содержит содержит 4 нуклеотидные пары, то расщепляется, в среднем, одна связь из 250 возможных). Такие высокоспецифичные ДНКазы называются рестриктазами. Участки ДНК, «узнаваемые» рестриктазами, называются полиндромными последовательностями. Рестриктазы широко применяются в генной инженерии. Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, могут быть утилизированы во II-м этапе ГМФ-пути. Азотистые основания также подвергаются дальнейшему катаболизму, но по-разному, в зависимости от их типа - пуриновых (аденина, гуанина) или пиримидиновых (тимина, цитозина и урацила). AMФ, ГМФ Скорость синтеза ФРДФ зависит от 2 факторов: доступности рибозо-5-фосфата и активности ФРДФ-синтетазы, регуляция акти
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 750; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.107.243 (0.021 с.) |