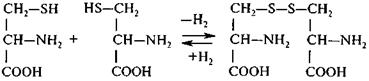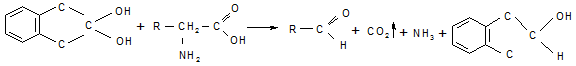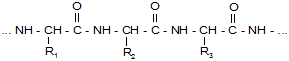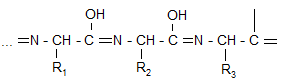Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физиологическая роль и применение в медицине некоторых аминокислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
( Материал для самостоятельной подготовки). Глицин ( аминоуксусная кислота) – заменимая аминокислота, является одним из центральных нейромедиаторов; оказывает седативное действие. Улучшает метаболические процессы в тканях мозга. Применяется как средство, ослабляющее влечение к алкоголю, уменьшающее депрессивные нарушения, повышенную раздражительность, нормализующее сон.
Цистеин (2-амино-3меркаптопропановая кислота) – заменимая аминокислота, может синтезироваться в организме с использованием метионина. При нарушении превращения метионина в цистеин недостаток этой аминокислоты и приводит к нарушению обменных процессов в организме. Цистеин участвует в процессах трансаминировання, в обмене серы. Расщепление цистеина род влиянием десульфогидразы приводит к образованию пировиноградной кмслоты и сероводорода. Цистеин легко превращается в Цистин: Цистеин Цистин
Легкость образования дисульфидных связей —S—S— обусловливает важную роль цистеиновьх остатков в формировании третичной структуры белковых молекул. Глутаминовая кислота (2-аминоглутаровая кислота) – заменимая аминокислота. Содержится в белках серого и белого вещества Мозга.
Играет важную роль в жизнедеятельности организма: участвует в белковом и углеводном обмене, стимулирует окислительные процессы, способствует обезвреживанию и выведению из организма аммиака, повышает устойчивость организма к гипоксии, способствует синтезу АТФ, переносу ионов калия, играет важную роль в деятельности скелетной мускулатуры, стимулирует передачу возбуждения в синапсах ЦНС. В медицинской практике находит применение главным образом при лечении заболеваний ЦНС: эпилепсии, психозов, реактивных состояний (депрессии).
Метионин (α-амино-γ-S-метилмасляная, или 2-амино-4-S-метилбутановая кислота) – незаменимая аминокислота, необходимая для поддержания роста и азотистого равновесия организма. Особая роль метионина в обмене веществ связана с Тем, что эта аминокислота содержит подвижную метильную группу —СН3, которая может передаваться на другие соединения (процесс переметилирования). Способностью метионина к переметилированию обусловлен его липотропный эффект (удаление из печени избытка жира). Липотропным свойством обладает также белок казеин и творог, содержащие значительное количество метионина. Метионин участвует в синтезе адреналина, креатина и других биологически важных соединений; активирует действие гормонов, витаминов (В12, аскорбиновой и фолиевой кислот), ферментов. Путем метилирования и транссульфирования метионин обезвреживает токсичные продукты. Метионин применяют для лечения и предупреждения заболеваний и токсических поражений печени (цирроз, отравления СНСI3, С6Н6), при хроническом алкоголизме, сахарном диабете, атеросклерозе и др. Гистидин является предшественником гистамина.
При декарбоксилировании гистидина образуется гистамин, играющий важную роль в стимуляции сокращения мускулатуры кишечника, спастических сокращений бронхов, а также в развитии аллергических и иммунных реакций: Триптофан – незаменимая аминокислота — является предшественником серотонина. В организме триптофан гидроксилируется в 5-гидрокситриптофан Который в результате декарбоксилирования превращается в серотонин: Серотонин играет исключительно важную роль в обмене веществ у высших млекопитающих, регулируя передачу импульсов в нервных тканях и кровяное давление. Производными аминокислот являются многие нейропептиды, гормоны гипофиза и т. д. Смеси аминокислот, а также индивидуальные аминокислоты применяют в медицине для парентерального питания больных с заболеваниями пищеварительных и других органов, при нарушениях обмена веществ. γ-Аминомасляная кислота (ГАМК, аминалон) содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге.
Применяется как лекарственное средство при сосудистых заболеваниях головного мозга (атеросклерозах, гипертонии, нарушениях мозгового кровообращения). ГАМК является основным медиатором, участвующим в процессах центрального торможения. Под ее влиянием активируются энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. Аминокапроновая кислота (ε-аминокапроновая кислота) оказывает специфическое крововостанавливающее действие при кровотечениях, связанныхс повышением фибринолиза.
Белки (Самостоятельная работа студентов). Белки представляют собой соединения, в полипептидных цепях которых содержатся более 50 аминокислотных остатков. Они делятся на белки, состоящие только из остатков аминокислот (простые белки, или протеины) и на белки, в состав которых помимо аминокислот входят остатки соединений, относящихся к другим классам (сложные белки, или протеиды). Небелковую (т. е. не аминокислотную) часть молекулы называют простетической группой; она определяет классификацию белков на группы: гликопротеины — аминокислоты + углеводы; липопротеины — аминокислоты + липиды; нуклеопротеины — аминокислоты + нуклеотиды; фосфопротеины — аминокислоты + фосфорная кислота; металлопротеины — аминокислоты + ионы металлов. Если сложный белок является ферментом, то его простетическая (небелковая) группа нередко является коферментом, т. е. соединением, необходимым для проявления каталитической активности фермента. Протеиновую (белковую) часть фермента в этом случае называют апоферментом. Отнесение белка к тому или иному классу делают на основе его первичной структуры. Строение белков. Вторичная структура белков (как и пептидов) отражает расположение полипептидной цепи в пространстве. Характер пространственной структуры полипептидной цепи обусловлен дополнительным образованием пяти типов связей между отдельными аминокислотными остатками, стабилизирующих структуру белковой молекулы: 1) дисульфидные мостики; 2) водородные связи; 3) ионные связи; 4) гидрофобные связи; 5) гидратируемые группы. При этом связываемые остатки могут находиться и на достаточно удаленных друг от друга участках полипептидной цепи. Рассмотрим основные типы связей, реализующихся в белковых молекулах. 1 .Дисульфидные мостики образуются между остатками цистеина за счет окисления тиольных групп в дисульфидные:
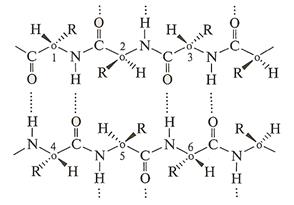
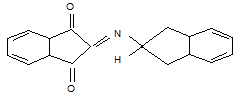
Мостики возникают как между остатками цистеина, расположенными в одной цепи (как, например, в окситоцине или вазопрессине), так и между остатками, находящимися в разных цепях, если белок состоит из более чем одной полипептидной единицы, как в инсулине (рис. 12) или иммуноглобулинах. 2. Водородные связи также являются ключевыми при формировании вторичной структуры белка, так как образование каждой водородной связи стабилизирует молекулу. Геометрия пептидной связи позволяет существование полипептидной цепи в нескольких видах: а) «сложенный лист»; б) α-спираль; в) неупорядоченная структура. Водородные связи могут образовываться между карбонильной группой одной пептидной связи и группой NH другой связи. Причем связываемые группировки могут находиться как в одной и той же цепи, так и в разных цепях:
Рис. 12 Фрагмент молекулы инсулина быка.
α-Спираль возникает за счет внутрицепочечных водородных связей, когда группы N—Н и С=0 находятся на разных участках одной и той же полипептидной цепи. Такой тип водородных связей возможен только в том случае, если основная цепь сворачивается в спираль с шагом в 3,6 аминокислотных остатка. Только при таком взаимном расположении групп N—Н и С=0, принадлежащих разным пептидным связям, виток спирали фиксируется водородной связью. Спиралевидная структура обеспечивает более энергетически выгодное расположение боковых групп друг относительно друга, что особенно существенно для аминокислотных остатков с объемными заместителями при α-углеродном атоме. Неупорядоченная структура характерна только для отдельных фрагментов цепи, которые чаще всего появляются между спирализованными и складчатыми участками в ходе формирования третичной структуры белка. 3. Ионные связи являются результатом электростатического взаимодействия и появляются в тех случаях, когда в боковой цепи имеются заряженные группы — катионы NH4+ (протонированные аминогруппы лизина, гуанидиновые группировки аргинина, основные атомы азота имидазольного кольца гастидина) и анионы СОО" (карбоксилат-анионы аспарагиновой и глутаминовой кислот). Возможно и электростатическое взаимодействие N- и С-концов полипептидной цепи. 4. Гидрофобные связи (гидрофобные взаимодействия) представляют собой результат несвязного взаимодействия неполярных алкильных групп боковых цепей таких аминокислот, как аланин, валин, лейцин, изолейцин за счет сил Ван-дер-Ваальса. 5. Гидратируемые группы оказывают влияние на формирование вторичной структуры белка, тогда когда молекулы воды, окружающие белковую молекулу, могут образовывать структуру, подобную структуре льда. Очень важно, что из всех перечисленных вариантов внутри- и межмолекулярных взаимодействий только дисульфидные мостики не зависят от показателя рН среды, полярности растворителя и ионной силы раствора. Дисульфидные мостики разрушаются только под действием восстановителей. Организованная определенным образом во вторичную структуру молекула белка затем укладывается в компактную плотную структуру, называемую третичной структурой белка. В ее образовании участвуют как регулярные (спирализованные или β-складчатые), так и аморфные участки полипептидной цепи. В некоторой степени третичная структура белков отражена в системе классификации белков, основанной на их растворимости в водных средах. В этом варианте классификации различают глобулярные белки, растворимые в воде и водных растворах кислот, оснований и солей, и фибриллярные белки, не растворимые в этих растворителях. Третичная структура фибриллярных белков характеризуется нитевидностью (лат. fibrilla — волоконце). Длина молекул этих белков в сотни раз больше их диаметра, что обусловлено параллельной (или антипараллельной) ориентацией их цепей. Цепи фибриллярных белков группируются друг около друга в виде протяженных пучков и отличаются очень большим числом межцепочечных водородных связей. Такие молекулы не растворимы в воде, так как растворение требует высоких энергетических затрат на разрыв водородных связей, и очень прочны, поэтому они являются основным строительным материалом живых тканей (например, кератины, коллаген, эластин, миозин, фиброин и пр.). Третичная структура глобулярных белков имеет вид компактных клубочков (лат. globulus — шарик). В глобулярных белках преобладают внутримолекулярные водородные связи; число межмолекулярных связей невелико. Все или почти все полярные группы глобулярных белков расположены на поверхности молекул; гидрофобные остатки находятся внутри свернутой цепи. Гидратация молекул энергетически выгодна из-за доступности полярных групп и немногочисленности межмолекулярных водородных связей, что и обеспечивает высокую растворимость глобулярных белков. В организме глобулярные белки выполняют роль регуляторов и стабилизаторов процессов жизнедеятельности; к ним относятся ферменты, гормоны, глобулины, альбумины, тканевые белки и т.д. У ряда белковых соединений несколько сложных полипептидных цепей могут агрегироваться вместе, создавая более сложный комплекс определенного строения, называемый четвертичной структурой белка. Каждую полипептидную цепь, образующую четвертичную структуру, называют субъединицей. Она сохраняет свойственные ей первичную, вторичную и третичную структуры, однако биологическая роль комплекса в целом отличается от биологической роли субъединиц вне комплекса. Фиксация четвертичной структуры обеспечивается водородными связями и гидрофобными взаимодействиями между субъединицами. Например, молекула гемоглобина — белка с четвертичной структурой — состоит из четырех субъединиц, окружающих гем (простетическую железосодержащую группу — железопорфирин); между субъединицами нет ковалентной связи, однако тетрамер представляет собой единое целое, в котором субъединицы прочно связаны и ведут себя в растворе как одна молекула. Наличие четвертичной структуры характерно также для других металлопротеинов и для иммуноглобулинов. При формировании четвертичной структуры белка образующийся комплекс может содержать помимо субъединиц полипептидной структуры и субъединицы иной полимерной природы, а также соединения других классов. Изменение условий, в которых находится молекула белка: варьирование рН среды, повышение температуры, облучение УФ-светом, рентгеновскими лучами, сильное механическое воздействие, давление, ультразвук — приводят к разрушению связей, обеспечивающих сохранение четвертичной, третичной и даже вторичной структуры, и, следовательно, к разрушению уникальной нативной (созданной природой) структуры белка. Этот процесс носит название денатурации белка. Нарушение нативной конформации белка может быть обратимым (если изменение структуры легко устранимо и нативная структура восстанавливается) и необратимым (особенно выражено при повышении температуры, лучевом воздействии, обработке сильными кислотами и щелочами). Денатурация белка сопровождается снижением гидрофильности белковых молекул, уменьшением стабильности растворов белка в изоэлектрической точке, повышением реакционной способности функциональных групп молекулы. Большинство белковых молекул проявляют специфическую функциональную активность только в узком интервале значений рН и температуры (физиологические значения). В результате изменений указанных параметров белок теряет активность из-за денатурации. Денатурированные белки существуют в виде случайных хаотических петель и клубков, форма которых подвержена изменениям. Поверхностные свойства белков. Белки являются поверхностно-активными веществами, что связано с наличием в молекуле фрагментов с различными гидрофильно-гидрофобными свойствами. Поверхностную активность белки проявляют прежде всего за счет боковых цепей. Таким образом, белки являются стабилизаторами лиофобных дисперсных систем — эмульгаторами жиров и холестерина; осуществляют транспорт жиров из кишечника в ткани. Каждый белок имеет свойственные только ему последовательность аминокислотных остатков, пространственную структуру и функции. Функции белков в организме разнообразны. 1. Каталитическая функция Обмен веществ (пищеварение, дыхание и др.), мышечные сокращения, нервная проводимость функционирование клетки в целом происходят под действием высокоспецифических и высокоэффективных катализаторов ферментов, Являющихся белками, например, рибонуклеаза, каталаза, алкогольдегидрогеназа По своей эффективности ферменты в Миллионы и Миллиарды раз превосходят эффективность химических катализаторов. К настоящему времени охарактеризовано несколько тысяч ферментов, свыше тысячи из них получены в индивидуальном состоянии, В соответствии с типом катализируемых реакций ферменты подразделяются на оксидоредуктазы (ОВР), трансферазы (реакции переноса функциональных групп), гидролазы (реакции гидролиза), лиазы (реакции отщепления групп негидролитическим путем), изомеразы (реакции изомеризации) лигазы (реакции синтеза за счет энергии АТФ). 2. Строительная или пластическая функция Структурные белки составляют основу костной и соединительной тканей, шерсти, роговых образований, мембран. Например, коллаген соединительных тканей, α-кератин волос и шерсти, мембранные белки. Коллаген составляет около 1/З всех белков позвоночных. Волокнам коллагена очень прочны, они входят в состав сухожилий, кожи, хрящей, кровеносных сосудов. З. Сократительная функция Белки сократительной системы участвуют в организме в выполнении механической работы, а следовательно, в движении. Перемещение хромосом в процессе деления клеток, проникновение вируса в бактерию, транспорт веществ через мембрану, движение микроорганизмов и работа мышц — это примеры трансформации химической энергии в энергию движения. Примеры сократительных белков: миозин, актин (белки мышц). 4. Регуляторная функция Регуляторные белки регулируют обменные процессы, контролируют биосинтез белков и нуклеиновых кислот. К ним относятся и пептиднобелковые гормоны, которые секретируются эндокринными железами. К белковым гормонам относятся такие важнейшие соединения, как инсулин, гормон роста соматотропин, некоторые гормоны гипофиза — центральной железы внутренней секреции: тиротропин, гонадотропин, лютропин, липотропин. Паратгормон синтезируется в паращитовидных железах. 5. Транспортная функция Транспортные белки (белки-переносчики) осуществляют перенос метаболитов, ионов, липидов, сахаров, аминокислот по руслу крови, во внеклеточных тканевых жидкостях, а также внутрь клеток через биологические мембраны (гемоглобин, миоглобин — переносчики кислорода). Липопротеины плазмы переносят липиды в виде белоклипидных комплексов. 6. Энергетическая функция Большое значение имеют пищевые и запасные белки, которые снабжают организм энергией (казеин, проламины). При расщеплении 1 г белка выделяется 17,6 кДж энергии. Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходит при участии белков биоэнергетической системы (родопсин, цитохромы). 7. Защитная функция Защитные системы высших организмов формируются защитными белками. К ним относятся некоторые наиболее изученные белковые вещества, участвующие в проявлении защитных реакций организма. Основу их составляют белки иммунной системы (иммуноглобулины, которые ответственны а иммунитет; антигены тканевой совместимости, интерлейкины, интерфероны-противовирусные белки и т.п.), а также белки системы свертывания крови (тромбин, фибрин). Белки — необходимая составная часть продуктов питания. Недостаток белков в пище вызывает тяжелое заболевание — квашиоркор. В процессе пищеварения белки подвергаются гидролизу до аминокислот. Пищевая ценность белков зависит от содержания в них незаменимых аминокислот (триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин, фенилаланин). Растительные белки в питательном отношении менее ценны, чем животные. Они беднее лизином, метионином, триптофаном, труднее перевариваются. Инсулин — один из первых белков, первичная структура которого была установлена в 1954 г. Это гормон, вырабатываемый в поджелудочной железе. Молекула инсулина человека (М — 5807) состоит из двух пептидных цепей, соединенных между собой двумя дисульфидными мостиками. Одна цепь содержит 21 аминокислотный остаток, а другая — 30. Инсулин обнаружен у всех позвоночных. Основная физиологическая функция инсулина — регуляция уровня глюкозы в крови. Он улучшает усвоение глюкозы тканями и стимулирует ее превращение в гликоген, облегчает проникновение глюкозы в клетки. При нарушении функции поджелудочной железы количество вырабатываемого в организме инсулина уменьшается. Возникает тяжелое нарушение обмена веществ (сахарный диабет), при котором в крови резко повышается концентрация глюкозы (гипергликемия), наблюдается избыточное выведение глюкозы с мочой (глюкозурия), нарушается синтез белков и жиров. Введение инсулина дает лечебный эффект. Для медицинских целей инсулин получают из поджелудочной железы животных. Инсулин как лекарство применяют при сахарном диабете, в некоторых случаях — при общем истощении, поражениях печени, а также в лечении некоторых психических заболеваний. Лабораторный практикум. «α-Аминокислоты, пептиды, белки»
Цель: 1. Изучить химические свойства аминокислот. 2. Научиться с помощью качественных реакций определять – аминогруппу, ароматические аминокислоты, пептидные связи, белки. Техника безопасности: 1. С концентрированными кислотами и щелочами работать осторожно, под вытяжным шкафом, в очках. 2. С раствором нингидрина работу проводить под вытяжным шкафом, вдали от огня. Нингидрин не должен попадать на кожу.
Ход работы:
ОIIЫТ №1. Амфотерные свойства аминокислот. А) В пробирку поместите 5 капель 1% раствора α-аланина или аминокислоты и добавьте по каплям 9,1% хлороводородной кислоты подкрашенной индикаторам конго в синий цвет до появления розово-красной окраски. Напишите уравнение реакций и объясните изменение окраски. Б) В пробирку поместите 5 капель 1% р-ра аминокислоты м по каплям добавьте 0,1% раствор гиидроксида натрия, подкрашенного фенолфталеином до исчезновения окраски. Объясните происходящее явление и напишите реакции.
ОПЫТ №2. Реакция глицина с азотистой кислотой. В пробирку поместите 5 капель 1% раствора глицина и равный объем 5% раствора нитрата натрия. Добавьте 2 капли конц. уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа: реакция используется для качественного определения аминогрупп в аминокислотах. Напишите схему взаимодействия глицина с азотной кислотой.
ОПЫТ №3. Нингидриновая реакция на аминогруппу в α – положении. Растворы α – аминокислот при нагревании с нингидрином дают сине-фиолетовое окрашивание. В этой реакции α – аминокислоты окисляются нингидрином, подвергаясь при этом окислительному дезаминированию и деркабоксилированию.
Нингидрин α – аминокислота альдегид нингидрин (восст.)
Восстановленный нингидрин конденсируется с другой молекулой нингидрина в окисленной форме, образуя окрашенный продукт конденсации.
В пробирку поместите 4 капли 1% раствора глицина и 0,1% раствора нингидрина. Содержимое пробирки осторожно нагреть до появления сине-красного цвета.
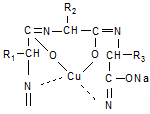
ОПЫТ №4. Биуретовая реакция на пептидные связи. В щелочной среде при добавлении к раствору белка гидрата окиси меди образуется комплексное (хелатное) соединение розово-фиолетового цвета. Такую реакцию дают белки, некоторые аминокислоты, пептиды, биурет, средние пептиды. Впервые данный комплекс получен Биуретом (NH2CONHCONH2). Отсюда и название – биуретовая реакция. Схематично реакцию Cu(OH)2 пептидами можно представить так:
Кетонная форма полипептида
Енольная форма Биуретовый комплекс
В пробирку поместите 5-6 капель белка, добавьте равный объем, 30% раствора NaOH и по стенке добавьте 1-2 капли раствора сульфата меди. Наблюдается появление красно—фиолетового окрашивания.
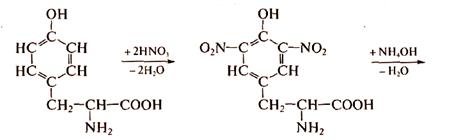
ОПЫТ №5 Ксантопротеиновая реакция на ароматические аминокислоты Ксантопротеиновая реакция на ароматические аминокислоты - реакция нитрования бензольного ядра циклических аминокислот концентрированной азотной кислотой
Тирозин Динитротирозин (желтый)
В результате образуется нитропроизводные аминокислот, имеющие желтую окраску. В щелочной среде нитропроизводные образуют соли хиноидной структуры. окрашенные в оранжевый цвет (ксантиновый)
Натриевая соль динитротирозина (оранжевый)
В белке содержится достаточное колнчесво ароматических аминокислот, поэтому ксантопротеиновая реакция применяется и для определения белков. В пробирку поместите 10 капель раствора тирозина и 2 капли конц. азотной кислоты. Содержимое пробирки осторожно нагрейте до растворенья осадка. Образуется раствор лимонно-желтого цвета. Охладив пробирку осторожно добавьте 1-3 капли 10% раствора гидроксида натрия до появления ярко—оранжевого цвета. Написать уравнения реакции.
ГЛАВА 9. УГЛЕВОДЫ.
Вопросы к занятию.
1. Общая характеристика и классификация углеводов. 2. Моносахариды, их стереоизомерия (D и L-ряды). 3. Цикло-оксотаутометрия. Формулы Хеуроса, мутаротация. 4. Химические свойства моносахаридов: реакции по >C=О, ОН-связи. 5. Глюкозидный гидроксил. Пентозы (ксилоза, рибоза) и гексозы (глюкоза, фруктоза, галактоза). 6. Олигосахариды. Дисахариды: лактоза, сахароза (строение, состав, циклооксотаутометрия). 7. Восстанавливающие и не восстанавливающие дисахариды. Виды О-гликозидной связи. 8. Полисахариды: крахмал, гликоген, целлюлоза, декстрины. 9. Гетерополисахариды и их роль в биологии и медицине.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.255.122 (0.012 с.) |