
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт №3. Йодоформная проба на ацетон.Содержание книги
Поиск на нашем сайте
К раствору ацетона прибавьте около 1 мл раствора йода. Сюда же, перемешивая, прилейте по каплям раствор едкого натра – столько. Чтобы жидкость обесцветилась. Что наблюдается? Какой ощущаете запах? Запишите результаты и схему образования йодоформа из ацетона. В выводе укажите, по какому центру в альдегиде протекает данная реакция?
Опыт№4. Получение оксима ацетона.
В пробирку поместите по одной лопаточке солянокислого гидроксил амина, безводной соды и 10-15 капель воды. Подождите пока выделится основная масса СО2, затем охладите и добавьте при хорошем перемешивании 15 капель ацетона. Смесь разогревается и выпадают кристаллы оксима ацетона. Напишите уравнение реакции.
Опыт №5. Получение динитрофенилгидразона. В пробирку поместите одну лопаточку 2,4-динитрофенилгидразина и такое же количество CH3COONa (кристаллы), добавьте 1 мл 2 Н раствор HCl. Хорошо перемешайте и прибавьте 2-3 капли чистого ацетона. При сильном встряхивании образуется жёлтый кристаллический осадок гидразона ацетона. Напишите схему реакции образования 2,4-динитрофенилгидразона ацетона.
ГЛАВА 5. КАРБОНОВЫЕ КИСЛОТЫ. Вопросы к занятию.
1. Электронное строение карбоксильной группы. 2. Кислотность и основность карбоновых кислот с точки зрения протолитической теории. 3. Влияние на кислотность карбоновых кислот структуры органического заместителя в молекуле кислоты. 4. Классификация, изомерия и номенклатура карбоновых кислот. 5. Химические свойства карбоновых кислот. 6. Механизм реакции этерификации. 7. Хлорангидриды, ангидриды, амины и нитрилы производные карбоновых кислот. 8. Ди- и трикарбоновые кислоты и особенности их поведения. 9. Медико-биологическое значение карбоновых кислот.
Строение, номенклатура и физико-химические свойства Карбоновых кислот Органические соединения, содержащие карбоксильную группу По систематической номенклатуре ИЮПАК названия карбоновых кислот образуют от названий родоначальных углеводородов с тем же числом атомов углерода с добавлением окончания -овая кислота. Названия циклических и ароматических карбоновых кислот образуют добавлением к названию родоначального углеводорода слов карбоновая кислота. Нумерацию цепи начинают с атома углерода карбоксильной группы. Для кислот использу- ются и тривиальные названия, которые применяют также для замещенных кислот, обозначая положение заместителей греческими буквами. В этом случае углеродный атом, соседний с карбоксильной группой, обозначается как α-углерод, затем β-углерод, γ-углерод: γ β α R—СН2—СН3—СН2СООН и т. д.
Для названия аниона карбоновой кислоты RCOOӨ используется ее латинское тривиальное название с суффиксом -am, a для названия ее молекулярного остатка без гидроксильной группы, т. е. ацила Название функциональных производных карбоновых кислот (эфиров, амидов и т. д.) формируется на основе названий их ацильного остатка.
Низшие предельные монокарбоновые кислоты (C1—C9) представляют собой жидкости, а высшие предельные и ароматические кислоты - твердые вещества. Для карбоновых кислот характерна значительная межмолекулярная ассоциация вследствие образования циклических димеров или линейных ассоциатов за счет водородных связей: ассоциативный циклический димер линейные ассоциаты Таблица 12.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1820; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.53.238 (0.01 с.) |


 называются одноосновными карбоновыми кислотами, две – двухосновными и т. д. В зависимости от природы углеводородного остатка различают карбоновые кислоты: предельные, непредельные, ароматические, гетероароматические, гидрокси- и оксокислоты, аминокислоты и др. Одноосновные карбоновые кислоты общей формулы CnH2n+1COOH называются предельными кислотами.
называются одноосновными карбоновыми кислотами, две – двухосновными и т. д. В зависимости от природы углеводородного остатка различают карбоновые кислоты: предельные, непредельные, ароматические, гетероароматические, гидрокси- и оксокислоты, аминокислоты и др. Одноосновные карбоновые кислоты общей формулы CnH2n+1COOH называются предельными кислотами.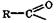 - то же название, но с суффиксом -ил. Примеры тривиальных и систематических названий некоторых карбоновых кислот, их анионов и ацильных групп приведены в табл. 12.
- то же название, но с суффиксом -ил. Примеры тривиальных и систематических названий некоторых карбоновых кислот, их анионов и ацильных групп приведены в табл. 12.



