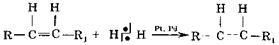Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции нуклеофильного замещения, нуклеофильного присоединенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте (реакции присоединения-отщепления). Реакции нуклеофильного замещения с участием
Такое сопряжение является причиной, с одной стороны, повышенной кислотности карбоксильных соединений, а с другой — уменьшения частичного положительного заряда (
На стадии II происходит атака нуклеофила (молекулы спирта Реакции нуклеофильного присоединения. Наиболее характерны реакции нуклеофильного присоединения (
На реакционную способность оксосоединения оказывает влияние природа групп R и
Обратите внимание, что последние стадии процесса представляют собой атаку нуклеофила (молекулы спирта
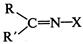
Другой пример биологически важной реакции этого типа — присоединение аминов и некоторых других азотсодержащих соединений к карбонильным соединениям — альдегидам и кетонам. Реакция идет по механизму нуклеофильного присоединения—элиминирования (
Другие азотсодержащие соединения, выступающие в этих реакциях в роли нуклеофила: гидразин Продуктами реакций
называемые гидразонами (X = Помимо указанных реакций присоединения возможны реакции AdR - свободнорадикального присоединения и полимеризации или поликонденсации. AdR - свободнорадикальное присоединение
Непредельные предельные Углеводороды углеводороды 4.Реакции полимеризации — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
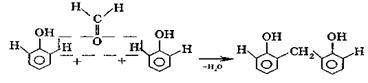
Примером реакции поликонденсации является поликонденсация фенола с альдегидами, в частности, с формальдегидом, в результате которой происходит образование полимерных продуктов реакции — фенолформальдегидных смол и твердых полимеров. Взаимодействие фенола с формальдегидом можно описать схемой:
димер
В ходе дальнейших стадий образуется полимер, а побочным продуктом реакции поликонденсации, в данном случае, является вода.
ГЛАВА 4. ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ).
Вопросы к занятию. 1. Электронное строение карбонильной группы (>C=0) в оксосоединениях. 2. Влияние заместителей на реакционную способность >C=0- связи в оксосоединениях. 3. Механизм нуклеофильного присоединения по >C=0 связи. 4. Реакции нуклеофильного присоединения (на примере воды, спиртов, бисульфита натрия, HCN). 5. Реакции присоединения- отщепления на примере гидроксиламина, гидразина, аминов. 6. Реакция диспропорционирования на примере бензилальдегида. 7. Механизм реакции альдольной конденсации. 8. Окисление альдегидов и кетонов. 9. Полимеризация альдегидов.
В зависимости от характера связанных с карбонильной группой заместителей карбонильные соединения делят на следующие классы: альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1078; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |

 - гибридизованного атома углерода. Механизм реакций этого типа рассмотрим на примере взаимодействия карбоновых кислот со спиртами (реакция этерификации). В карбоксильной группе кислоты реализуется p,
- гибридизованного атома углерода. Механизм реакций этого типа рассмотрим на примере взаимодействия карбоновых кислот со спиртами (реакция этерификации). В карбоксильной группе кислоты реализуется p,  -сопряжение, поскольку пара электронов атома кислорода гидроксильной группы ОН вступает в сопряжение с двойной углерод-кислородной связью (
-сопряжение, поскольку пара электронов атома кислорода гидроксильной группы ОН вступает в сопряжение с двойной углерод-кислородной связью (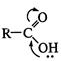
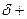 ) на атоме углерода карбоксильной группы (
) на атоме углерода карбоксильной группы (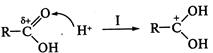

 ), протонирование гидроксильной группы с образованием хорошоуходящей группы
), протонирование гидроксильной группы с образованием хорошоуходящей группы  , на стадии III — ее отщепление и а стадии IV — регенерация протона — возврат катализатора с образованием конечного продукта — сложного эфира. Реакция обратима, что наблюдается при гидролизе сложных эфиров, гидролизе жиров в биосистемах.
, на стадии III — ее отщепление и а стадии IV — регенерация протона — возврат катализатора с образованием конечного продукта — сложного эфира. Реакция обратима, что наблюдается при гидролизе сложных эфиров, гидролизе жиров в биосистемах. ) для оксосоединений - альдегидов и кетонов. Механизм этих реакций имеет общие черты, это двухстадийный ионный процесс. Первая стадия (лимитирующая) представляет собой обратимую атаку нуклеофилом Nu: с образованием так называемого тетраэдрического интермедиата. Вторая стадия — быстрая атака электрофилом:
) для оксосоединений - альдегидов и кетонов. Механизм этих реакций имеет общие черты, это двухстадийный ионный процесс. Первая стадия (лимитирующая) представляет собой обратимую атаку нуклеофилом Nu: с образованием так называемого тетраэдрического интермедиата. Вторая стадия — быстрая атака электрофилом: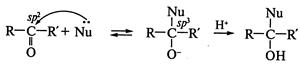
 . Так, введение электронодонорных заместителей снижает реакционную способность, а электроноакцепторных — усиливает. Поэтому альдегиды более активны в реакциях
. Так, введение электронодонорных заместителей снижает реакционную способность, а электроноакцепторных — усиливает. Поэтому альдегиды более активны в реакциях 
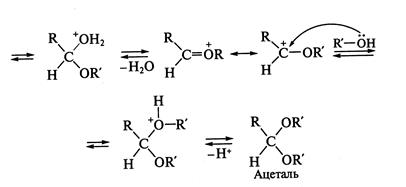
 . Образующиеся промежуточные соединения — полуацетали — являются неустойчивыми. Стабилизация их возможна только в циклической форме при образовании циклических полуацеталей, например 5-гидроксипентаналя:
. Образующиеся промежуточные соединения — полуацетали — являются неустойчивыми. Стабилизация их возможна только в циклической форме при образовании циклических полуацеталей, например 5-гидроксипентаналя: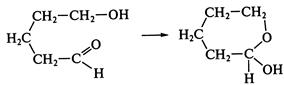
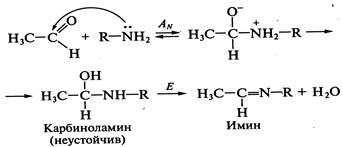
 , гидроксиламин
, гидроксиламин 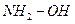 , фенилгидразин
, фенилгидразин  .
.
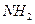 ), оксимами (X = ОН), фенил-гидразонами (X =
), оксимами (X = ОН), фенил-гидразонами (X =  ), иминами (X = R), что будет более подробно рассмотрено в соответствующих разделах.
), иминами (X = R), что будет более подробно рассмотрено в соответствующих разделах.