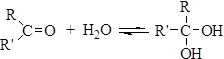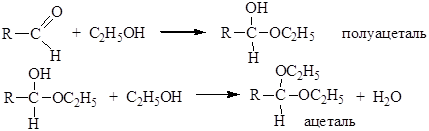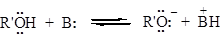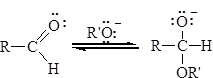Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронное строение и общая характеристика реакционной способностиСодержание книги
Поиск на нашем сайте
Электронное строение альдегидов и кетонов показано на примере муравьиного альдегида:
Связь углерод-кислород является одновременно более прочной и более реакционноспособной, чем двойная углерод – углеродная связь. Повышенная реакционная способность связи С=О вызвана различием электроотрицательности углерода и кислорода. В связи с появлением частичного положительного заряда на атоме углерода альдегиды и кетоны проявляют склонность к реакциям с нуклеофильными реагентами. Среди них реакции нуклеофильного присоединения и присоединения - отщепления. Особенности электронного строения служат причиной и других реакций альдегидов и кетонов: протонирование карбонильной группы, СН – кислотность при наличии водородных атомов у α-углеродного атома. Явление СН-кислотности состоит в повышенной подвижности атома водорода в α-положении по отношению к карбонильной группе, вызванной сильным –I-эффектом последней:
Электронная плотность от атомов водорода смещена на α-углеродный атом, этим вызвана легкость его замещения. Подвижностью атома водорода в α-положении объясняется и явление кето-енольной таутомерии альдегидов и кетонов
Кето-енольная таутомерия обуславливает некоторые реакции альдегидов и кетонов, которые будут рассмотрены ниже. Химические свойства альдегидов и кетонов Реакции присоединения 1.Присоединение воды. Вода присоединяется к альдегидам и кетонам, образуя неустойчивые гем -диолы:
Реакция обратима, гем-диолы легко образуются и снова распадаются с отщеплением воды, выделить их удается очень редко. Устойчивость гем-диолов существенно повышается при наличии электроноакцепторных заместителей, связанных с карбонильным атомом углерода. Например, трихлорацетальдегид (хлораль) легко присоединяет воду с образованием устойчивого продукта: Cl3CCHO + H2O ® Cl3CCH(OH)2 Образующийся хлоральгидрат – кристаллическое вещество с т. пл. 57°С. Устойчивость этого соединения связана с наличием электроноакцепторной трихлорметильной группы. Хлораль применяется в медицине как успокаивающее и снотворное средство. Другие альдегиды и кетоны также существуют в водных растворах в гидратированной форме с различным содержанием гем-диола: Таблица17.2 Содержание карбонильной формы и гем-диола в водных растворах альдегидов и кетонов
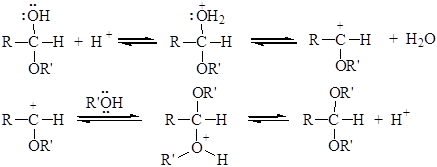
Водный раствор, содержащий 40% формальдегида, называется формалином Присоединение спиртов. Спирты, как и вода, реагируют с альдегидами и кетонами:
При этом образуются соединения, содержащие один алкоксильный остаток -OR’ (полуацетали, полукетали) или два - ацетали, кетали. Образование полуацеталей катализируется и кислотами, и основаниями: Кислотный катализ
На первой стадии происходит протонирование атома кислорода карбонильной группы, на второй стадии образовавшийся карбокатион присоединяет молекулу спирта, реакция завершается депротонированием аддукта. Активация карбонильной группы в реакциях присоединения воды и спиртов может происходить двумя способами:
Первый путь – специфический кислотный катализ, когда реакция ускоряется Н+. В этом случае скорость реакции изменяется с изменением рН среды (образование оксониевого катиона) и не зависит от природы кислоты. Во втором случае реакция катализируется не протонами (т.е. диссоциировавшей кислотой), а недиссоциированной кислотой в целом. В этом случае говорят об общем кислотном катализе. Положительный заряд на карбонильном атоме углерода увеличивается за счет образования водородной связи. Протон в этом случае переносится на карбонильный атом кислорода только при атаке нуклеофила. В этом случае природа кислоты оказывает существенное влияние: чем сильнее кислота, тем выше скорость реакции. Необходимость активирования карбонильной группы кислотным катализатором будет тем больше, чем менее нуклеофильно основание. По этой причине сильно основные азотистые соединения (аммиак, амины, гидроксиламин, гидразин и др.) легко реагируют с альдегидами и кетонами в нейтральной или даже слабощелочной среде, в то время как спирты, менее нуклеофильные, часто требуют добавления кислот, так же как и очень слабые азотистые основания, например 2,4 – динитрофенилгидразин. Основной катализ 1 Стадия – образование алкоксид-иона:
2 Стадия – присоединение нуклеофильного реагента:
3 Стадия – присоединение протона к образующемуся на второй стадии алкоксид-иону:
Реакция образования ацеталей (кеталей) катализируется только кислотами. В качестве исходного может быть использован альдегид или полуацеталь:
Реакции присоединения спиртов с образованием ацеталей и кеталей являются обратимыми. Они относятся к кислотно-катализируемым реакциям. Ацетали устойчивы к действию оснований. 3. Присоединение синильной кислоты. Синильная кислота присоединяется к карбонильным соединениям с образованием гем-цианоксидов (циангидринов). Реакция катализируется только основаниями, которые позволяют получить активный нуклеофил CN- из слабой кислоты HCN. Циангидрины встречаются в природе, например, содержатся в косточках сливы, вишни, персика и в миндале. Циангидрины приводят к тяжелому отравлению в результате освобождения синильной кислоты внутри организма. Стадия 1 – образование цианид-иона:
В качестве оснований в этой реакции используют NaOH, K2CO3, третичные амины, но чаще всего реакцию проводят с использованием водного раствора цианида натрия или калия. Стадия 2 – медленное присоединение цианид-иона к карбонильной группе:
Стадия 3 – быстрое присоединение протона к алкоксид-иону:
Реакция обратима на всех стадиях, так как в щелочной среде образовавшийся циангидрин расщепляется. Выход продукта реакции зависит от пространственного строения карбонильного соединения: альдегиды образуют циангидрины легко (80-90%), метилкетоны, за исключением ацетона, более трудно. 4. Присоединение бисульфита натрия. Альдегиды и кетоны взаимодействуют с бисульфитом натрия, образуя хорошо растворимые в воде соли α-гидроксиалкансульфоновых кислот:
Этот метод используют для очистки альдегидов и кетонов. Для выделения их из гидросульфитных производных используют разбавленные кислоты и основания. 5. Реакции присоединения - отщепления. Большинство реакций присоединения - отщепления сводится к взаимодействию карбонильной группы с N-нуклеофилами. К N-нуклеофилам относят аммиак и его производные: R-NH2 где R = H, Alk, Ar, OH, NH2, NHC6H5, NHCONH2, NHCSNH2 Стадия 1 – медленное присоединение N-нуклеофила по карбонильной связи:
Стадия 2 – быстрый перенос протона с атома азота на атом кислорода:
Стадия 3 – отщепление воды (1,2-отщепление):
Продукт этой реакции называется имином или основанием Шиффа. Имины типа >C=NН называются незамещенными иминами, имины типа >C=NR - замещенными иминами. Многие другие производные аммиака также дают с альдегидами и кетонами аналогичные продукты конденсации. К таким производным относятся гидроксиламин (NH2OH), гидразин (NH2-NH2), фенилгидразин (NH2-NHC6H5) и семикарбазид (NH2-NHC(O)NH2). Продукты их конденсации с карбонильными соединениями называются соответственно оксимами, гидразонами, фенилгидразонами и семикарбазонами:
Конденсацию карбонильных соединений с этими реагентами часто проводят в присутствии электрофильного катализатора, чаще всего – протонных кислот. Реакции с сильными нуклеофилами протекают без катализатора, слабые нуклеофилы реагируют только в присутствии катализатора. Реакции с участием α-водородного атома 1. Альдольная конденсация. Под действием каталитических количеств водной кислоты или основания альдегиды превращаются в β-оксиальдегиды. Этот процесс носит название альдольной конденсации:
Альдольная конденсация, катализируемая основаниями. Катализируемая основаниями альдольная конденсация начинается с образования енолят-иона альдегида (стадия 1). Поскольку енолят-ион является нуклеофилом, то он атакует карбонильную группу другой молекулы альдегида. В результате образуется алкоксид-ион (стадия 2). Далее происходит протонирование алкоксид-иона водой, при этом образуется конечный продукт – альдоль и регенерируется катализатор (ОН-) (стадия 3). Это происходит потому, что алкоксид-ион является более сильным основанием, чем гидроксид-ион.
При нагревании в присутствии основания альдоли легко отщепляют воду, образуя a,b -ненасыщенные альдегиды. Дегидратация протекает легко благодаря кислому характеру атома водорода у a -углеродного атома углерода и вследствие того, что образующийся продукт содержит сопряженную систему двойных связей:
Этот тип конденсации получил название кротоновой. Альдольная конденсация, катализируемая кислотами. Механизм альдольной конденсации, катализируемой кислотами, включает две основных стадии: превращение кето-формы альдегида в енольную форму (стадия 1) и атака образовавшимся енолом карбонильной группы альдегида (стадия 2):
Альдоль под действием разбавленной кислоты отщепляет воду даже при комнатной температуре, поэтому конденсацию, катализируемую кислотой, практически невозможно остановить на стадии b- оксиальдегида:
Кетоны вступают в альдольную конденсацию значительно труднее, чем альдегиды. Однако, при катализе кислотами образующийся в небольших количествах 4-окси-4-метил-2-пентанон (продукт альдольной конденсации) будет быстро дегидратироваться в 4-метил-3-пентен-2-он (мезитилоксид):
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 591; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.007 с.) |