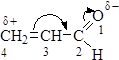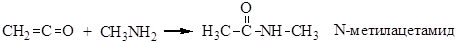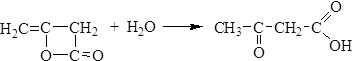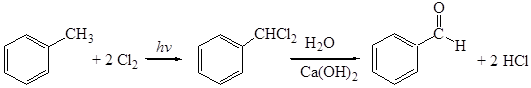Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Галогенирование альдегидов и кетоновСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакция галогенирования протекает с участием α-углеродного атома. С галогеном реагирует не само карбонильное соединение, а его енольная форма:
При присоединении галогена к енолу образуется неустойчивый галогенгидрин. От него отщепляется галогеноводород, и образуется α-галогензамещенное карбонильное соединение. Реакция катализируется щелочью. Если в молекуле альдегида или кетона с карбонильной группой связана метильная группа (метилкетоны и ацетальдегид), то при избытке галогена в ней замещаются все атомы водорода:
Тригалогенметильная группа является сильнейшим акцептором электронов, поэтому карбонильная активность полученного альдегида или кетона становится высокой, и гидроксид-анион, служивший катализатором в этой реакции, проявляет уже нуклеофильные свойства и атакует карбонильный атом углерода. От полученного аддукта сравнительно легко отщепляется тригалогенметил-анион, который стабилизируется присоединением протона и образует тригалогенметан:
Такая реакция носит название галоформной. При использовании йода в результате галоформной реакции образуется йодоформ – кристаллическое вещество желтого цвета, которое легко идентифицировать. Это позволяет использовать галоформную реакцию для обнаружения метилкарбонильных соединений, в этом случае ее называют йодоформной. Окислительно–восстановительные реакции Кетоны в нейтральной среде устойчивы к окислению, например, не реагируют с перманганатом калия. В кислой и щелочной среде кетоны окисляются с расщеплением углерод – углеродной связи, при этом образуется смесь продуктов:
Если R1 и R2 = Н, то в качестве продуктов окисления образуется две (в случае симметричных кетонов, R=R3) или четыре различных кислоты (R≠R3 – несимметричный кетон). В отличие от кетонов альдегиды легко окисляются практически любыми окислителями, даже кислородом воздуха. Легкость окисления альдегидов используют для качественного их обнаружения реакцией «серебряного зеркала» - восстановлением одновалентного серебра в аммиачном растворе:
Восстановление альдегидов и кетонов водородом в момент выделения приводит к образованию первичных и вторичных спиртов:
Отдельные представители
Формальдегид – бесцветный газ с резким специфическим запахом. Он ядовит, действует раздражающе на слизистые оболочки глаз и дыхательных путей. Хорошо растворим в воде, его 40%-ный водный раствор называют формалином и широко используют в качестве дезинфицирующего средства для дезинфекции зерно- и овощехранилищ, парников, теплиц. Формальдегид широко применяется в органическом синтезе, например в производстве синтетических смол (фенолформальдегидные, карбамидные), глицерина и т.д. При нагревании с аммиаком формальдегид образует гексаметилентетрамин (уротропин), который в больших количествах применяют в производстве фенолформальдегидных смол, взрывчатых веществ, а также в качестве горючего (сухой спирт) Уксусный альдегид (ацетальдегид) – жидкость с резким неприятным запахом, вызывает раздражение слизистых оболочек, удушье, головную боль. Из ацетальдегида в промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этиловый спирт, бутиловый спирт, ацетали, этилацетат и ряд других веществ. Подобно формальдегиду он конденсируется с фенолом, аминами и другими веществами, образуя синтетические смолы, используемые в производстве полимерных материалов. Ацетон – бесцветная жидкость с характерным запахом. Хорошо растворим в воде и органических растворителях. В качестве растворителя в очень больших количествах применяется в лакокрасочной промышленности, в производстве ацетатного шелка, кинопленки, бездымного пороха (пироксилина), для растворения ацетилена (в баллонах) и т.д. Он служит исходным сырьем при производстве небьющегося органического стекла, кетена и т.д.
Лекция 18. Ненасыщенные альдегиды и кетоны Изомерия. Классификация. Строение: сопряжение связей С=О и С=С. Акролеин и кротоновый альдегид. Способы получения. Химические свойства: особенности реакций электрофильного и нуклеофильного присоединения Кетены. Дикетен. Ненасыщенные альдегиды и кетоны, в зависимости от взаимного расположения двойной и карбонильной групп в молекуле, могут быть поделены на три группы: с кумулированными (кетены CH2=C=O), сопряженными (CH=CH2-COCH3 - метилвинилкетон, 1-бутен-3-он; CH2=CHCHO - акролеин, пропеналь) и изолированными (CH2=CHCH2CH2CH2COCH3) кратными связями. Из них наибольший интерес представляют соединения с сопряженными связями (акролеин, кротоновый альдегид, метилвинилкетон) – α,β-ненасыщенные альдегиды и кетоны
Для некоторых α,β-ненасыщенных альдегидов и кетонов сохранились эмпирические (акролеин) или рациональные (метилвинилкетон) названия. По номенклатуре IUPAC положение двойной связи и карбонильной группы указывают цифрами. Важнейшими представителями ненасыщенных альдегидов являются акролеин CH2=CH-CHO и кротоновый альдегид CH3-CH=CH-CHO. Существует несколько способов получения акролеина: 1. Альдольная конденсация формальдегида с ацетальдегидом. Первоначально образуется оксипропионовый альдегид, который далее подвергается дегидратации:
2. Прямое каталитическое окисление пропилена.
3. Дегидратация глицерина.
Акролеин используется для получения пластмасс, отличающихся большой твердостью. При конденсации акролеина с пентаэритритом получают полимеры, по внешнему виду напоминающие стекло. Акролеин используют в качестве исходного вещества для синтеза глицерина. Кротоновый альдегид получают кротоновой конденсацей ацетальдегида (см. Лекция №17). Применяется для получения масляного альдегида, бутанола, масляной кислоты, а также малеинового ангидрида. Химические свойства Акролеину, кротоновому альдегиду и другим непредельным соединениям с сопряженной двойной и карбонильными связями присущи реакции, свойственные алкенам и альдегидам. Взаимное влияние двойной связи и карбонильной группы находит отражение в некоторых особенностях химического поведения. Реакции присоединения к α,β-ненасыщенным альдегидам и кетонам могут протекать по типу 1,2-присоединения (т.е. по связям С=С или С=О) или по типу 1,4-присоединения.
1. Порядок присоединения HBr не соответствует правилу Марковникова и протекает по типу 1,4-присоединения аналогично диенам:
2. Синильная кислота присоединяется к акролеину по карбонильной группе (1,2-присоединение по карбонильной группе):
По карбонильной группе присоединяются также СН3MgI, NH2OH. 3. Гидросульфит натрия присоединяется не только по карбонильной группе, но и по двойной связи:
4. Присоединение галогенов по двойной связи протекает аналогично алкенам (1,2-присоединение по двойной связи).
Метилвинилкетон - простейший представитель ненасыщенных кетонов. Его получают преимущественно двумя способами: 1. Гидратация винилацетилена.
2. Конденсация формальдегида с ацетоном:
Метилвинилкетон проявляет свойства как кетона, так и алкена. Легко полимеризуется в прозрачную бесцветную стекловидную массу, используемую в производстве пластмасс. КЕТЕНЫ Кетенами называются соединения, содержащие группу >C=C=O.
Простейший кетен CH2=C=O (газ с т. кип. -48°С) может быть получен из бромангидрида бромуксусной кислоты под действием цинковой пыли:
В промышленности кетен получают пиролизом ацетона
и дегидратацией уксусной кислоты в присутствии катализаторов кислотного типа:
Строение кетена подобно аллену. Атом углерода карбонильной группы находится в состоянии sp-гибридизации, а второй атом углерода и атом кислорода находятся в sp2-гибридном состоянии Химические свойства Кетены чрезвычайно легко реагируют с водой и другими веществами, содержащими активный водородный атом (спиртами, кислотами, первичными и вторичными аминами). При этом образуются функциональные производные уксусной кислоты.
Кетен легко полимеризуется с образованием дикетена:
Дикетен реагирует с водой, спиртами, аминами, образуя ацетоуксусную кислоту и ее производные:
В промышленности из кетена получают уксусную кислоту, уксусный ангидрид, этилацетат, дикетен и другие вещества, являющиеся полупродуктами в производстве красителей и лекарственных веществ. Лекция 19. Альдегиды и кетоны ароматического ряда. Классификация кетонов: ароматические и жирноароматические. Номенклатура. Изомерия. Методы получения: из углеводородов и спиртов (окисление, дегидрирование), из дигалогенпроизводных (гидролиз), реакция Гаттермана, Фриделя – Крафтса. Химические свойства. Реакции окисления и восстановления. Присоединение нуклеофильных реагентов. Реакция Канниццаро. Для ароматических альдегидов и кетонов характерно наличие карбонильной группы >С=О, связанной с атомом углерода бензольного ядра или боковой цепи.
Первый тип соединений относится к ароматическим альдегидам и кетонам, а второй – к жирноароматическим. В рамках тривиальной номенклатуры ароматические альдегиды называют по названиям соответствующих карбоновых кислот:
Для жирноароматических за основу берут названия соответствующих альдегидов жирного ряда по радикальной или систематической номенклатуре:
Кетоны ароматического и жирноароматического ряда называют либо по радикальной номенклатуре, либо названия кетонов имеют суффикс -фенон:
Способы получения Ароматические альдегиды Способы получения альдегидов жирного ряда приемлемы и для получения ароматических альдегидов. Существуют также специальные методы получения ароматических альдегидов и кетонов. 1. Каталитическое окисление боковой цепи:
Данный метод имеет промышленное значение. 2. Гидролиз геминальных дигалогенпроизводных:
Гидролиз проводят в присутствии гидроксида кальция при температуре 95 – 100°С в присутствии железного катализатора.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1467; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.25.100 (0.009 с.) |