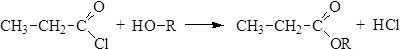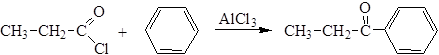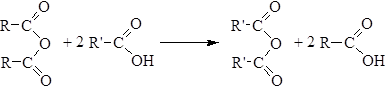Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Функциональные производные карбоновых кислотСодержание книги
Поиск на нашем сайте
При взаимодействии карбоновых кислот с нуклеофилами получают соединения общей формулы
Это функциональные производные карбоновых кислот, общим структурным элементом является ацильная группа К функциональным производным карбоновых кислот также относятся соли и нитрилы:
Чтобы дать названия производным карбоновых кислот надо знать номенклатуру ацильных групп (см. лекцию №20). Галогенангидриды карбоновых кислот Это соединения общей формулы
Названия галогенангидридов карбоновых кислот строят следующим образом:
Способы получения Галогенангидриды карбоновых кислот можно получать следующими способами: а) из карбоновых кислот действием PCl5, PCl3, PBr3, SOCl2
б) присоединением НХ к кетенам
Физические свойства Галогенангидриды карбоновых кислот высокополярные соединения. Они имеют довольно высокие температуры кипения и плавления. Галогенангидриды – соединения с резким, раздражающим запахом, что связано с их гидролизом с образованием НХ и карбоновой кислоты. Химические свойства На атоме углерода ацильной группы сосредоточен довольно высокий положительный заряд, обусловленный смещением электронной плотности:
Из строения галогенангидридов следует, что галоген чрезвычайно подвижен в этих соединениях и легко вступает в реакции с нуклеофильными реагентами, протекающими по схеме:
Галогенангидриды являются самыми сильными ацилирующими агентами, т.е. с их помощью можно вводить в молекулы органических соединений ацилы 1.Гидролиз галогенангидридов:
Ацилгалогениды гидролизуются водой без применения специальных катализаторов и образуют карбоновые кислоты. 2. Ацилирование спиртов (О-ацилирование, алкоголиз):
3. Ацилирование аминов и их проихводных (N-ацилирование, аммонолиз) приводит к образованию незамещенных и N‑замещенных амидов:
Примером N-ацилирования может служить получение бензанилида:
4. Ацилирование ароматических соединений (С-ацилирование, реакция Фриделя-Крафтса):
5. Реакция с солями карбоновых кислот приводит к образованию смешанных ангидридов:
Ангидриды карбоновых кислот Ангидриды карбоновых кислот называют согласно названиям соответствующих карбоновых кислот.
Способы получения Ацилирование карбоновых кислот и их солей ацилгалогенидами
2. Ацилирование карбоновых кислот ангидридами.
Взаимодействие карбоновых кислот с кетенами.
Физические свойства Ангидриды низших кислот (начиная с уксусной) – жидкости с резким запахом. Уксусный ангидрид имеет т. кип. 140°С, является одним из продуктов промышленного органического синтеза и широко используется в промышленности для ацилирования целлюлозы и аминов. Химические свойства 1.Гидролиз ангидридов карбоновых кислот протекает легко в присутствии кислот.
2. Ацилирование спиртов протекает в присутствии кислотных или основных катализаторов. Как ацилирующие агенты ангидриды менее реакционноспособны чем соответствующие галогенангидриды.
3. Ацилирование аминов и аммиака не требует применения катализаторов.
4.Ацилирование ароматических соединений Ангидриды широко используют для ацилирования реакционноспособных ароматических соединений в присутствии кислотных катализаторов.
Сложные эфиры Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров.
Способы получения 1.Этерификация карбоновых кислот спиртами в присутствии кислотных катализаторов.
Ацилирование спиртов ангидридами и хлорангидридами карбоновых кислот
Взаимодействие спиртов с кетенами
Взаимодействие кислот с алкенами и алкинами
Физические свойства Сложные эфиры низших спиртов и кислот – жидкости с приятным фруктовым запахом. Используются для ароматизации напитков; в качестве растворителей лаков и красок.
Химические свойства Гидролиз сложных эфиров Сложные эфиры легко гидролизуются в присутствии сильных кислот или оснований. Гидролиз протекает как реакция обратная реакции этерификации.
В щелочной среде реакция гидролиза необратима.
2. Переэтерификация – превращение одного сложного эфира в другой под действием соответствующего спирта в присутствии катализатора (кислотного или основного).
|
||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.195.180 (0.009 с.) |


 .
.