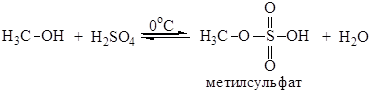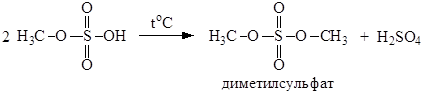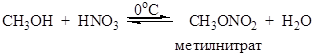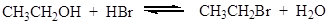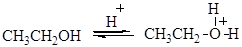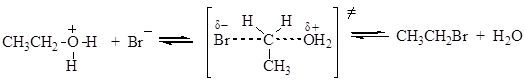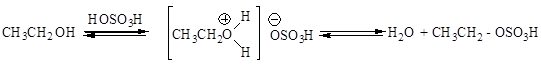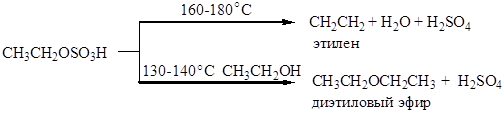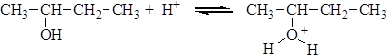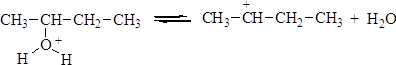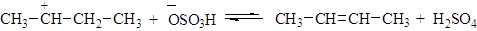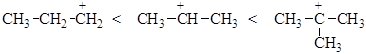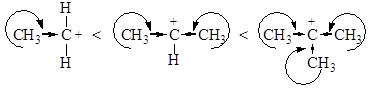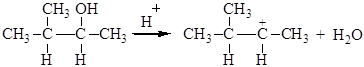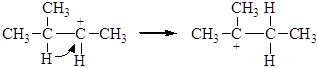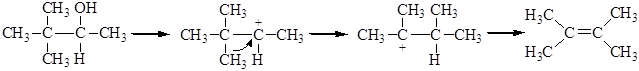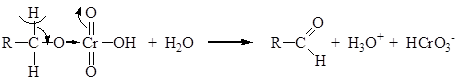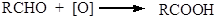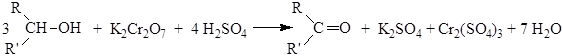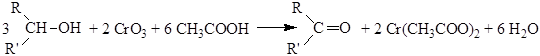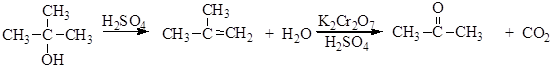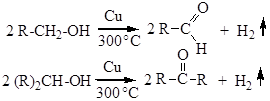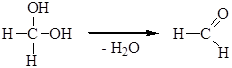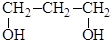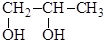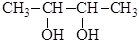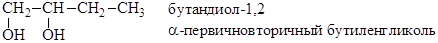Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие с неорганическими кислотамиСодержание книги
Поиск на нашем сайте Спирты взаимодействуют с кислородсодержащими минеральными кислотами приводит к образованию сложных эфиров неорганических кислот. Многоосновные кислоты образуют кислые и средние эфиры. Взаимодействие с серной кислотой проводят при низких температурах:
При нагревании этил- и метилсульфатов образуются соответствующие средние эфиры – диэтил- и диметилсульфаты:
Диметилсульфат – хороший метилирующий агент. Высшие спирты, особенно вторичные и третичные, под действием серной кислоты легко образуют алкены и не образуют эфиров в таких условиях. Метилнитрат получают взаимодействием метилового спирта с азотной кислотой:
Для получения нитратов двух- и трехатомных спиртов применяют смесь азотной и серной кислот. Многие полинитраты неустойчивы и при ударе взрываются. Некоторые моноэфиры фосфорной кислоты широко распространены в природе, например, фосфаты углеводов. ДНК и РНК являются полимерными эфирами фосфорной кислоты. Нуклеофильное замещение гидроксильной группы на галоген К реакциям нуклеофильного замещения относятся замещение гидроксильной группы на галоген, амино-, алкоксигруппу и др. Гидроксид-анион, который выступает в роли уходящей группы, относится к числу трудно замещаемых групп. Чтобы осуществить нуклеофильное замещение гидроксильной группы в спиртах, последние необходимо модифицировать таким образом, чтобы гидроксид-анион не выступал в роли уходящей группы. Часто реакции проводят в присутствии сильных кислот, в этом случае гидроксильная группа протонируется и отщепляется в виде молекулы воды. Замещение гидроксильной группы на галоген возможно под действием галогенводородных кислот (HCl, HBr) и галогенидов фосфора и серы. Наиболее важные химические превращения спиртов связаны с заменой гидроксильной группы на галоген под действием галогенводородных кислот:
Реакция протекает по механизму нуклеофильного замещения. В случае первичных спиртов реализуется SN2 механизм:
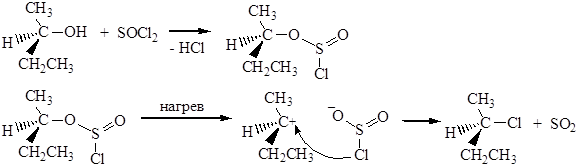
Третичные спирты реагируют по SN1 механизму. При действии PCl3 и PCl5 на спирты также образуются соответствующие галогенпроизводные: 3 CH3CH2-OH + PCl3 ® 3 CH3CH2-Cl + H3PO4 Взаимодействие спиртов с тионилхлоридом SOCl2 происходит по механизму, отличающемуся от рассмотренных ранее:
Атака вступающего нуклеофила происходит с той же стороны, откуда отщепляется уходящая группа, поэтому в молекуле сохраняется взаимное расположение атомов, в отличие от реакций Sn1и SN2. Механизм этой реакции нельзя отнести ни к Sn1,ни к SN2. Его обозначают символом Sni (замещение нуклеофильное внутримолекулярное). Реакция спиртов с SOCl2 в присутствии пиридина протекает иначе, по механизму SN2. Реакции отщепления В реакциях отщепления (элиминирования) Е проявляются основные свойства спиртов: CH3CH2OH ® CH2=CH2 В качестве катализаторов используют минеральные кислоты (серная, фосфорная), кислые соли (KHSO4), ангидриды кислот (Р2О5), оксид алюминия и т.д. Подробно эти превращения рассмотрены в методах получения алкенов. Кислотная дегидратация спиртов является практически важной реакцией: этим способом в промышленности получают изобутилен (из трет -бутанола), стирол (дегидратацией метилфенилкарбинола), а также изопрен (известный метод синтеза изопрена из изобутилена и формальдегида включает в себя заключительную стадию - дегидратацию диола и ненасыщенного спирта). Например, этиловый спирт образует этилен по следующей схеме:
Отщепление молекулы серной кислоты может происходить как внутримолекулярно (алкен), так и межмолекулярно (простой эфир)
Вторичные и третичные спирты в кислой среде легко отщепляют воду. Отщепление воды приводит к образованию карбкатиона. Направление реакции отщепления определяется правилом зайцева: водород отщепляется от наименее гидрогенизированного атома углерода, соседнего с углеродом, несущим гидроксильную группу. Реакция отщепления протекает по следующему механизму: 1. Протонирование молекулы спирта:
2. Отщепление молекулы воды с образованием алкил-катиона:
3. Отщепление протона с образованием алкена:
В зависимости от строения спирта образуются первичные, вторичные и третичные карбкатионы. По увеличению стабильности катионы располагаются в следующий ряд:
Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Мы имеем дело в данном ряду с индукционной стабилизацией и стабилизацией за счет сопряжения sС-Н связей с вакантной орбиталью атома углерода, несущего положительный заряд:
Образующиеся катионы в зависимости от их строения способны к перегруппировкам. Так, например, 3-метил-2-бутанол дает вторичный карбениевый катион, склонный к перегруппировке в более стабильный – третичный. Стадия 1:
Стадия 2:
Образование последнего связано с гидридным сдвигом (Н-) из положения 3 в положение 2. В перегруппировке может участвовать и алкильная группа:
Основное различие между тремя типами реакционных интермедиатов (карбкатионы, карбанионы и свободные радикалы) состоит в том, что карбкатионы имеют тенденцию изомеризоваться в более устойчивые частицы. Окисление Первичные и вторичные спирты могут быть окислены соответственно до альдегидов и кетонов. Третичные спирты устойчивы к окислению в мягких условиях. Первичные спирты окисляются до альдегидов под действием окислителей, содержащих Cr(VI). Это обычно хромовая кислота H2CrO4:
Окисление первичного спирта начинается с образования эфира хромовой кислоты RCH2-O-Cr(O)2-OH. На следующей стадии эфир претерпевает реакцию отщепления, в результате которой образуется двойная связь углерод – кислород:
Полученный альдегид далее окисляется до кислоты.
Чтобы избежать окисления альдегида его отгоняют из реакционной среды. Это возможно, так как получающиеся альдегиды неспособны к ассоциации и кипят значительно ниже соответствующих спиртов. Альдегиды можно также получить окислением первичных спиртов реагентом Саретта (комплекс CrO3 с пиридином). В относительно мягких условиях происходит окисление спирта раствором оксида хрома (VI) в разбавленной серной кислоте (окисление по Джонсу). Вторичные спирты легко окисляются до кетонов под действием окислителей: K2Cr2O7 в разбавленной серной кислоте, CrO3 в уксусной кислоте и KMnO4 в кислой среде:
Хромовая смесь окисляет и первичные, и вторичные спирты. Механизм окисления вторичных спиртов подобен окислению первичных спиртов в альдегиды, поэтому для получения кетонов пригодны методы, описанные выше. Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Третичные спирты окисляются в кислой среде. В качестве промежуточного продукта образуется алкен, который далее разлагается по схеме:
Дегидрирование спиртов. Этим способом получают многие альдегиды и кетоны, пропуская пары первичного или вторичного спирта над медным катализатором при 300°С:
В промышленности этот процесс реализован для получения формальдегида из метанола. Отдельные представители Метанол (метиловый, древесный спирт) – бесцветная жидкость со слабым спиртовым запахом. Большое количество его используют в производстве формальдегида, муравьиной кислоты, метил- и диметиланилина, метиламинов и многих красителей, фармацевтических препаратов, душистых веществ. Метанол - хороший растворитель, поэтому он широко применяется в лакокрасочной промышленности, а также в нефтяной промышленности при очистке бензинов от меркаптанов, при выделении толуола азеотропной ректификацией. Этанол (этиловый, винный спирт) – бесцветная жидкость с характерным спиртовым запахом. Этиловый спирт в больших количествах используется в производстве дивинила (перерабатывается в синтетические каучуки), диэтилового эфира, хлороформа, хлораля, этилена высокой чистоты, этилацетата и других сложных эфиров, применяемых в качестве растворителей лаков и душистых веществ (фруктовые эссенции). В качестве растворителя этиловый спирт широко применяется в производстве фармацевтических, душистых, красящих и других веществ. Этанол – хорошее антисептическое средство. Пропиловый и изопропиловый спирты. Эти спирты, а также их сложные эфиры применяются как растворители. В ряде случаев они заменяют этиловый спирт. Изопропиловый спирт используют для получения ацетона. Бутиловый спирт и его сложные эфиры применяют в больших количествах как растворители лаков и смол Изобутиловый спирт применяется для получения изобутилена, изомасляного альдегида, изомасляной кислоты, а также в качестве растворителя. Первичные амиловые и изоамиловые спирты составляют основную часть сивушного масла (побочные продукты при получении этилового спирта из картофеля или злаков). Амиловые спирты и их эфиры – хорошие растворители. Изоамилацетат (грушевая эссенция) применяется при изготовлении прохладительных напитков и некоторых кондитерских изделий. Лекция №15. Многоатомные спирты Многоатомные спирты. Классификация. Изомерия. Номенклатура. Двухатомные спирты (гликоли). Трехатомные спирты. Глицерин. Синтез из жиров и пропилена. Применение гликоля и глицерина в промышленности. ДвухАТОМНЫЕ СПИРТЫ Спирты, содержащие несколько гидроксильных групп, называются многоатомными спиртами. Двухатомные спирты называются гликолями или диолами, общая формула таких соединений СnH2n(OH)2. Две гидроксильные группы не могут находиться у одного атома углерода, такие соединения легко теряют воду, превращаясь в альдегиды или кетоны:
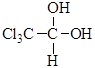
Это свойство типично для всех гем -диолов. Устойчивость гем -диолов повышается при наличии электроноакцепторных заместителей. Примером устойчивого гем -диола является хлоральгидрат:
Гликоли, содержащие гидроксильные группы у разных углеродных атомов, устойчивы. Изомерия и номенклатура Изомерия гликолей связана с изомерией углеродного скелета и взаимным расположением гидроксильных групп (α-, β-, γ-гликоли и т.д.) В двухатомных спиртах гидроксилы могут быть соединены с первичными, вторичными и третичными атомами углерода, поэтому различают гликоли двупервичные, первично-вторичные и т.д.: 1) первично – первичный гликоль
2) первично – вторичный
3) двувторичные и т.д.
Тривиальные названия двухатомных спиртов производятся от названия двухатомного радикала с прибавлением слова гликоль, например этиленгликоль, пропиленгликоль. По систематической номенклатуре пользуются окончанием - ол с указанием числа гидрокисльных групп – диол и цифр, указывающих положения гидроксильных групп:
Способы получения Способы получения двухатомных спиртов аналогичны способам получения одноатомных спиртов.
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1480; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |