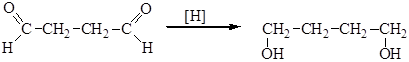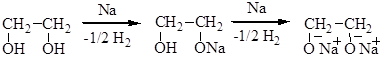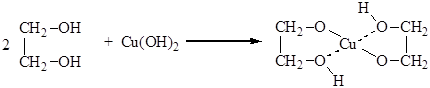Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз вицинальных дигалогенпроизводных или галогенгидриновСодержание книги
Поиск на нашем сайте
Окисление алкенов водным раствором перманганата калия или пероксидом водорода
3. Гидратация α-окисей
В результате реакции алкоголята и этиленоксида образуются соединения типа ROCH2CH2OH – целлозольвы: CH3CH2CH2CH2ONa + (CH2)2O + H2O ® CH3CH2CH2CH2-O-CH2CH2OH Каталитическое восстановление эфиров двухосновных кислот
Восстановление диальдегидов
Физические свойства Благодаря наличию межмолекулярных и внутримолекулярных водородных связей и большому числу полярных групп гликоли имеют более высокие температуры кипения, чем одноатомные спирты, хорошо растворимы в воде. Низкомолекулярные диолы – густые жидкости, высокомолекулярные – твердые вещества. СН3СН2ОН т. кип. 78.3°С СН2(ОН)-СН2ОН т. кип. 197.5°С Химические свойства Химические свойства диолов аналогичны свойствам одноатомных спиртов, но они могут вступать в реакции с участием одной или обеих гидроксильных групп. Со щелочными металлами образуют полные и неполные гликоляты, а с минеральными и органическими кислотами – полные и неполные эфиры. Образование гликолятов
Отличительной особенностью гликолей является реакция с гидроксидом меди с образованием гликолята меди (качественная реакция на вицинальные диолы)
Образование сложных эфиров
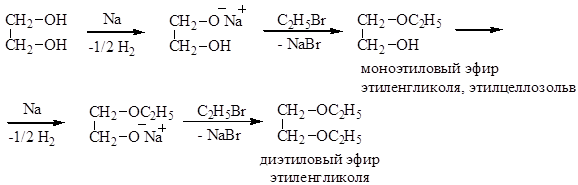
Образование простых эфиров
Реакции дегидратации Для гликолей характерны внутримолекулярные и межмолекулярные реакции дегидратации
Особо рассмотрим дегидратацию α-двутретичных гликолей (пинаконов) в присутствии серной кислоты, приводящую к образованию пинаколинов:
Такая перегруппировка получила название пинаколиновой. Дегидратация пинаконов над оксидом алюминия приводит к алкадиенам. Окисление Двухатомные спирты легко окисляются:
Отдельные представители Этиленгликоль и пропиленгликоль широко используют в производстве антифризов. Этиленгликоль применяется также в синтезе полимерных материалов – полиэтилентерефталата (лавсан), ненасыщенных полиэфиров, полиуретанов, алкидных полимеров и т.д. Из него получают этиленгликольдинитрат (для производства взрывчатых веществ и порохов), а также моно- и диацетаты этиленгликоля, являющимися хорошими растворителями. Простые моноэфиры этиленгликоля общей формулы ROCH2-CH2OH называются целлозольвы. Название «целлозольв» относится к 2-этоксиэтанолу. Эти вещества обладают хорошими растворяющими свойствами в отношении эфиров целлюлозы. Бутилцеллозольв – хороший растворитель; он используется в гидравлических тормозных жидкостях и добавляется к авиационному топливу в качестве антифриза. Карбитолы, являющиеся моноалкиловыми эфирами диэтиленгликоля, применяются в качестве растворителей, а также при изготовлении лаков. Их получают реакцией целлозольва с эквивалентным количеством этиленоксида. Карбоваксы (полимеры с различными молекулярными массами) получают реакцией этиленоксида с виц -диолами (например, этиленгликолем). Карбоваксы находят применение в качестве смазочных масел, компонентов мазей и жидкой фазы в газожидкостной хроматографии. ТРЕХАТОМНЫЕ СПИРТЫ Родоначальником гомологического ряда трехатомных спиртов является глицерин (пропантриол-1,2,3). Это вязкая нетоксичная жидкость с т. кип. 290°С, гигроскопична, смешивается с водой. Используется в пищевой, текстильной промышленности для получения пластмасс и лаков, порохов, ВВ, косметических и лекарственных веществ. Способы получения Гидролиз жиров Долгое время единственным источником получения глицерина в промышленных масштабах служило мыловаренное производство (гидролиз жиров – сложных эфиров глицерина и высших карбоновых кислот). Из пропилена В настоящее время глицерин получают из пропилена по схеме:
3. Из ацетилена:
Химические свойства По химическим свойствам глицерин не отличается от одно-, двухатомных спиртов. Со щелочными металлами, гидроксидами железа, меди, кальция и бария образует глицераты. С HCl, HBr дает моно- и дигалогенгидрины, с HI – трийодпропан. При действии PCl3, PI3, PBr3 все гидроксильные группы замещаются на галоген. При дегидратации глицерин образует акролеин (непредельный альдегид, образование которого мы наблюдаем при подгорании жиров):
Наиболее интересны сложные эфиры глицерина и кислот (карбоновых и минеральных). С карбоновыми кислотами глицерин образует сложные эфиры – жиры животного и растительного происхождения:
Интересны и сложные эфиры минеральных кислот, например, полный эфир азотной кислоты и глицерина – тринитрат глицерина, нитроглицерин (тривиальное название химически неверно) – взрывчатое вещество, применяемое для изготовления динамита и бездымного пороха. Динамит, пропитанный нитроглицерином кизельгут, был предложен Нобелем, что принесло ему большую прибыль, которую он завещал на ежегодные премии ученым (Нобелевские премии). Тринитрат глицерина применяют в медицине в качестве сосудорасширяющего средства. Сам глицерин играет важную роль в обмене веществ, входит в состав липидов. Ненасыщенные спирты Простейший ненасыщенный спирт – виниловый – неустойчив и превращается в ацетальдегид, он никогда не был выделен в индивидуальном состоянии:
Другие виниловые спирты также претерпевают аналогичное превращение в соответствующие карбонильные соединения. Известны, однако, простые и сложные эфиры виниловых спиртов, они могут быть получены путем присоединения спиртов и карбоновых кислот к ацетиленам:
Сложные эфиры виниловых спиртов находят применение при получении многих промышленно важных полимеров. Аллиловый спирт может быть легко получен гидролизом аллилхлорида:
Он вступает в большинство обычных реакций двойных связей и в соответствии с ожидаемым на основании химических свойств аллилгалогенидов оказывается значительно более реакционно способным, чем насыщенные первичные спирты, по отношению к реагентам, расщепляющим связь С-О:
Двойная связь не оказывает влияния на реакционную способность гидроксильной группы в том случае, если они разделены двумя или большим числом метиленовых групп, как в бутен-3-оле-1: СН2=СН-СН2-СН2ОН Лекция №16. Фенолы Одноатомные фенолы. Изомерия. Номенклатура. Способы получения: из арилгалогенидов, сульфокислот, аминов. Промышленный способ получения фенола из кумола. Химические свойства. Кислотность. Причины стабилизации фенолят-иона. Влияние заместителей на кислотность фенолов. Простые и сложные эфиры фенолов. Реакции электрофильного замещения (галогенирование, нитрование, сульфирование, нитрозирование). Реакция с формальдегидом. Фенолформальдегидные смолы. Особое место в органической химии занимают фенолы:
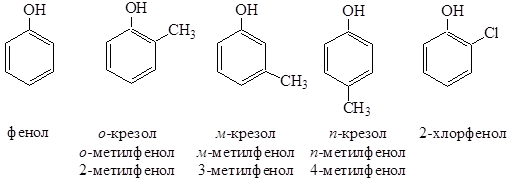
Фенол – тривиальное название, которое принято и в номенклатуре ИЮПАК. Многие фенолы сохраняют тривиальные названия:
По числу гидроксильных групп фенолы делят на одно-, двух-, трех- и многоатомные. Способы получения фенолов Коксование каменного угля Основная цель этого процесса состоит в производстве металлургического кокса. Побочно образуются жидкие продукты коксования и газ. Перегонкой жидких продуктов коксования наряду с бензолом, толуолом и нафталином получают фенол, тиофен, пиридин и их гомологи, а также более сложные аналоги с конденсированными ядрами. Доля каменноугольного фенола,по сравнению с получаемым кумольным методом, незначительна.
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 648; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |