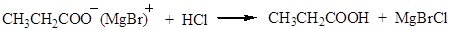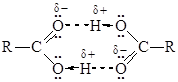Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Промышленные способы получения карбоновых кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 1. Окисление углеводородов. Существует два способа: окисление низших алканов C4-C8 преимущественно в уксусную кислоту и окисление твердого парафина в так называемые синтетические жирные кислоты (СЖК) с прямой цепью углеродных атомов С10-С20, являющихся сырьем для синтеза ПАВ (поверхностно-активных веществ). Процесс протекает в жидкой фазе при нагревании или в присутствии катализаторов. При окислении алканов происходит деструкция по связям между вторичными углеродными атомами, поэтому из н-бутана образуется главным образом уксусная кислота, а в качестве побочных продуктов – метилэтилкетон и этилацетат. 2.Синтезы на основе оксида углерода (II). Карбоновые кислоты получают на основе оксида углерода по реакции карбонилирования:
Присоединение по двойной связи при кислотном катализе всегда протекает по правилу Марковникова, вследствие этого только из этилена получается неразветвленная кислота, а из его гомологов - α-метилзамещенные кислоты. Особый интерес данный метод представляет для синтеза кислот с третичным радикалом (неокислот) из изоолефинов (реакция Коха):
Механизм реакции состоит в предварительном протонировании алкена кислотой с образованием иона карбения, его взаимодействия с СО с получением ацилий – катиона и реакции последнего с водой с образованием карбоновой кислоты:
Неокислоты и их соли обладают очень высокой растворимостью и вязкостью, а их сложные эфиры - стабильностью к гидролизу, что обеспечивает им широкое применение в ряде отраслей. Карбонилирование спиртов катализируется комплексами металлов (Ni, Со, Fe, Pd). Процесс реализован в промышленности для синтеза уксусной кислоты из метанола и характеризуется высокими экономическими показателями. Кислоты также получают окислением альдегидов (продукт оксосинтеза). Лабораторные способы получения карбоновых кислот 1. Окисление первичных спиртов см. Лекцию №14. 2. Окисление альдегидов и кетонов. Альдегиды окисляются значительно легче, чем кетоны. Кроме того, окисление альдегидов приводит к образованию кислот с тем же числом углеродных атомов, в то время как окисление кетонов протекает с разрывом углерод – углеродных связей (образуются две кислоты или кислота и кетон):
Окислителями служат перманганат калия или бихромат. Окисление кетонов требует более жестких условий, чем альдегидов. 3. Гидролиз нитрилов. Нитрилы получают взаимодействием галогеналканов с цианистым калием, а затем их подвергают гидролизу водными растворами кислот или щелочей. В кислой среде азот выделяется в виде соли аммония:
в щелочной - в виде гидроксида аммония, который разлагается с выделением аммиака, кислота же получается в виде соли:
4. Синтез Гриньяра. При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот:
Под действием сильной кислоты (обычно НСl) соль превращается в кислоту:
Гидролиз жиров Жиры - сложные эфиры карбоновых кислот и глицерина (триглицериды). Карбоновые кислоты, входящие в состав жиров имеют углеродную цепь от 3 до 18 углеродных атомов. Кипячение жиров или масел с водными растворами щелочей (NaOH, КОН) приводит к получению солей карбоновых кислот и глицерина. Эта операция называется омылением, так как соли карбоновых кислот используют для изготовления мыла. Физические свойства Низшие кислоты с числом атомов углерода до 3 – легколетучие бесцветные жидкости с характерным острым запахом, смешиваются с водой в любых соотношениях. Большинство кислот С4 – С9 – маслянистые жидкости с неприятным запахом. Растворимость в воде сильно уменьшается с ростом молекулярной массы. Кислоты от С10 и выше – твердые вещества, нерастворимые в воде. Плотности муравьиной и уксусной кислот больше единицы, остальных – меньше единицы. Температура кипения возрастает с увеличением молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят выше, чем кислоты с разветвленным углеродным скелетом. Сравнение температур кипения кислот и спиртов с одинаковым числом углеродных атомов показало, что кислоты кипят при значительно более высоких температурах, чем спирты. Это свидетельствует о более высокой ассоциации молекул кислот по сравнению со спиртами за счет образования водородных связей. Карбоновые кислоты, как и спирты, способны образовывать водородные связи. Если акцептором является достаточно сильное основание, образование водородной связи предшествует полному переносу протона к основанию. По Бренстеду соединение – донор водорода считают «кислотой». Будет ли данное соединение «донором водорода» («кислотой»), зависит от природы «акцептора водорода» («основания»). Чем сильнее основание, тем больше вероятность того, что данное соединение будет вести себя по отношению к нему как кислота:
Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:
С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается. Лекция 21. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ Строение карбоксильной группы. Кислотные свойства, константа кислотности, влияние на нее структурных и электронных факторов.Реакции со щелочами и карбонатами, металлами. Карбоксилат-анионы. Реакции замещения гидроксильной группы: взаимодействие схлоридами фосфора и тионилхлоридом. Механизм реакции этерификации. Кислотный катализ. Группы С=О и О-Н, образующие карбоксильную группу, взаимно влияют друг на друга и проявляют иные свойства, чем в карбонильных соединениях и спиртах.
Карбоновые кислоты имеют три реакционных центра, в соответствии с этим все реакции карбоновых кислот можно разделить на три типа: - протекающие с разрывом связи О-Н - протекающие с разрывом связи С-О - протекающие с разрывом связи С-Н
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 454; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.108.174 (0.008 с.) |