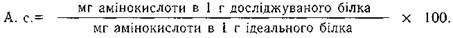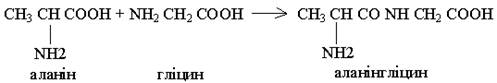Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Амінокислотний склад і структура білків.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Елементарною структурною одиницею білкової молекули є амінокислота. У природі виявлено близько 100 різних амінокислот, але тільки 20-22 з них входять до складу білків організму людини та харчових продуктів, близько 10 зустрічається рідко, а інші входять до складу деяких фізіологічних небілкових сполук (гормонів, антибіотиків та ін.) або містяться у рослинних і тваринних організмах у вільному стані. Усі амінокислоти поділяються за хімічною структурою на дві групи: ациклічні (жирного ряду) і циклічні (ароматичного ряду). Більшість амінокислот має ациклічну структуру. Будь-яка амінокислота у своєму складі обов'язково має дві головні функціональні групи: карбоксильну (СООН) і аміногрупу (NH2). Крім того, амінокислоти можуть мати гідроксильні радикали, ароматичні кільця, сульфгідрильні групи та ін. Більшість амінокислот — це α-амінокислоти, але зустрічаються і β-амінокислоти (β-аланін). Водні розчини амінокислот можуть мати нейтральну, слабокислу або слаболужну реакцію середовища. Це залежить від того, скільки і яких функціональних груп (NH2) і (СООН) входить до складу амінокислоти. Залежно від кількості аміно- і карбоксильних груп у молекулі амінокислоти розпізнають моноаміномонокарбонові кислоти (валін, аланін, гліцин, метіонін, лейцин, ізолейцин), моноамінодикарбонові (аспарагінова, глютамінова) кислоти, диаміномонокарбонові (лізин, аргінін, орнітин), диамінодикарбонові (цистин). Замінні амінокислоти - частина амінокислот які можуть утворюватися в організмі людини внаслідок процесів взаємного перетворення (глютамінова кислота, цистин, цистеїн, пролін). Незамінні амінокислоти – амінокислоти які не можуть утворюватися в організмі людини, а повинні надходити з харчовими продуктами. Для дорослої людини їх 8 (лізин, лейцин, ізолейцин, валін, метіонін, триптофан, фенілаланін, треонін), а для дітей додатково (гістидин і аргінін). На основі вивчення амінокислотного складу багатьох білків встановлено, що такі амінокислоти, як фенілаланін, пролін, тирозин, лейцин, ізолейцин, глютамінова кислота майже постійно зустрічаються в білках. Такі ж амінокислоти, як лізин, метіонін, аргінін, гістидин, зустрічаються значно рідше. Але це загальне положення не завжди можна застосувати до окремих специфічних білків. Так, наприклад, протаміни відзначаються високим вмістом аргініну (до 80%) і майже повною відсутністю лейцину та глютамінової кислоти. Для гістонів характерним є високий вміст аргініну і лізину і майже повна відсутність триптофану і цистину.
Залежно від амінокислотного складу білки бувають повноцінними і неповноцінними. Повноцінні білки - в своєму складі мають всі незамінні амінокислоти в оптимальному співвідношенні. Згідно з формулою ФАО (комітет ООН з продовольства і сільського господарства), оптимальне співвідношення незамінних амінокислот в молекулі повноцінного білка повинно бути таким: триптофан - 1, лейцин - 3-4, ізолейцин - 3, валін - 3, лізин - 3, метіонін - 3, фенілаланін - 4, треонін - 2. Нестача в раціоні харчування тієї чи іншої амінокислоти впливає в першу чергу на регенерацію білків. При відсутності валіну порушується координація рухів. Ізолейцин потрібен для нормального росту молодого організму. Лейцин дуже поширений у рослинних і тваринних білках, особливо багато його утворюється при проростанні зерна. При нестачі цієї амінокислоти затримується ріст молодого організму, зменшується маса тіла. Лізин — важлива незамінна амінокислота. Нестача лізину в їжі призводить до порушення кровотворення, зменшення кількості еритроцитів і зниження в них гемоглобіну, порушення кальцифікації кісток. Метіонін відіграє важливу роль в азотистій рівновазі в організмі. У молекулі метіоніну є легкорухлива метильна група, яка може порівняно легко передаватися на інші сполуки. Треонін відіграє важливу роль в розвитку тваринних організмів. Нестача треоніну призводить до зменшення маси тіла і навіть до загибелі тварини. Триптофан потрібен для утворення гемоглобіну, нормального росту організму. Головним джерелом триптофану є білки молока, м'яса, яєць, бобових. Фенілаланін відіграє важливу роль у діяльності щитоподібної залози, він утворює ядро в процесі синтезу гормону тироксину. Для визначення біологічної цінності білків використовують такий показник, як амінокислотний скор, який дозволяє виявити лімітовані незамінні амінокислоти. Визначення лімітованих амінокислот і ступеня їх нестачі проводиться шляхом порівнювання відсоткового вмісту амінокислот в досліджуваному білку і в такій же кількості умовно ідеального білка. Еталонами ідеального білка вважають білки материнського молока, курячого яйця і коров'ячого молока.
Усі амінокислоти, скор яких менше 100%, вважаються лімітованими, а амінокислота з найменшим скором є головною лімітованою амінокислотою (табл.2.9). Таблиця 2.9 Амінокислотний скор білків коров'ячого молока
АК — кількість амінокислот на 100 г білка, г; С — скор відносно білків жіночого молока, %.
У зв'язку з тим, що молекула амінокислоти у своєму складі має дві головні групи (NH2) і (СООН), ще в 1888 р. видатний хімік Л.Я.Данилевський висловив припущення, що при утворенні білка амінокислоти з'єднуються між собою ковалентним пептидним зв'язком. Це припущення було підтверджено в 1902 р. німецьким біохіміком Е.Фішером.
Пізніше, було встановлено що, крім пептидних зв'язків, при утворенні ланцюга амінокислот, які у своєму складі мають сірку, виникає дисульфідний зв'язок внаслідок окиснення сульфгідрильних груп.
Білок — це високомолекулярна сполука, яка складається із залишків амінокислот, з'єднаних між собою пептидним зв'язком або дисульфідним містком. Білки мають важливу особливість: кожній амінокислоті в молекулі білка відповідає суворо визначене місце. Він має кілька рівнів організації структури своєї молекули. АК – кількість амінокислот на 100 г білка, г; С – скор відносно білків жіночого молока, %. Амінокислотний склад білка і послідовність розміщення амінокислот в поліпептидних ланцюжках називають первинною структурою білка. У зв'язку з тим, що амідна група, яка входить до пептидного зв'язку, має атом водню, це забезпечує можливість утворення водневого зв'язку. Він може виникати як між окремими поліпептидними ланцюжками, так і між кільцями одного ланцюга. Чим більше водневих зв'язків утворюється в молекулі білка, тим нижча її енергія, тим вища її стабільність. Тому поліпептидні ланцюжки прагнуть утворити впорядковані жорсткі α-спіралі з максимально можливою кількістю водневих зв'язків. Ці спіралі нагадують різьбу гвинта, на одному витку якого вміщується 3,6 амінокислотного залишку, тобто водневі зв'язки у спіралі виникають через три амінокислоти на четверту. Але деякі амінокислоти не можуть укластись у спіральну конформацію. Якщо в поліпептидному ланцюгу зустрічається така амінокислота, то спіраль повинна перерватися, а поліпептидний ланцюг у цьому місці мусить набрати якоїсь іншої конформації. Іншим варіантом з'єднання поліпептидних ланцюгів є виникнення міжмолекулярних водневих зв'язків, які з'єднують сусідні поліпептидні ланцюги або ділянки білкової молекули. При цьому утворюється складчаста (β-структура). Поліпептидні ланцюги в цій структурі витягнуті, а пептидні групи лежать в одній площині. Так, наприклад, молекула колагену (білок сполучної тканини м'яса) являє собою три поліпептидні витягнуті ланцюги, з'єднані між собою міжланцюговими водневими зв'язками.
Спіральна або складчаста структура макромолекули, обумовлена утворенням водневих зв'язків, називається вторинною структурою білка. Міоглобін, гемоглобін, овоальбумін значною мірою побудовані з α-спіралей, у той час як β-лактоглобулін, β-хімотрипсин, пепсин - в основному неспіральні. Цілий ряд властивостей білкової молекули (ферментативна атакованість, термолабільність) залежать від її вторинної структури. Найбільш складні й тонкі особливості структури, які відрізняють один білок від одного, пов'язані з орієнтацією білкової молекули у просторі. Молекули багатьох білків мають округлу форму, тобто спіральні структури укладені або згорнуті в компактні глобули. Таке укладення стабілізується рядом вторинних зв'язків, які виникають між боковими радикалами амінокислотних залишків. До них належать дисульфідні зв'язки, гідрофобні взаємодії (сили Вандер-Ваальса) між неполярними радикалами, електростатичні сили взаємодії між полярними групами, сольові зв'язки та ін. Головну роль у стабілізації цього рівня організації макромолекул відіграє не пептидний скелет, а бокові ланцюги амінокислот. Конфігурація поліпептидної спіралі у просторі визначає третинну структуру білка. Дослідники вважають, що третинна структура виникає автоматично, як наслідок взаємодії амінокислотних радикалів з молекулами розчинника. При цьому кожна спіраль в певних умовах укладається тільки одним способом, набуваючи тієї форми, яка характерна для молекул природного білка. Третинна структура визначає зовнішню форму білкової молекули (глобулярну чи фібрилярну). Глобулярні білки молока, яйця, міоглобін, фібрилярні — колаген м'яса і риби, кератин волосся, нігтів, фіброїн шовку. При побудові четвертинної структури білкові субодиниці є ніби «цеглинками», з яких будується значно більша компактна глобула. Як правило, в такі мультимери об'єднуються неактивні молекули, які завдяки саме такій сполуці утворюють функціонально активну одиницю. Четвертинна структура являє собою більш складну конфігурацію, бо молекула білка складається з кількох субодиниць, кожна з яких займає фіксоване положення у просторі, внаслідок чого білок набуває біологічної активності. Об'єднання субодиниць в мультимер відбувається самовільно. Число субодиниць (протомерів, які входять у мультимер), різне — від чотирьох (у молекулі гемоглобіну) до кількох тисяч (білок вірусу тютюнової мозаїки). Четвертинна структура утворюється при виникненні ковалентних іонних зв'язків і слабких сил взаємодії між окремими функціональними групами, які містяться на поверхні глобул.
Часто четвертинна структура білка є основою його біологічної активності. Але треба підкреслити, що функціональна активність того чи іншого білка визначається не тільки четвертинною структурою, а всіма чотирма рівнями її організації. Усі ці рівні структури взаємно впливають один на одного, причому нижчий порядок організації визначає вищий. Властивості білків. Найважливіші властивості білків, які проявляються при переробці, зберіганні і використанні харчових продуктів: амфотерність, гідрофільність, здатність денатуруватись, гідроліз, гниття та деякі інші. Амфотерність білкової молекули обумовлена присутністю в молекулі амінокислоти (а отже, в молекулі білка) двох функціональних груп: аміногрупи, яка надає білку лужних властивостей, і карбоксильної групи, яка є носієм кислих властивостей. Завдяки цьому кожна молекула білка має свою ізоелектричну точку (ІЕТ) — таке значення рН середовища, при якому її заряд дорівнює нулю. У такому стані молекула білка найменше дисоційована і стабільна, бо вона не має найважливішого фактора стабільності — заряду. Різні білки мають різне значення ІЕТ. Так, ІЕТ для гемоглобуліну — 6,7, казеїну молока — 4,6; γ-глобуліну — 7,3, пепсину — 2,75. Знання цієї властивості допомагає цілеспрямовано вести технологічні процеси в ряді галузей харчової промисловості. Наприклад, при виробництві сиру необхідно викликати денатурацію головного білка молока казеїну, ІЕТ якого 4,6. Для цього знижують рН молока завдяки молочній кислоті, що утворюється при молочнокислому бродінні. При виробництві згущеного молока, навпаки, технологічний процес ведуть так, щоб зберегти високу дисперсність білків, тобто не допустити зниження рН, щоб білок не денатурувався. Гідрофільність білків визначається здатністю диполів води зв'язуватися іонами, іонними та полярними групами. Оскільки молекула білка має на своїй поверхні значну кількість полярних груп, вона може зв'язувати велику кількість диполів води. Білки можуть вбирати до 300% води порівняно зі своєю сухою масою. Вода фіксується силовим полем полярних груп (СОО-; NH3+; ОН- тощо) кількома шарами. У більшості харчових продуктів білки перебувають у набухлому стані. З цим зв'язана твердість, еластичність, пружність та інші структурні властивості м'яса, тіста, сиру, м'ясного і рибного фаршу. Найменшу здатність до набухання проявляють білки в ізоелектричному стані. Деякі білки можуть набухати безмежно, тобто розчиняються. Розчинність білків залежить від співвідношення полярних і неполярних груп, а також їхнього взаємного розташування в молекулі. Деякі білки з часом втрачають свою здатність розчинятися. Напевне, це пов'язано з певними змінами конфігурації білка у просторі. Ось чому після тривалого зберігання бобові та макарони погано набухають у воді. Денатурація білків - будь-яке негідролітичне порушення природної структури білкової молекули, яке викликає зміну його основних властивостей. Фактично це внутрішня перебудова молекули, яка не пов'язана з порушенням пептидних зв'язків. Внаслідок такої перебудови порушується унікальне розміщення і форма пептидних ланцюгів. Таким чином, при денатурації порушується четвертинний, третинний і вторинний рівні структури білка, і, як наслідок, змінюються його властивості. Здебільшого денатурація — процес невідновний.
Денатурація білків може викликатися найрізноманітнішими факторами, які викликають порушення тих форм зв'язку, завдяки яким були утворені відповідні рівні структури білкової молекули. На практиці найголовнішим фактором денатурації є теплова денатурація. Для багатьох білків температура +50°С уже є критичною. При підвищенні температури перш за все порушуються водневі зв'язки. Ступінь денатурації при нагріванні залежить від температури та часу її дії на білок, рН середовища, кількості води увібраної білком. Безводні білки витримують досить високу температуру, не зазнаючи помітних змін структури. Високотемпературна обробка харчових продуктів завжди супроводжується денатурацією (виробництво борошняних виробів, варіння м'яса, риби, овочів). Денатурація білків може викликатися зміною рН середовища. При цьому відбувається зміна електростатичних сил взаємодії завдяки збільшенню кількості полярних груп у субстраті. У харчовій промисловості широко використовують вплив рН середовища на стан білків. Виробництво кисломолочних продуктів, сичужних сирів, консервування за допомогою оцтової або молочної кислоти — в усіх цих випадках денатурація білків викликається зміною реакції середовища. Іони деяких металів Cu2+, Zn2+, Pb2+, Ca2+ викликають порушення третинної структури молекули білка внаслідок того, що вони впливають на кількість полярних груп у субстраті, так само як і зміна рН середовища. Денатурацію можуть викликати деякі органічні сполуки (сечовина, ферменти, алкалоїди, феноли та ін.). Ці речовини послаблюють гідрофобні сили взаємодії і викликають порушення третинної структури. Так, наприклад, при виробництві пива, вина велике значення для одержання високоякісного продукту має обробка цих продуктів дубильними речовинами. Внаслідок денатурації білків під впливом дубильних речовин напої стають прозорими, не мають осаду. При денатурації білків змінюються деякі їхні властивості: - форма і розмір молекули (деякі глобулярні білки стають схожими на фібрилярні); - збільшується в'язкість, а іноді білок ущільнюється. Наприклад, зміна вигляду білкової частини курячого яйця при тепловій денатурації; - атакованість протеолітичними ферментами (денатурований білок легше засвоюється); - розчинність, тому що денатурований білок не може зв'язувати воду. Крім того, при денатурації білок може виділяти частину рідини (процес коагуляції). Ось чому іноді при обсмажуванні продуктів маса зменшується. Гідроліз білків супроводжується розривом пептидних зв'язків, тобто порушенням первинної структури. При цьому утворюються такі проміжні продукти гідролізу, як альбумози, пептони, поліпептиди і нарешті амінокислоти. Продукти гідролізу легше розчиняються у воді, ніж самі білки, можуть надавати харчовим продуктам своєрідного смаку. Під час зберігання продуктів гідроліз білків призводить до погіршення якості м'яса, риби, сирів та інших товарів. Гідролітичний розпад білків найчастіше каталізується ферментами, рідше кислотами і лугами. Гниття — це глибокий розпад білків під впливом мікроорганізмів з виділенням аміаку, сірководню, індолу, скатолу, меркаптанів. Харчові продукти, білки яких почали гнити, не тільки непридатні для їжі, а й небезпечні для здоров'я людини. Класифікація білків. У природі відомо понад 2000 білків тваринного, рослинного і мікробного походження. Усі ці білки різноманітні за своїми біологічними властивостями, але близькі за хімічним складом. Створити єдину класифікацію білків поки що неможливо через недостатні знання структури багатьох білків. Білки поділяються залежно від складу на дві великі групи: прості - протеїни і складні - протеїди. Протеїни — це білки, які у своєму складі мають тільки залишки амінокислот, і тому при гідролізі таких білків кінцевими продуктами є лише амінокислоти. До простих білків належать альбуміни, глобуліни, глютеліни, гістони, проламіни, протаміни. Альбуміни — це білки, які розчиняються у воді, мають порівняно невелику молекулярну масу. До складу цих білків входять такі амінокислоти, як лейцин, лізин, аспарагінова і глютамінова кислоти. Представниками альбумінів є овальбумін (білок яйця), лактоальбумін (білок молока), лейкозин пшениці, легумелін гороху. Піна, яка утворюється при варінні овочів, кип'ятінні молока, — це в основному денатуровані альбуміни. Глобулін - не розчиняється у воді, але розчиняється в розбавлених розчинах нейтральних солей. Тваринний глобулін — це носій імунітету, тому його використовують для імунізації проти різних інфекційних захворювань. До складу глобулінів входять лізин, валін, лейцин, серин. До глобулінів належать лактоглобулін, овоглобулін, міозиноген (білок м'язів), фібриноген (білок крові), легумін гороху, фазеолін квасолі, туберин картоплі. Глютеліни - не розчиняються у воді і в нейтральних солях, але розчиняються в розбавлених лугах. Вони багаті лізином і глютаміновою кислотою. Типовими представниками глютамінів є глютелін пшениці, жита і кукурудзи, оризенін рису. Проламіни - погано розчиняються у воді, але добре розчиняються у 60-80%-му спирті. Всі проламіни — рослинні білки, вони багаті глютаміновою кислотою і проліном. До проламінів належать гліадин пшениці й жита, гордеїн ячменю, зеїн кукурудзи, авенін вівса. Проламіни і глютеліни при замішуванні пшеничного борошна з водою утворюють клейковину тіста, завдяки чому тісто стає еластичним і може утримувати гази, що утворюються під час бродіння. Протеїди — це білки, які в своєму складі, крім амінокислот, мають ще яку-небудь небілкову групу, котра називається простатичною. До цих білків належать фосфопротеїди, глікопротеїди, ліпопротеїди, хромопротеїди. Фосфопротеїди — це білки, до складу яких обов'язково входить фосфорна кислота, яка зв'язана ефірним зв'язком з оксигрупою таких амінокислот, як серин і треонін. Це важливі харчові білки для молодого організму. Представниками фосфопротеїдів є такі білки, як казеїноген молока, вітелін яйця, іхтулін ікри риб. Ліпопротеїди — складні білки, які мають залишки ліпідів. Вони розчиняються у воді і не розчиняються в органічних розчинниках. Ліпопротеїди є основою біологічних мембран рослин і тварин, які регулюють проникнення речовин з однієї клітини в іншу. Утворення ліпопротеїдів забезпечує перенесення і розчинність ліпідів у тканинах і клітинах. У вільному вигляді входять до складу крові, молока, жовтка яйця тощо. Глікопротеїди у своєму складі мають вуглеводи (глюкозу, галактозу, манозу). Ці білки зустрічаються в усіх тканинах рослин, тварин, мікробів і вірусів. Головними представниками глікопротеїдів є муцини і мукоїди, що входять до складу хрящів, кісток, рогівки ока, травних соків. Хромопротеїди - у своєму складі, крім залишків амінокислот, мають небілкові забарвлені сполуки, які можуть належати до різних класів органічних речовин. Вони досить поширені у продуктах рослинного і тваринного походження. Наприклад, сполуки хлорофілу з білком відіграють важливу роль в засвоєнні вуглекислого газу повітря рослинами; гемоглобін (сполука білка глобіну і барвної речовини гема) відповідає за забезпечення кожної клітини тваринного організму киснем. Нуклеопротеїди — складні білки, що мають нуклеїнові кислоти. Вони входять до складу кожної клітини, відіграють важливу біологічну роль не тільки тому, що беруть участь в утворенні структурних елементів клітин, а й тому, що виконують такі важливі функції в організмі, як передача спадкових властивостей.
Ферменти
У будь-яких живих організмах утворюються складні речовини білкової природи, які називаються ферментами і відіграють головну роль в обміні речовин та інших життєвих процесах організмів. Без ферментів організм загинув би від виснаження навіть при споживанні найпоживнішої їжі, тому що вона б не могла бути засвоєною. Ферменти — це специфічні речовини, пристосовані для виконання певної хімічної реакції. Якщо реакція складна, то її, подібно до автоматичної лінії, поетапно виконують декілька ферментів. Однією з особливостей тваринного організму є здатність здійснювати необхідні для життєдіяльності перетворення речовин при відносно низьких температурах. Так, наприклад, в лабораторних умовах сахароза гідролізується при тривалому нагріванні (65-67°С) із сильними концентрованими кислотами. Тим часом в організмі людини цей процес іде з великою швидкістю за короткий час при температурі близько 37°С та концентрації соляної кислоти 0,4-0,5%. Академік І.П.Павлов зазначав, що ферменти відіграють величезну роль, вони обумовлюють хімічні процеси, завдяки яким здійснюється життя, вони і є в повному розумінні збудниками життя. Ферменти діють як у клітинах, так і після виділення з клітин. Причому в клітинах вони за одних умов сприяють розпаду речовин, за інших - синтезу, поза клітинами ферменти лише розщеплюють речовини. Процеси ферментації сировини при виробництві багатьох харчових продуктів (вино, хліб, кисломолочні продукти) використовувались уже давно. Властивості ферментів. Головною відмінною властивістю ферментів є здатність каталізувати хімічні реакції. До того ж на відміну від неорганічних каталізаторів ферменти являються специфічними каталізаторами. Перш за все слід розпізнавати специфічність субстрату і реакції. Під специфічністю субстрату розуміють здатність ферменту каталізувати певні реакції в одному або декількох субстратах, які мають подібні структури. Специфічність ферментативної реакції — найважливіша біологічна властивість ферментів. Біологічні каталізатори не тільки регулюють швидкість хімічних реакцій, а й визначають, які речовини і в якій послідовності повинні зазнати перетворення. Взаємозв'язана дія ферментів організує життєві процеси, визначає з різноманітних можливих шляхів необхідний шлях процесу. Специфічність ферментів може виражатись по-різному. По-перше, більшість ферментів мають абсолютну специфічність, тобто перетворюють або один субстрат, якщо реакція мономолекулярна, або точно визначену пару субстратів, якщо реакція має бімолекулярний характер. По-друге, більшість ферментів каталізують тільки одне перетворення даної речовини, один тип реакції. Ця властивість має особливе значення для практики, оскільки при обробці ферментами складних систем необхідно провести реакції якогось конкретного типу. По-третє, ферменти, в разі оптичної ізомерії молекул, здатні впливати тільки на один ізомер. Ферменти мають високу «продуктивність праці». Доказом цього можуть служити кілька прикладів: одного грама реніну, який використовується в сироварній промисловості, достатньо для того, щоб викликати денатурацію казеїну, який міститься в 50 тоннах молока; амілаза слини проявляє каталітичну активність при розведенні 1:1 000 000. Ферменти як білки залежно від складу молекули можуть бути однокомпонентними (складаються тільки із залишків амінокислот, як протеїни) або двокомпонентними (крім залишків амінокислот мають ще небілкові групи, як протеїди). Якщо в молекулі двокомпонентного ферменту небілкова група є органічною сполукою, то вона називається коферментом. Молекула ферменту, беручи участь у прискоренні хімічної реакції, діє не всією своєю масою, а тільки певною ділянкою, яка дістала назву активного центру. Більшість ферментів має один активний центр, а деякі — два і більше. Кількість активних центрів перебуває у відповідній залежності від молекулярної маси ферменту. Чим більша молекулярна маса, тим більша кількість активних центрів утворюється в молекулі ферменту. Активний центр є динамічним утворенням з оптимальним розміщенням різноманітних функціональних груп, які зв'язують субстрат і забезпечують біокаталітичну реакцію. У зв'язку з тим, що активний центр визначає каталітичну активність і специфічність ферментів, то він повинен забезпечити досить тісну взаємодію з молекулами субстрату. Активний центр розташовується не в межах якого-небудь невеликого, відрізка одного поліпептидного ланцюга, а являє собою сукупність груп, розташованих на двох або кількох пептидних ланцюгах або на різних ділянках одного, але дуже закрученого пептидного ланцюга, і становить не жорстку структуру, а еластичну, яка мовби пристосовується до форми субстрату. В однокомпонентних ферментах активний центр утворюється безпосередньо амінокислотними залишками в заспіралізованому ланцюгу білкової молекули. Активною групою багатьох однокомпонентних ферментів виступають сульфгідрильні (SH) або гідроксильні (ОН) групи. У двокомпонентних ферментах активний центр утворюється небілковою ділянкою і деякими амінокислотними залишками, які примикають до цієї ділянки, але головною частиною активного центру все ж таки є кофермент. Швидкість і характер ферментативних реакцій залежить від таких чинників, як температура, рН середовища, окиснювально-відновний потенціал реакції, наявність активаторів (інгібіторів) специфічної або неспецифічної дії, а також від таких важливих параметрів процесу, як концентрація ферменту і концентрація субстрату. Вплив температури на швидкість ферментативної реакції досить багатоплановий. З одного боку, підвищення температури прискорює саму каталітичну реакцію, а з другого боку, прискорює денатурацію (інактивацію) ферментативного білка. При цьому треба мати на увазі, що при нагріванні денатурація відбувається набагато швидше, ніж будь яке інше хімічне перетворення. Дія всіх ферментів у значній мірі залежить від рН середовища, навіть при тих значеннях рН, коли не може бути й мови про інактивацію ферментного білка в лужному або кислому середовищі. Для кожного ферменту існує рН-оптимум активності. Іноді каталітична активність ферменту проявляється в досить вузькій зоні значень рН. Наявність оптимуму рН з'ясовується тим, що ферменти, як і всі білки, мають електричний заряд і їхня структура залежить саме від рН середовища. Швидкість ферментативної реакції залежить від наявності в системі активаторів або паралізаторів ферментів. Відома досить велика кількість речовин, які і тій або іншій мірі порушують природну структуру ферментного білка і тим самим гальмують швидкість тієї реакції, що каталізується цим ферментом. Так діють солі важких металів (міді, свинцю, ртуті та інших), формальдегід, сечовина тощо. Дуже важливим чинником, що впливає на швидкість ферментативного процесу, є концентрація ферменту. Частіше за все існує сувора пропорціональність між концентрацією ферменту і початковою швидкістю реакції. Класифікація ферментів. Нині відомо понад 2000 ферментів, і кількість їх постійно зростає. Відповідно до рішень Міжнародного біохімічного союзу в основу сучасної класифікації ферментів покладено типи хімічних реакцій, які вони каталізують. Згідно з цією класифікацією всі ферменти поділяються на 6 класів, кожен клас поділяється на підкласи, які, у свою чергу, поділяються на підпідкласи. Підпідкласи складаються з окремих представників. У сучасній науковій літературі використовують тривіальну (робочу) і систематизовану номенклатуру. Згідно з тривіальною номенклатурою назва ферментів більш коротка і не завжди показує характер дії ферменту. Наприклад: пепсин, трипсин, хімозин. Систематизована назва досить точно визначає дію ферменту, вона складається з двох частин: перша частина відповідає назві головного субстрату, друга — характерові каталітичної реакції плюс суфікс - аза. Так, наприклад, фермент, який каталізує гідроліз пептидного зв'язку між двома залишками гліцину, називається гліцилгліцину гідролаза. Оксидоредуктази — двокомпонентні ферменти, які каталізують окиснювально-відновні реакції, що відбуваються при диханні та бродінні як у живих організмах, так і в деяких харчових продуктах. У цьому класі ферментів найбільший інтерес становлять підкласи дегідраз, оксидаз і оксигеназ. Дегідрази - каталізують відщеплення водню від окиснюваної речовини і переселення його до будь-якої іншої речовини, що відновлюється. Оксидази — це ферменти, що каталізують переміщення водню від окиснюваної речовини до кисню. Оксигенази - каталізують приєднання кисню безпосередньо до якої-небудь речовини. Трансферази — каталізують реакції перенесення груп і атомів від однієї органічної речовини (донатора) до іншої (акцептора). Вони беруть участь в обміні нуклеїнових кислот, білків, вуглеводів, ліпідів. Залежно від того, яку групу переносять ферменти, вони одержують і відповідну назву: метилтрансфераза, амінотрансфераза, глюкозилтрансфераза. Гідролази - каталізують реакцію гідролізу. Більшість гідролаз — однокомпонентні ферменти, досить поширені у природі. При виробництві і зберіганні харчових продуктів найбільше значення мають три підкласи гідролаз: естерази, глікозидази, пептидази. Естерази - каталізують гідроліз ефірних зв'язків. До цього підкласу належать ліпази. Глікозидази - каталізують гідроліз глікозидних зв'язків. Сюди входять ферменти вуглеводного обміну (α- і β-амілази, інвертаза, целюлаза та ін.). Пептидази каталізують гідроліз пептидних зв'язків. До цього підкласу входять ферменти білкового обміну: пепсин, трипсин, амінотрипептидаза та ін. Ліази — це ферменти, що каталізують негідролітичний розпад складних сполук. Більшість ліаз — двокомпонентні ферменти і мають у своєму складі фосфорні ефіри водорозчинних вітамінів. Сюди входять ферменти, які каталізують реакції декарбоксилювання (піруватдекарбоксилаза), дезамінування (аспартатаміакліаза), розпаду фруктозодифосфату у процесах аеробного і анаеробного дихання (альдолаза). Ізомерази — ферменти, які каталізують поворотні внутрішньомолекулярні перетворення органічних речовин в їхні ізомери. Найбільше значення ферменти цього класу мають у процесах різноманітних бродінь, що відбуваються при виробництві та зберіганні багатьох харчових продуктів. Лігази (синтетази) - каталізують об'єднання простих молекул завдяки енергії розпаду аденозинтрифосфату (АТФ). Здебільшого це двокомпонентні ферменти. Ферменти широко використовуються при виробництві харчових продуктів. Сироваріння, виробництво вина, пива, кисломолочних продуктів, хліба, чаю було б неможливим, якби не було ферментів. Більшість цих процесів була відома людині задовго до того, як виникло саме слово «фермент», тому можна говорити, що практичне використання ферментів у харчовій промисловості почалося набагато раніше, ніж наукове вивчення цих речовин. Але в наші дні, коли ферментологія досягла досить високого рівня, вона стала активно втручатися у століттями відомі процеси, удосконалюючи їх, пристосовуючи до сучасних технологічних вимог, з метою поліпшення якості готової продукції. Наукові дослідження ведуться у напрямі одержання ферментних препаратів, які у своєму складі містять окремі ферменти різноманітного напряму. Деякі препарати такого типу вже використовуються, наприклад, при виробництві хлібобулочних виробів. За їх допомогою поліпшуються органолептичні властивості виробів, подовжується час зберігання хліба у свіжому вигляді, зменшуються витрати деяких цінних видів сировини (цукру, жиру). Кількість же препаратів надзвичайно мала (2-5 г на тонну борошна). Протеолітичні ферменти дістали широке використання у м'ясній промисловості, для прискорення дозрівання м'яса. У звичайних умовах це процес досить довгий (при температурі 2-4°С яловичина дозріває 10-14 днів). При обробці м'яса протеолітичними ферментами час дозрівання його скорочується до 1-2 діб. Широко використовується у м'ясній промисловості фермент глюкооксидаза, який окислює глюкозу. Це має велике практичне значення, тому що навіть невелика кількість глюкози у м'ясі прискорює його псування. Одна з найважливіших проблем харчової промисловості — це розвиток комплексної переробки сировини і відходів. Тільки на підприємствах олійної промисловості нагромаджуються сотні тонн соняшникового лушпиння. Ферменти використовуються для гідролізу речовин, що містяться в лушпинні, і завдяки цьому з 1 т лушпиння одержують 170 кг кормових дріжджів. Таке ж використання можуть дістати ферменти і при переробці інших видів насіння та кісточок як відходів консервної промисловості. У харчовій промисловості починають використовуватися іммобілізовані ферменти. Це, так би мовити, нерухомі, закріплені на якомусь носії ферменти. У ролі такого носія можуть використовуватися природні або синтетичні високомолекулярні речовини: білки і полісахариди, синтетичні полімери, кераміка, скло. Прикріплення ферментів відбувається різними способами: шляхом утворення тривких хімічних зв'язків або звичайною сорбцією на поверхні. Іммобілізовані ферменти не розчиняються у воді. Іммобілізація підвищує стійкість ферментів до впливів зовнішнього середовища (нагрівання, рН середовища). Все це полегшує використання таких ферментів, оскільки їх можна відділити від продуктів реакції і використовувати багаторазово. Велике значення мають ферментативні процеси при зберіганні продовольчих товарів. Знаючи спрямованість дії ферментів, товарознавець може регулювати умови зберігання, тим самим уникати процесів, які призводять до псування харчових продуктів. Небілкові азотисті речовини - містяться в харчових продуктах у вигляді різноманітних органічних і неорганічн
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 1678; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.162.87 (0.017 с.) |