
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічний склад м'язової тканиниСодержание книги
Поиск на нашем сайте
М'язова тканина має складний хімічний склад. До неї входить значна кількість лабільних речовин, вміст і властивості яких можуть змінюватися залежно від багатьох чинників як за життя тварини (передзабійний стан), так і відразу після забою. Тому хімічний склад тканин вивчають за певних суворих умов, до яких відноситься швидке виділення тканини після забою тварини, охолодження, швидке подрібнення під час охолодження, оброблення за низьких температур і та ін. Під час дослідження хімічного складу м'язову тканину звільняють за можливістю від інших тканин (сполучної, жирової та ін.) і подрібнюють (гомогенізують). Після цього виділяють і розділяють хімічні компоненти, що входять до складу тканини. Таке розділення найчастіше ґрунтується на вибірковій розчинності окремих хімічних речовин м'язової тканини в різних розчинниках: воді, водно-сольових розчинах за різного значення рН, органічних розчинниках і та ін. Вміст води у м'язах коливається залежно від віку тварини: чим вона молодша, тим більше вологи у м'язах. Вміст води неоднаковий у різних групах м'язів і зменшується в міру збільшення вмісту жиру. Розрізняють 2 форми води — вільну та зв'язану. Зв'язана вода утримується білком досить міцно. Зв'язана вода складає 6-15% від маси тканини. За шаром гідратної води розташовані шари молекул води, які утримуються відносно слабко, і є розчином різних речовин, — це вільна вода. У тканині її міститься від 50 до 70%. Після висушування м'язової тканини сухий залишок становить близько 30%, у тому числі органічні речовини 23-28%; 1-1,5% припадає на частку неорганічних солей. Головним компонентом органічних речовин м'язової тканини є білки. На їх частку припадає близько 80% сухого залишку, або 18-22% маси тканини. З інших постійних органічних компонентів тканини особливе місце займають численні екстрактні речовини, що виконують важливу роль у біохімічних перетвореннях м'язів. До складу сухого залишку входять також жири та інші ліпіди. У м'язовій тканині містяться різні вітаміни, мінеральні речовини, вуглеводи. Таблиця 1.1. Вміст основних груп хімічних речовин у м'язовій тканині
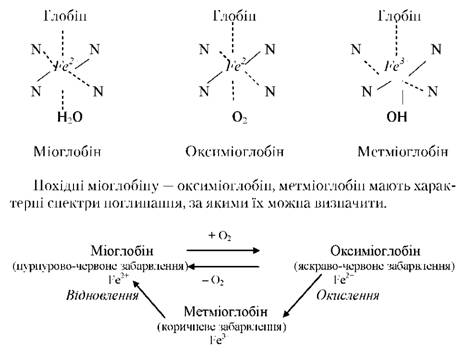
Білки, які входять до м'язової тканини, непрості за складом, різноманітні за будовою, фізико-хімічними властивостями і біологічними функціями. Вони поділяються на три основні групи: саркоплазматичні (35% усіх м'язових білків), міофібрилярні (45% усіх м'язових білків) і білки строми. Нерідко білки м'язової тканини поділяють на розчинні у воді, розчинні в сольових розчинах і нерозчинні у водно-сольових розчинах (білки строми). Розчинність білків залежить від співвідношення в молекулі кількості неполярних гідрофобних і полярних гідрофільних груп, їх взаємного розміщення, а також сили взаємодії між білковими молекулами. Фракція водорозчинних білків характеризується переважно глобулярною будовою молекул. Ці білки входять в основному до складу рідкої частини саркоплазми. Вони відносно легко розчинні у воді, оскільки взаємодія між молекулами білка і розчинника сильніша, ніж взаємодія між сусідніми білковими молекулами. Водорозчинні білки умовно розглядають як білки саркоплазми. Для більшості білків м'язової тканини, нерозчинних у воді, властива фібрилярна будова, їх молекули взаємодіють між собою та молекулами інших білків сильніше, ніж з молекулами розчинника (води). Тому для їх розчинення необхідно створити умови, за яких порушується міжмолекулярна взаємодія білків. Білки, які було виділено сольовими розчинами, в основному формують структуру міофібрил, тобто скорочувального апарату м'язів. Білки, що становлять оболонку клітини, і білки, що міцно утримуються в структурі м'язових клітин і нерозчинні в сольових розчинах, умовно називають білками строми. їх (крім білків сарколеми — колагену, еластину) можна виділити 0,25% розчином NaOH. Особливими властивостями характеризуються білки ядер, які також відносяться до білків строми, оскільки не переходять у витяжку під час водної та водно-сольової екстракції. Деякі білки м'язової тканини (актин, тропоміозин) знаходяться у зв'язаному стані з ліпідами, тому для їх розчинення необхідно зруйнувати цей зв'язок. Під час вивчення білкового складу м'язів основний інтерес являють білки саркоплазми, міофібрили, ядер і сарколеми (мал. 1.1). Білки саркоплазми. До цієї групи належать відносяться міоген, міоглобін, глобулін Х, міоальбумін. Усі вони, за винятком міоглобіну, — це гетерогенні системи, фракції білків, близьких за фізико-хімічними і біологічними властивостями, тому їх позначення, певним чином умовне. Характерною властивістю цих білків є розчинність у розчинах невисокої іонної сили. Міоген — група білкових речовин, що виконує, головним чином, ферментні функції. Фракція міогену становить близько 20% усіх білків м'язової тканини. Міоген легко розчиняється під час екстрагування водою гомогенату м'язової тканини і міститься у відпресованому м'язовому соку. Молекули міогену мають глобулярну форму. Молекулярна маса міогену становить 150 000-81 000, ізоелектрична точка фракції знаходиться в інтервалі рН 6,0-6,6. Температура згортання в розчині55-66°С. У фракції міогену містяться всі життєво необхідні амінокислоти, тобто він є повноцінним білком. За кімнатної температури частина білків фракції міогену, що знаходиться в розчині, згортається, тобто переходить у нерозчинний стан, утворюючи тонкий осад у вигляді плівок (ниток) — міогенфібрин. У складі фракції міогену містяться багато ферментів м'язової тканини, які виконують функції, пов'язані з окислювальним перетворенням вуглеводів та інших сполук. Окремі фракції міогену є комплексом білків, що утримуються міцними зв'язками і не руйнуються за звичайних методів виділення. Шляхом порівняння фізико-хімічних і біологічних властивостей міогенів встановлено, що відповідні їхні функції в різних тварин близькі між собою. Міоглобін (міохром) — розчинний у воді білок, який надає м'язам червоного кольору. Міоглобін є пігментом хромопротеїдом, простетичною групою якого є гем-комплекс порфірину з залізом, і має кислий характер. Глобін, що входить до складу протеїду як білковий компонент, навпаки, має основний характер і за амінокислотним складом є повноцінним білком. Білкова частина глобіну становить 94% загальної маси міоглобіну. Молекулярна маса міоглобіну — 16 800. Ізоелектрична точка лежить при рН 7,0. Міоглобін добре розчиняється у воді. Наявність міоглобіну зумовлює пурпурово-червоне забарвлення м'язової тканини. При цьому атом заліза в гемі двовалентний і зв'язаний шостим координаційним зв'язком з молекулою води. Міоглобін — один з небагатьох білків, у яких встановлено послідовність амінокислот у молекулі та вивчено конформацію. Не дивлячись на невеликий вміст у м'язових клітинах (близько 1% до суми всіх білків тканини), міоглобін відіграє важливу роль у передачі кисню, який доставляється кров'ю, ферментним системам клітин. Виключно важливе значення в механізмі цього процесу має та обставина, що міоглобін має спорідненість до кисню вищу, ніж гемоглобін (білок крові). Так, при парціальному тиску кисню 533 Па міоглобін насичується ним на 60%, а гемоглобін — на 38%. Виконуючи роль передавача кисню, міоглобін здійснює функцію кисневого буфера, або кисневого резерву. Ця властивість білка має надзвичайно важливе значення, особливо коли в процесі м'язового скорочення (в умовах сильного напруження) циркуляція крові тимчасово ускладнена. Міоглобін також виконує роль головного чинника, що полегшує проникнення кисню всередину клітини. Внаслідок цього у м'язах, які інтенсивно працюють (з активно протікаючими аеробними окислювальними процесами) міститься відносно більше міоглобіну, тому вони забарвлені темніше (наприклад, м'язи ніг та шиї у великої рогатої худоби, грудні м'язи птахів, які літають, м'язи коня), ніж м'язи, які не працюють або працюють менш інтенсивно. Міоглобін у м'язовій тканині великої рогатої худоби залежно від віку міститься в такій кількості: телят 0,1-0,3%, дорослих тварин 0,4-1,0%, старих тварин 1,6-2,0%. Кількість міоглобіну у м'ясі свиней становить 0,3-0,7%. Після забою тварини в поверхневому шарі м'яса завтовшки близько 40 мм міоглобін, приєднуючи кисень, переходить у світло-червоний оксиміоглобін. Темніше забарвлення м'яса в шарах, що знаходяться нижче, спричинене наявністю відновленого міоглобіну. При тривалому зберіганні м'яса оксиміоглобін і його поверхня, окислюючись, переходять у метміоглобін, і м'ясо набуває коричневого відтінку. Виключно важливе значення (для надання м'ясопродуктам забарвлення натурального м'яса) має поєднання міоглобіну з окисом азоту в NO-міоглобін (спектр поглинання, близький до спектра поглинання оксиміоглобіну), який зберігає після теплової денатурації червоне забарвлення. Глобулін Х. Білок, на який припадає близько 20% усієї кількості білкових речовин м'язової клітини. Наявність невеликої кількості неорганічних солей (1-1,5%) у м'язовій тканині є достатньою, щоб під час водної екстракції глобулін Х перейшов у розчин. Ізоелектрична точка глобуліну Х знаходиться при рН 5,2. Молекулярна маса становить 160 000. У розчині білок коагулює при 50оС. Міоальбуміну в м'язовій тканині 1-2% від всіх білків. Він розчиняється у воді, не осаджується хлористим натрієм при повному насиченні, але осаджується сірчанокислим амонієм. Ізоелектрична точка міоальбуміну знаходиться при рН 3,3. Температура коагуляції 45-47°С. Нуклеопротеїди. До складу білків саркоплазми нуклеопротеїди входять у невеликій кількості. Зосереджені вони в основному в рибосомах, саркоплазматичному ретикулумі. їх особливістю є наявність у структурі молекули рибози, тобто нуклеїнові кислоти ну- клеопротеїдів саркоплазми є рибонуклеїновими кислотами (РНК). їх загальний вміст у м'язах становить 207-245 мг%. Білки міофібрил. До цієї групи білків належать міозин, актин, актоміозин, тропоміозин та ін. Виділяються вони значно важче, ніж білки саркоплазми, через комплексоутворення між білками, а також між білками та іншими хімічними компонентами міофібрил. Міозин. Найважливіший білок м'язової тканини як за біологічними особливостями, так і за вмістом (близько 40% від суми білків тканини). Молекулярна маса міозину ще остаточно не встановлена через складності будови його молекули та здатності білка до асоціації з іншими білками. Його молекулярна маса знаходиться в межах 500 000, що узгоджується і з теоретичними розрахунками. Він одержаний у кристалічному вигляді. У дистильованій воді кристали міозину набухають, утворюючи прозорий гель — драглеподібну масу. При зниженні концентрації міозину отримується розчин, який має подвійне променезаломлення в потоці, що пояснюється асоціацією частинок міозину. У спокійному стані паличкоподібні частинки білка в розчині міозину агрегують, утворюючи драглеподібну структуру, яку можна легко зруйнувати механічним коливанням. Таке явище руйнування структур називається тиксотропією, що спостерігається навіть у 0,3% розчинах міозину. Міозин зв'язує кальцій (близько 40% кальцію, що знаходиться в м'язовій плазмі), магній і калій. Для міозину характерна взаємодія з аденозинтрифосфорною (АТФ) і аденозиндифосфорною (АДФ) кислотами. Його молекула здатна зв'язувати 3 молекули АДФ або 2 молекули пірофосфату (РР), але це поєднання залежить від концентрації двовалентних іонів. Молекули міозину легко асоціюють один з одним, утворюючи частинки з молекулярною масою приблизно в 8 разів більше за початкову. Крім того, міозин взаємодіє з іншими білками та компонентами клітини, наприклад, міозин утворює міцні комплекси з глікогеном. У молекулі міозину міститься близько 5000 амінокислотних залишків, які належать 20 амінокислотам, у тому числі й незамінним. У клітинах міозин знаходиться в комплексі з ліпідами (у складі цієї фракції знаходиться холестерин). Міозин коагулює при 4550°С. Міозин має ферментативну активність, каталізуючи гідролітичний розпад АТФ на АДФ і фосфорну кислоту: міозин АТФ + H2O ► АДФ + H3PO4 + 8 ккал. Розпад АТФ під впливом міозину супроводжується виділенням з високоенергетичного зв'язку нуклеотиду значної кількості енергії, яка використовується для здійснення акту м'язового скорочення Електронно-мікроскопічні дослідження показали, що молекула міозину має подовжену будову з потовщенням на кінці у вигляді головки (мал. 1.2). Молекула побудована з чотирьох поліпептидних ланцюгів — двох великих і двох малих. Мал. 1.2.Будова молекули міозину: 1 — глобулярна «головка»; 2 — фібрилярний «хвіст» фрагментації молекули цього білка.
Встановлено, що при дії на кристалічний міозин трипсину та хімотрипсину міозин розпадається на два компоненти. Ці компоненти одержали назву мероміозинів: важкий (Н-мероміозин) ВММ з молекулярною масою 340 000 і легкий (L-мероміозин) ЛММ з молекулярною масою 140 000. Актин. Цей білок міцно утримується в структурі м'язового волокна і звичайними прийомами (екстракцією водою або сольовими розчинами) відокремити його не можна, тому іноді актин відносять до білків строми. У 100 г м'язів міститься близько 3 г актину, тобто він становить близько 12-15% загальної кількості білків м'язів. Актин може існувати в 2-х формах, різних за фізико-хімічними властивостями: глобулярній Г-актин (молекули кулясті) і фібрилярній Ф-актин (молекули витягнуті). Молекулярна маса Г-актину 47 000, діаметр 5,5 нм. Завдяки значному вмісту проліну в його молекулі не може утворюватись a -спіраль. У м'язі тварин за життя в спокійному стані актин знаходиться у фібрилярній формі. Можливий перехід фібрилярного актину в глобулярний, і навпаки. Ф-актин з'являється в результаті утворення з двох молекул Г-актину димеру (молекулярна маса близько 94 000) і подальшої полімеризації глобул у ланцюжки (мал. 1.3). Процес полімеризації здійснюється за участю деякої частини сульфгідрильних груп білка і критичної концентрації іонів магнію. Нитка Ф-актину є двоспіральною структурою. Кожна спіраль — це ланцюжок, що складається з 200-300 окремих глобул- «намистинок» (мономери Г-актину); молекулярна маса Ф-актину до 1 500 000. Кожен мономер у двоспіральному ланцюжку фіксований за допомогою двох типів зв'язків з чотирма сусідніми мономерами. Полімерний актин може змінювати свою конформацію під впливом АТФ.
Мал. 1.3. Будова подвійної спіралі: Ф-актина мономерів та Г-актина Розчин Ф-актину характеризується подвійним променезаломленням, значною в'язкістю та тиксотропією. При діалізі та переході його в Г-актин ці властивості зникають. За амінокислотним складом актин відноситься до повноцінних білків. Ізоелектрична точка знаходиться при рН 4,7. Актоміозин. Це складний комплекс, побудований двома білками — актином та міозином. При утворенні актоміозину молекули міозину прикріпляються своїми «головками» до «намистинок» подвійної спіралі актину (одна молекула на дві «намистинки»), а хвостова частина розміщена у вигляді спіралі уздовж осі актоміозину. Якщо розчин міозину з'єднати з розчином Ф-актину, то вийде дуже в'язкий розчин актоміозину, який характеризується подвійним променезаломленням. Актоміозиновий комплекс утворюється через сульфгідрильні групи міозину та оксигрупи актину. Актоміозин не розчиняється у воді. Характерною властивістю актоміозину є його взаємодія з солями і АТФ. Зміни білка, що відбуваються при цьому, складні і залежать від умов досліду. Якщо до розчину актоміозину додати невелику кількість АТФ (на 100 000 г актоміозину одну молекулу АТФ), то різко знижується в'язкість розчину і зникає здатність подвійного променезаломлення, що пов'язано з дисоціацією актоміозину на актин і міозин. Дисоціація актоміозину на початкові компоненти відбувається і при підвищенні концентрації солей. У комплекс з міозином можуть входити обидва різновиди актину, але здатність до скорочування під дією АТФ має тільки гель, до складу якого входить Ф-актин, його активність інша, ніж у вільного міозину. Актоміозиновий комплекс проявляє Mg2+ АТФ-азну активність, безпосередньо пов'язану з механізмом пересування протофібрил. Скорочення актоміозинового гелю, яке супроводжується розпадом АТФ і використанням енергії, яка виділяється, розглядають як своєрідну модель механізму фізіологічного акту м'язового скорочення. Тропоміозин. Структурний білок міофібрил, вперше виділений з поперечносмугастих м'язів. Тропоміозин становить 10-12% білків міофібрил, або 2,5% від суми білків м'язів. Тропоміозин розчиняється у воді, але з м'язової тканини він виділяється лише сольовими розчинами з високою іонною силою, що свідчить про зв'язок його з нерозчинними у воді білками міофібрил. Молекула тропоміозину складається з двох замкнених поліпептидних ланцюгів, тобто це циклопептид. Між ланцюгами один дисульфідний зв'язок. Молекулярна маса білка 53 000, ізоелектрична точка перебуває при рН 5,1. Тропоміозин одержано в кристалічному вигляді; його кристали мають форму великих гексагональних пластин. За амінокислотним складом тропоміозин відрізняється від міозину: у його молекулі немає триптофану, але багато дикарбонових і основних амінокислот. Характерною особливістю білка є стійкість до денатурації. У процесі скорочення м'язів тропоміозин виконує функцію, пов'язану з передачею кальцію. Найбільш значуща роль цього білка в гладких м'язах, де він знаходиться у великих кількостях. Ці м'язи здатні перебувати в стані тривалого тонічного скорочення, пов'язаного з вкрай малою витратою хімічної енергії. Інші білки міофібрил. У міофібрилах виявлено невелику кількість інших білків (водорозчинних) — a - і b -актиніни. їх одержують з м'язового гомогенату після видалення саркоплазматичних білків і актоміозину. Ці білки виконують регуляторну роль. Білок a -актинін бере участь в утворенні поперечних зв'язків між тонкими нитками в диску І. Білки ядер. Ядра м'язових клітин побудовані головним чином з нуклеопротеїдів, що становлять близько 50% сухої речовини. Під час гідролізу нуклеопротеїди розщеплюються на білок і нуклеїнові кислоти. Нуклепротеїди відрізняються один від одного природою білка і нуклеїновими кислотами. У структуру ядерних нуклеопротеїдів входять дезоксирибонуклеїнові кислоти (40-45 мг%). Рибонуклеїнова кислота в основному міститься в саркоплазмі клітини (близько 90%) і в невеликій кількості в ядрі; ДНК — в клітинних ядрах. Молекулярна маса ДНК досягає декількох мільйонів (3-20), діаметр частинок 1,5-2 нм довжиною до 50 нм. Форма молекул досить різноманітна: сферична, еліптична, циліндрична. Форма молекул нативних нуклеїнових кислот зазвичай надто подовжена, що зумовлює структурну в'язкість розчинів протеїду. Білки сарколеми. До цієї групи належать білки, що входять до складу сарколеми та пухкої сполучної тканини, що об'єднують м'язові волокна у м'язові пучки. Кожне м'язове волокно вкрите найтоншою еластичною оболонкою — сарколемою, яка складається з мембран. У складі мембран сарколеми, крім білків, істотними компонентами є фосфоліпіди, що відіграють важливу роль у проникності оболонки. На поверхні сарколеми розташовані сполучні волокна, які складаються з білків сполучної тканини (протеїноїдів): колагену, еластину і ретикуліну. У міжклітинному просторі м'язової тканини трапляються муцини та мукоїди — слизоподібні білки, що виконують захисну функцію і полегшують ковзання м'язових пучків. Ці білки виділяються лужними розчинами. На поверхні сарколеми і у міжм'язових проміжках знаходяться нервові волокна і нервовий апарат клітин, до складу яких входять ліпопротеїди та нейрокератини. Ферменти м'язової тканини. За хімічною природою всі ферменти є білками. Ферменти м'язової тканини, яка характеризується активним обміном речовин, представлені у великій кількості: тільки в саркоплазмі їх налічується понад 50. Нині багато з них вдалося виокремити в хімічно чистій кристалічній формі. Більшість ферментів, що каталізують гідролітичні реакції, належать до простих білків — ні в міозині, ні в міогені не виявлено простатичної групи. Ферменти, що каталізують окислювально-відновні реакції (оксидоредуктаза), переважно належать до складних білків. Як простатичні групи до складу ферментів входять вітаміни та інші органічні сполуки; є також ферменти, які містять іон металу. Найголовнішими характерними властивостями ферментів як біологічних каталізаторів є специфічність, нестійкість до дії підвищеної температури, чутливість до концентрації іонів водню. Той або інший фермент діє тільки на певну речовину (субстрат) або на певний тип хімічного зв'язку в молекулі (наприклад, пепсин — тільки на білок і не розщеплює жири та вуглеводи). На певну специфічність вказує те, що у випадках оптичної ізомерії або стереоізомерії фермент каталізує перетворення лише одного ізомеру. Специфічність дії ферментів залежить від білкової частини, а простатична група не є специфічною і може, з'єднуючися з різними білками, брати участь в утворенні низки ферментів. Експериментально доведено, що специфічність ферментів пов'язана з конформацією білків, які входять до складу ферменту. З підвищенням температури швидкість ферментативних реакцій спочатку збільшується, досягаючи максимуму за певної температури. Оптимальною температурою для більшості ферментів, виділених з тканини теплокровних тварин, є температура тіла (37-40°С). При подальшому підвищенні температури швидкість ферментативних реакцій зменшується і, нарешті, за 80-100°С, а для деяких ферментів і за нижчої температури, реакція припиняється. Активність ферментів різко змінюється під час зміни реакції середовища. Величина рН, за якої активність ферментів найбільша, є оптимальною, і для кожного ферменту існує оптимальне значення рН середовища. М'язова тканина здійснює свої функції завдяки активній участі ферментативних систем, специфічно локалізованих у структурах тканини. Ферментні системи забезпечують отримання великої кількості енергії, необхідної для здійснення м'язової діяльності. М'язові клітини характеризуються великою концентрацією ферментів гліколізу, а також ферментів циклу трикарбонових кислот і дихального ланцюга. Деякі ферменти є одночасно і структурними елементами м'язового волокна. До них слід віднести АТФ-азу (міозин), що міститься в міофібрилах. Здійснення процесу гліколізу і пов'язане з ним виділення енергії протікає у структурі саркоплазми. Разом з тим різні дії на м'язову тканину підвищують інтенсивність гліколітичних процесів, що може свідчити про вихід ферментів зі структур, які їх обмежують, і їх активації. У структурі саркоплазми міститься багато ферментів синтезу білків, ліпідів і полісахаридів. Аеробне окислення продуктів обміну відбувається в мітохондріях (саркосомах). Різні м'язи залежно від функціональних особливостей характеризуються неоднаковим співвідношенням концентрації ферментних систем, що каталізують анаеробні та аеробні перетворення. Так, у червоних м'язових волокнах міститься більше мітохондрій, ніж у білих. У білих м'язах інтенсивність анаеробного глікогенолізу приблизно в 2 рази вища, ніж у червоних. Саркоплазматичний ретикулум містить, окрім АТФ-ази, що активується іонами магнію, АМФ-аміногідролазу, яка також має дуже високу активність. У ядрах містяться гліколітичні, окислювальні, гідролітичні ферменти, ферменти білкового синтезу. Крім того, в ядрах є ферменти синтезу нуклеїнових кислот (ДНК-полімераза і РНК-полімераза). У сарколемній мембрані виявлено наявність АМФ-аміногідро- лази та активної ацетилхолінестерази. До рибосомних відносять ферменти, що беруть участь на тих стадіях синтезу білка, які відбуваються в рибосомах. Лізосоми містять клітинні гідролази: кислу рибонуклеазу, дизоксирибонуклеазу, кислу фосфатазу, катепсини (протеїнази), естерази, глікозидази. У живій клітині ці ферменти можуть діяти в основному на фагоцитований матеріал, що потрапив усередину лізосоми. М'язовій клітині це необхідно для поновлення її найважливіших структур і компонентів. Якщо цілісність лізосоми порушено, то гідролази вивільнюються і перетравлюють компоненти клітини. Наявність у лізосомах ліпопротеїдної мембрани надійно утримує гідролітичні ферменти і запобігає перетравленню субстратів м'язового волокна після забою тварини. Проте згодом під впливом різних чинників відбувається вивільнення гідролаз.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.67.189 (0.011 с.) |


 Важливе значення для поняття будови і властивостей міозину мають результати використання методів.
Важливе значення для поняття будови і властивостей міозину мають результати використання методів.



