Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Небілкові речовини м'язової тканиниСодержание книги
Поиск на нашем сайте
Ліпіди, що входять до складу м'язових волокон, виконують функції подвійного значення. Частина їх, головним чином фосфоліпіди, є пластичним матеріалом і входить до структурних елементів м'язового волокна — міофібрилів, клітинних мембран, прошарків гранул. До складу міофібрил входять різні гліцерофосфоліпіди, багато з яких сприяють активності низки ферментів. Особливо великим вмістом фосфоліпідів відзначається саркоплазматичний ретикулум. Гліцерофосфоліпіди містять і сарколемні мембрани. Проте загальний вміст фосфоліпідів у сарколемній мембрані значно нижчим, ніж у мітохондріях, причому якісний склад їх не відрізняється від складу субклітинних структур. Інша частина ліпідів виконує роль резервного енергетичного матеріалу. Такі ліпіди містяться в саркоплазмі у вигляді дрібних крапельок на полюсах мітохондрій. У великій кількості ліпіди містяться в міжклітинному просторі, між пучками м'язів у сполучних прошарках. Сумарний вміст тригліцеридів у м'язах різних тварин різко варіює. При напруженій роботі їх вміст у міжклітинному просторі зменшується до мінімуму. З глицерофосфатидів м'язової тканини виділені холингліцерофосфоліпіди, етанолгліцерофосфоліпіди, плазмогени, сфінгомієлін та ін. Вони містять більше ненасичених жирних кислот (65-75%), ніж гліцерофосфатиди інших тканин. Усього гліцерофосфатидів у м'язах 0,2-1%, на частку зв'язаних білками припадає 20-27%. Звичайно під час роботи м'язів розпадається невелика кількість гліцерофосфатидів; помітний їхній розпад під час виснажливої роботи м'язів. Із стероїдів у м'язовій тканині міститься вільний і зв'язаний холестерин: у гладких м'язах 0,8% до сухої речовини, в серцевих — 0,5%, у скелетних — 0,3%. Характерною особливістю холестеринбілкових комплексів, виділених із м'язів ссавців, є міцний зв'язок холестерину з білком. Загальний вміст ліпідів у м'язовій тканині, а також їх компонентів схильний до значних коливань і залежить від стану тварини, її виду, віку, статі, умов утримування та годівлі. Вуглеводи. В організмі тварин вуглеводи містяться у відносно невеликій кількості. У м'ясі вони зустрічаються у вільному стані, в комплексі з білками та ліпідами і як структурні елементи низки сполук. Вуглеводи м'яса представлені моносахаридами та полісахаридами. У структурі молекули глікогену залишки глюкози поєднані a -1,4-глікозидними зв'язками, в місцях розгалуження — a -1,6- зв'язками. Його молекулярна маса 1-106. Великий ступінь розгалуженості м'язового глікогену необхідний, оскільки дії ферментів піддаються кінці молекули: чим більше вільних кінців, тим швидше може бути використана молекула глікогену або швидше синтезована під час таких періодів клітинного метаболізму, коли відбувається його регенерація. Глікоген витрачається при м'язовій роботі та накопичується під час відпочинку. Вміст його залежить від тренованості та вгодованості тварини, а також фізіологічного стану: у м'язах стомленої та голодної тварини міститься мало глікогену. Глікоген легко розчиняється в гарячій воді з утворенням колоїдного опалесціюючого розчину. З водним розчином йоду глікоген дає червоно-буре забарвлення. При кислотному гідролізі він розпадається до глюкози. У свіжих м'язах забійних тварин міститься 0,3-0,9% (іноді до 2%) глікогену та 0,05% глюкози. У м'язових волокнах виявлено певний зв'язок глікогену з міофібрилами. Спостерігається локалізація глікогену в анізотропних дисках і не виявлено в ізотропних. Крім того, глікоген рівномірно розподілений в саркоплазмі (з переважанням в навколоядерній). Можливо, що зв'язок глікогену з міозином анізотропних дисків міофібрил і міогеном саркоплазми забезпечує необхідний темп розщеплення полісахариду при його гліколітичному розпаді. У процесі інтенсивної м'язової роботи глікоген піддається анаеробному гліколітичному розпаду з утворенням молочної кислоти. Відразу після припинення життя тварини глікоген починає розпадатися, утворюючи проміжні продукти і кінцевий продукт — молочну кислоту. У післязабійний період перетворення глікогену м'язової тканини є першопричиною багатьох подальших біохімічних процесів. До складу міжклітинної основної речовини сполучної тканини входять як характерна складова частина високомолекулярні вуглеводи — мукополісахариди. Ці сполуки утворюють стінки клітин, з'єднують клітини одна з одною, утворюючи біологічно активні комплекси поверхні клітин, і є тією рідкою фазою, в якій відбувається рух клітин і якою змащуються частини, що труться. Екстрактні речовини м'язової тканини беруть участь у процесі утворення специфічного м'ясного смаку та аромату. Під час варіння м'яса у воді ці сполуки переходять у бульйон і, видозмінюючись, надають йому властиві смак і аромат. Специфічні азотисті екстрактні речовини м'язової тканини — карнозин, карнитин, ансерин і креатин — стимулюють діяльність травних залоз. Розрізняють азотисті та безазотисті екстрактні речовини. До безазотистих відносяться вуглеводи і всі сполуки, що виникають з них у процесі метаболізму м'язової тканини. Загальний вміст їх становить 0,9-1,0% З азотистих небілкових речовин м'язової тканини в екстракт легко переходять карнозин, ансерин, карнитин, креатин, креатинфосфат (КРФ), АТФ, які за життя тварини виконують специфічні функції в процесі обміну речовин і енергії. Інша частина азотистих екстрактних речовин — пуринові основи, вільні амінокислоти та ін. — є проміжні продукти обміну білків. Частина азотистих екстрактних речовин, наприклад сечовина, сечова кислота і амонійні солі, є кінцевими продуктами обміну білків. Загалом у свіжих м'язах міститься 0,3% небілкового азоту (1,2% з розрахунку на сухий залишок). Після забою тварин азотисті екстрактні речовини і продукти їх перетворення беруть участь у створенні специфічного смаку та аромату м'яса. Ансерин (метилкарнозин) — аналог карнозину. Ансерин вперше виділений з м'язової тканини гусака, у зв'язку, з чим і одержав свою назву (лат. anser — гусак), проте він часто трапляється і у м'язах тварин. Ансерин має ті самі функції, що й карнозин. У м'язах забійних тварин його вміст становить 90-200 мг%. Карнитин (похідна g -аміно- b -оксимасляної кислоти). Вважають, що він є одним із джерел метильних груп. У м'язах його міститься 20-50 мг%. Холін (аміноетиловий спирт з трьома метильними групами в атомі азоту) необхідний для утворення фосфоліпідів і ацетилхоліну — сполука, що відіграє важливу роль у процесі передачі нервового збудження або скорочення м'язів. Вільний холін викликає перистальтику кишок. Як речовині, що надходить з продуктами харчування, йому надають значення вітаміну. Глютатіон (глютамінілцистеїлгліцин) — специфічний трипептид — сильний відновник і, як цистеїн, легко піддається окисленню. У живих тканинах глютатіон в основному знаходиться у відновленій формі і в міру необхідності переходить в окислену. Глютатіону, очевидно, належить особлива роль у підтриманні окислювально-відновного потенціалу м'язової клітини та активації ферментів, що містять в активних центрах SH-групи. Так, у м'язах тварин за життя міститься загального глютатіону 25,8-41,5, окисленого — 0,3-5,7, відновленого — 20,1-41,25 мг%. Креатин — за будовою є метилгуанідиноцтовою кислотою. Синтез креатину пов'язаний з перетвореннями аргініну, метіоніну та ін. Вміст креатину у м'язах різних тварин неоднаковий: у коня його міститься 0,058%, барана — 0,153, свині — 0,239, бика — 0,41%. За життя тварин вільного креатину в м'язах міститься порівняно мало, 70-80% його зв'язано з фосфорною кислотою і креатинфосфатом. Креатинфосфат (КрФ) — багата на енергію сполука, що виконує роль резерву енергії, яка легко мобілізується. Багато креатинфосфату міститься в інтенсивно працюючих м'язах. Органічні фосфати. Органічним (небілковим і неліпідним) фосфатам належить особлива роль в обміні енергії. Найважливіші з них є такі нуклеотиди, як АТФ (та інші моно-, ди- та три фосфати). Між різними нуклеотидами і АТФ є постійний обмін лабільними фосфатними групами.
Самостійна робота №2. Автолітичні перетворення компонентів м’язової тканини. Теоретичні відомості Автолітичними називаються процеси розпаду компонентів тканин під впливом ферментів, що знаходяться в них. Автоліз (грец. autos — сам і lysis — розчинення) починається в тканинах тварини відразу ж після забою. Після припинення життя тварини склад і властивості тканин, насамперед м'язової, істотно змінюються. Внаслідок припинення надходження кисню і призупинення процесів синтезу дезорганізується обмін речовин і енергії в тканинах. Як результат цього, зворотні прижиттєві процеси стають незворотними і протікають в одному напрямку — розпаду. Посмертні зміни м'язової тканини пов'язані з діяльністю ферментів, оскільки з припиненням життя тварини ферменти не інактивуються. Специфічні автолітичні перетворення в м'язовій тканині протікають відповідно до особливостей метаболізму, концентрації та локалізації ферментів. У початковий період відбуваються, в основному, автолітичні перетворення, пов'язані з тими системами, які відносяться до функцій руху (скорочення-розслаблення м'язових волокон): інтенсивний розпад вуглеводів (забезпечують синтез АТФ), АТФ (постачальник енергії міофібрилам), різкі зміни скоротливого апарату. У цей же період автолізу для білків характерні конформаційні зміни, які стимулюють агрегаційні взаємодії. Надалі переважаючими стають зміни, пов'язані з гідролітичним розпадом. Залежно від складу тканини та концентрації гідролаз, ступінь деструктивних перетворень компонентів для різних видів м'язової тканини неоднаковий. В основі автолітичних перетворень м'яса лежать зміни вуглеводної системи, системи ресинтезу АТФ і стану міофібрилярних білків, що входять до системи скорочення. Зміни м'яса, зумовлені автолітичними процесами, трапляються в технології м'яса за найрізноманітніших способів його оброблення, наприклад, під час охолодження та зберігання охолодженого м'яса, заморожування і холодильного зберігання, розморожування, засолювання, подрібнення і т. ін. Характер і глибина автолітичних змін м'яса впливають на його якість і харчову цінність.
Запитання для самоконтролю 1. Дайте характеристику хімічному складу м'язової тканини. 2. Які властивості мають білкові речовини м'язової тканини? 3. Який розподіл білків у структурних елементах м'язової тканини? 4. Дайте характеристику властивостей білків саркоплазми. 5. Яка роль міоглобіну в утворенні забарвлення м'ясопродуктів? Опишіть будову міоглобіну, його форми. 6. Дайте характеристику властивостям білків міофібрил. 7. Опишіть будову міозину, актину та їх комплексу. 8. З яких білків побудовані ядра і саркоплазма? 9. Дайте характеристику ферментам м'язової тканини. 10. Наведіть характеристику, основні функції ліпідів м'язової тканини. 11. Наведіть характеристику, основні функції вуглеводів м'язової тканини. 12. Наведіть характеристику, основні функції екстрактних речовин м'язової тканини. 13. Наведіть характеристику, основні функції мінеральних речовин і вітамінів м'язової тканини. 14. У чому полягає механізм процесу скорочення і розслаблення м'язів?
Тема №2.Біохімія крові Самостійна робота №3. План 1. Склад і фізико-хімічні властивості крові. 2. Біохімічні перетворення крові. Теоретичні відомості 1.Хімічний склад крові тварин одного виду постійний, а у тварин різних видів є деякі коливання щодо вмісту основних компонентів Таблиця 3.1. Хімічний склад цільної крові забійних тварин (середні дані)
Не дивлячись на транспортну функцію, кров великого кола кровообігу має досить постійний склад. Для характеристики крові існують певні показники: осмотичний тиск, реакція середовища, щільність і в'язкість. Для крові тварин характерна відносна постійність концентрацій іонів водню (рН). Реакція крові забійних тварин слаболужна і коливається в межах від 7,2 до 7,95. Постійність активної реакції середовища зумовлена наявністю в крові буферних систем, які відзначаються високою кислотною ємністю. Головними буферними системами крові є білкова (плазми), бікарбонатна, фосфатна і гемоглобінова. Найбільша буферна ємність у білків (85-90%). Щільність крові становить 1,055 г/см3, плазми — 1,03 г/см3, еритроцитів — 1,09 г/см3. В'язкість крові за температури 38°С у 5 разів більша в'язкості води і залежить від наявності в ній еритроцитів. Плазма крові. У ній міститься 90-91% води. Велику частину сухого залишку (9-10%) становлять білки, а решту — азотисті та безазотисті речовини, ліпіди, вуглеводи, вітаміни, мінеральні речовини і ферменти. Білки. Основними фракціями білків плазми крові є сироваткові альбуміни (3,6-4,4%), сироваткові глобуліни (2,5-3%) і фібриноген (0,45-0,65%). Фібриноген — білок з молекулярною масою 330 000, молекули якого складаються з трьох глобулярних структур діаметром близько 6 х 10-9 м, сполучених між собою тоншими бічними тяжами. Фібриноген нерозчинний у воді, але добре розчиняється в розведених розчинах нейтральних солей і лугах. Ізоелектрична точка фібриногену — за рН 5,5. Фібриноген є головним компонентом системи згортання крові. Плазма без фібриногену називається сироваткою. Сироваткові альбуміни — типові альбуміни — розчиняються у воді та сольових розчинах середньої концентрації. їх ізоелектрична точка — за рН 4,6. Ферменти плазми виконують регуляторні функції в процесах ліпідного та білкового обміну, окислення, згортання крові. У плазмі виявлено гідролази (амілазу, фосфотазу, ліпазу, протеазу), оксидоредуктазу (каталази, пероксидази). До протеїназу плазми входять ферменти тромбін (бере участь у згортанні) і плазмін (запобігає згортанню). Вуглеводи плазми представлені моносахаридами (глюкозою, фруктозою), вміст яких коливається в межах 20-250 мг% і залежить від виду тварин. Азотисті та безазотисті низькомолекулярні речовини плазми є проміжними (пуринові основи, амінокислоти, поліпептиди) або кінцевими продуктами обміну (сечовина, сечова кислота, амонійні солі, креатинін, молочна кислота та ін.). Ліпіди плазми представлені жирами, продуктами їхнього розпаду (гліцерин і жирні кислоти), лецитином, холестерином. Загальний вміст ліпідів у плазмі залежить від годівлі і в середньому становить у тварини 0,09-0,19%. Мінеральні речовини містяться в плазмі або в зв'язаному чи в іонізованому стані з білками. У тварин різних видів загальна кількість мінеральних речовин в крові складає приблизно 0,9% і представлена солями (натрію, калію, кальцію) і мікроелементами (залізо, йод, мідь, цинк, кобальт). Кров транспортує до тканин вітаміни, що поступають з їжею (групи В, А, D, E, K, C та ін.) Формені елементи. Розміри та кількість формених елементів крові різних видів тварин неоднакові. Основну масу формених елементів крові становлять еритроцити. їх кількість в 1 мм3 становить 6-18 млн, діаметр 4-6,2 мкм. Кількість лейкоцитів в 1 мм3 — 5-16 тис. (діаметр 4-20 мкм), тромбоцитів — 200-600 тис. (діаметр 2-3 мкм). Еритроцити безпосередньо беруть участь у транспортуванні поживних речовин та газів, адсорбуючи їх на своїй поверхні. При посиленому кровообігу ця функція набагато збільшується. Оболонка еритроцитів, утворена ущільненою стромою, проникна для води, глюкози, сечовини, аніонів і сприяє підтримці певного градієнта концентрацій різних катіонів між плазмою і еритроцитами. До складу еритроцитів входить вода (близько 60%); у сухому залишку 90% становить білок гемоглобін, кількість якого коливається від 30 до 41%. У одному еритроциті може міститися близько 280 млн молекул гемоглобіну. Гемоглобін в еритроцитах знаходиться в трьох станах: гемоглобін, зв'язаний з білками строми в достатньо міцний комплекс; гемоглобін, неміцно зв'язаний з фосфатидами строми; невелика частина вільного гемоглобіну. Гемоглобін є складним білком, що складається з білкової частини глобіну і простетичної — гему. Молекулярна маса гемоглобіну 68 000, ізоелектрична точка — за рН 5,5. Молекула гемоглобіну складається з чотирьох субодиниць, взаємне щільне угруповання яких у просторі утворює четвертинну структуру молекули. Кожній субодиниці гемоглобіну відповідає індивідуальний поліпептидний ланцюг, сполучений з гемом. На чотири субодиниці молекули гемоглобіну припадає два a -, два b -ланцюжки і чотири геми. Спіральні відрізки ланцюгів у гемоглобіні становлять близько 75% усієї білкової молекули, які сполучені неспіральними ділянками різної довжини. Окремі субодиниці гемоглобіну утримуються разом внаслідок електростатичної взаємодії та утворення деякого числа водневих зв'язків. Специфічні властивості гемоглобіну визначаються його четвертинною структурою. Гем є комплексною сполукою протопорфірину і заліза. Залізо в гемі знаходиться в центральному ядрі і пов'язане з азотом піролових кілець двома головними і двома додатковими валентностями. Біосинтез гема здійснюється за рахунок ацетату і гліцину. Чотири атоми азоту піролових кілець походять з аміногруп гліцину. Гем є нестійкою сполукою. Відщеплюючись від глобіну, він легко окислюється з утворенням геміну — комплексу порфірину з тривалентним залізом (ферипротопорфірин). Під час оброблення розчинів гемоглобіну розведеними кислотами або лугами виділяється окислена форма гему — гематин (гідроокис ферипротопорфірину). Під час денатурації глобіну, навіть часткової, збільшується чутливість гему до окислення. Гемоглобін виконує роль дихального білка — переносника кисню. Від легенів до тканин кисень переноситься в основному у формі оксигемоглобіну і лише 0,5% його розчинено в плазмі. Киснева ємність крові тварин залежить від вмісту в ній еритроцитів і гемоглобіну. Гемоглобін здатний легко сполучатися не тільки з киснем, а й з іншими газами, не змінюючи при цьому валентності заліза. Оксигемоглобін (HbO2) утворюється в результаті приєднання кисню до гемоглобіну. При цьому змінюються не тільки властивості простетичної групи, а й фізичні та хімічні властивості глобіну. Утворення оксигемоглобіну називається оксигенацією. Кожен з чотирьох атомів заліза в молекулі гемоглобіну здатний з'єднуватися з однією молекулою (тобто двома атомами) кисню, проте залізо при цьому не окислюється. Реакція ця зворотна: кисень поглинається, коли він знаходиться в надлишку (наприклад, в легенях) і звільняється там, де його менше (в тканинах). Карбоксигемоглобін (НЬСО) — міцніша (приблизно в 200 разів) сполука, ніж оксигемоглобін. Гемоглобін має велику спорідненість до СО. Якщо в повітрі знаходиться 1% СО, то 95% гемоглобіну переходить в карбоксигемоглобін. Окис вуглецю легко витісняє з оксигемоглобіну кисень, тому під час вдихання СО велика частина гемоглобіну крові переходить в НЬСО, внаслідок чого порушується процес перенесення кисню від легенів до тканин. Метгемоглобін (НЬОН) утворюється при дії окислювачів на гемоглобін. До його складу входить тривалентне залізо. Метгемоглобін може утворитися в організмі тварин під час тривалого вдихання оксидів азоту, пари нітробензолу, аніліну та інших окислювачів. Він не здатний з'єднуватися з киснем, тому під час утворення метгемоглобіну порушується нормальне живлення тканин. В організмі тварин метгемоглобін поволі відновлюється до гемоглобіну; аскорбінова кислота прискорює цей процес. Забарвлення гемоглобіну і його похідних різне: гемоглобін червоного кольору, оксигемоглобін — яскраво-червоного, метгемоглобін — темно-червоного, а карбоксигемоглобін — рожевого. Кожна з цих сполук характеризується властивою йому абсорбцією (поглинанням) світла. За спектрометричними даними, гемоглобін різних тварин не відрізняється. Якщо й існує дуже незначна різниця в розташуванні смуг поглинання, то вона виразно не уловлюється. Спектрометричний аналіз гемоглобіну і його похідних має важливе практичне значення, оскільки дає змогу швидко встановлювати перетворення гемпротеїну. У лейкоцитах містяться білки (параглобуліни, нуклеопротеїди, цитоглобін та ін.), значна кількість протеолітичних і ліполітичних ферментів, вуглеводи (глікоген і деяка кількість цукру). Тромбоцити є значно лабільними утвореннями, які під час вилучення крові швидко руйнуються. Руйнування тромбоцитів є початковим моментом згортання крові, оскільки вони містять агенти, які беруть участь у цьому процесі.
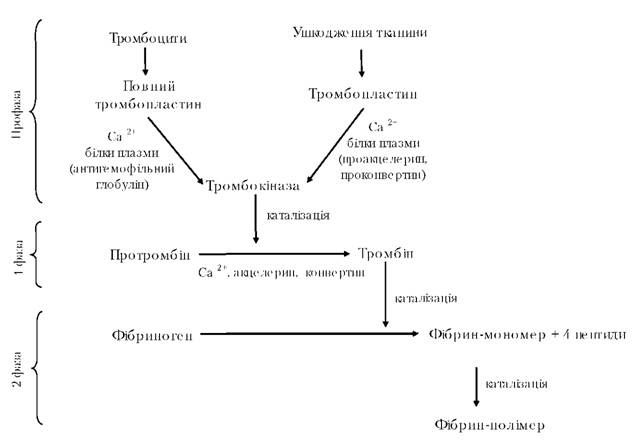
2.Біохімічні перетворення вилученої крові Згортання. Після вилучення з кровоносних судин кров через декілька хвилин згортається, утворюючи згусток. Згортання крові пов'язане з перетворенням розчинного білка плазми фібриногену в нерозчинний — фібрин. Згусток складається із сітки ниток фібрину, заповненої форменими елементами і сироваткою. Утворення специфічного фібринового згустку властиве тільки нативному фібриногену. Денатурація позбавляє фібриноген цієї здатності. За життя тварини у великому колі кровообігу кров не згортається завдяки наявності в ній фізіологічних антикоагулянтів. Швидкість згортання крові різних тварин неоднакова: кров великої рогатої худоби згортається через 6,5-10 хв, свиней — через 3,5-5, овець — через 4-8, коней — через 11,5-15, свійської птиці — менше ніж 1 хв. Утворення фібринової основи згустку — завершальний етап згортання крові, якому передує низка перетворень, пов'язаних із взаємодією багатьох компонентів крові ферментативної та неферментативної природи. Усі речовини, що беруть участь у процесі згортання крові, крім кальцію, є білками. Процес згортання крові складається з профази — утворення повного тромбопластину (тромбокінази) і двох основних фаз — утворення тромбіну з протромбіну і перетворення фібриногену на фібрин (схема 3.1). Тромбопластин — це лабільний, дуже складний ліпопротеїдний комплекс, що складається з білка, рибонуклеїнової кислоти і ацетальфосфатидів. Тромбопластин легко розщеплюється, втрачаючи активність під час видалення фосфатиду. Тканинний тромбопластин вивільняється при ушкодженні тканин за участю іонів кальцію і білків плазми — проакцелерину і проконвертину, що синтезується в печінці. Для швидкого утворення з неактивного тромбопластину тромбоцитів активної тромбокінази (або повного тромбопластину) необхідні іони кальцію, антигемофільний глобулін і різні білкові речовини, що містяться в плазмі крові. Антигемофільний глобулін у процесі згортання крові майже повністю використовується і тому в сироватці не виявляється; дуже лабільний, його можна одержати зі стабілізованої плазми. Тромбокіназа, що утворилася за участю тромбопластину з ушкодженої тканини або з тромбоцитів, каталізує реакцію розщеплювання протромбіну (глюкопротеїд, глобулін плазми, що синтезується в печінці за участю вітаміну К) на декілька фрагментів, один з яких є тромбіном. Для цієї реакції необхідні іони кальцію, білки акцелерин і конвертин.
Схема 3.1. Процес згортання крові У циркулюючій крові здорових тварин тромбіну не виявлено, він з'являється під час згортання крові. Температурний оптимум дії тромбіну 35-40°С. Зі зниженням температури активність його зменшується, а за 0°С зовсім не виявляється, хоча фермент не руйнується. Акцелерин утворюється зі свого попередника проакцелерину, що активується тромбіном; він прискорює утворення активного тромбіну з протромбіну. Конвертин утворюється під час взаємодії свого попередника проконвертину з тромбопластином за участю іонів кальцію. Стабілізація вилученої крові. Щоб запобігти або уповільнити згортання крові, її стабілізують. Для цього виключають або порушують активацію одного з компонентів системи згортання крові. Роль інгібіторів виконують речовини різної хімічної природи — стабілізатори, або антикоагулянти. Стабілізувати кров необхідно в момент її вилучення, щоб вона не встигла згорнутися. При цьому в складі крові залишається повноцінний білок фібриноген. Фізіологічні антикоагулянти. Основними фізіологічними антикоагулянтами, що запобігають прижиттєвому згортанню крові, є гепарин, антитромбін, антитромбопластин та ін. Ці природні антикоагулянти уповільнюють також згортання вилученої крові. Гепарин різко знижує активність тромбіну, утворюючи з ним неактивний оборотний комплекс, і гальмує активацію протромбіну, з'єднуючися з тромбопластином у неактивний комплекс. За хімічною природою гепарин є мукополісахаридом, до складу якого входять глюкозамін, глюкуронова кислота й ефірнозв'язана сірчана кислота. Порівняно багато гепарину в печінці, легенях, м'язах. Препарати гепарину широко використовуються як природний стабілізатор крові під час її переливання. Крім того, препарати гепарину є лікувальним засобом, що прискорює процес фібринолізу. Антитромбін — речовина білкової природи, яка інактивує тромбін. Антитромбінова дія плазми і сироватки крові пов'язана з альбуміновою фракцією. Антитромбінова активність плазми зберігається без змін за температури 4°С протягом двох тижнів. Нефізіологічні стабілізатори. Під час промислового перероблення крові стабілізаторами слугують оксалати (щавлевокислий калій), цитрати (лимоннокислий натрій), одно- і двозаміщені фосфати, пірофосфати, сульфати та інші стабілізатори, дія яких зводиться до поєднання іонів кальцію (утворення нерозчинних кальцієвих солей) і тим самим до виключення їх із системи згортання крові. Якщо кров використовують з харчовою метою, то стабілізатором виступає хлористий натрій, який пригнічує тромбін і гальмує перетворення мономерів фібрину в полімери фібрину. Проте його стабілізуючий ефект для крові різних тварин неоднаковий. Так, кров великої рогатої худоби в разі додавання хлористого натрію не згортається протягом 24 год, а кров свиней коагулює через 10 годин. Дефібринування. У деяких випадках під час промислового використання кров тварин дефібринують — відокремлюють фібрин. Під час дефібринування вилученої крові шляхом збивання фібрин виділяється у вигляді ниток, які потім видаляють. За іншим способом дефібринування зібрану кров обробляють у спеціальних апаратах — дефібринаторах, щоб зруйнувати згустки. При цьому фібринові нитки розриваються, а кров, що знаходиться в згустку вивільняється. Під час сепарації стабілізованої цільної крові одержують плазму і формені елементи, а під час сепарації дефібринованої крові — сироватку і формені елементи. Гемоліз. У процесі зберігання і перероблення крові за певних умов гемоглобін може переходити з еритроцитів у плазму і, розчиняючись у ній, зафарбовувати її в інтенсивний червоний колір. Таке явище називається гемолізом. В одних випадках гемолізу треба запобігти (виготовлення світлого альбуміну), в інших, навпаки, викликати (отримання стійкого забарвлення ковбас). Автолітичні перетворення. Вилучена кров тварин схильна до різних змін. Під час зберігання крові значна частина змін спричинюється ферментами (автолітичні зміни), в деяких пов'язана з природною нестійкістю компонентів крові. Якщо кров зберігати за низької плюсової температури, то ці перетворення можна звести до мінімуму. За температури 0°С у разі тривалого зберігання осідає значна кількість фібриногену і нерозчинного глобуліну, тому найсприятливішою для зберігання крові є температура трохи вища за 0°С. Під час зберігання в еритроцитах крові відбуваються гліколітичні перетворення, що призводять до накопичення молочної кислоти. Крім того, в результаті розпаду органічних фосфорних сполук у плазмі збільшується вміст неорганічних фосфатів. Результатом цих перетворень є зниження рН крові до 6,8-7,0. Зниження кислотності приводить до активації протеїназ лізосом лейкоцитів і виходу їх з обмежуючих структур. Активуються і протеїнази еритроцитів. Важливими автолітичними змінами є і фібринолітичні перетворення внаслідок активації плазміну. Під час зберігання крові помітно змінюються ліпопротеїди плазми. Зберігання сироватки за температури 4°С протягом трьох діб в умовах, близьких до стерильних, викликає порушення стійкості зв'язку між ліпідом і білком, внаслідок чого зростає швидкість екстрагування ліпідів ефіром. Разом з цим відбувається окислення ліпідів, а потім — ефірів ненасичених жирних кислот, які входять до складу незв'язаних ліпідів і ліпопротеїдів. Біохімічні перетворення під впливом мікробів. Вилучена кров є добрим поживним середовищем для мікрофлори і швидко піддається мікробному псуванню. Перетворення під дією ферментів мікробів, випереджаючи ав- толітичні процеси, зводяться переважно до гнильного розкладання білків крові, при цьому виділяються речовини, які мають неприємний запах: скатол, індол, фенол, меркаптани та інші речовини. У результаті накопичення продуктів розпаду часто відбувається гемоліз. Гемоглобін, що звільняється, окислюється і переходить у метгемоглобін та інші похідні. Внаслідок дії бактерій на продукти розпаду білків, які містять сірку, утворюється сірководень. За наявності сірководню і кисню гемоглобін і оксигемоглобін перетворюються на зелені пігменти — сульфгемоглобін, холеглобін та ін. Пігменти, що утворилися, надають крові, яка зіпсувалася, чорного відтінку. Технологічне перероблення. У результаті технологічного перероблення компоненти крові зазнають перетворень. Найбільші зміни пов'язані з перетвореннями білків. Важливим є характер їх денатурації. Різні фракції білків неоднаково стійкі до дії підвищеної температури. Так, розчини фібриногену і глобулінів у 10% хлористому натрії згортаються відповідно за температури 52-55 і 75°С; розчин альбуміну в 5% хлористому натрії згортається при 75°С, а в чистій воді — при 50° С. Швидкість денатурації білків різко збільшується під час зрушення реакції в кислий бік. Висушувати кров необхідно так, щоб білки якомога менше піддавалися тепловій денатурації та не втрачали своєї здатності розчинятися. З цією метою використовують розпилювальні сушарки, оскільки внаслідок надзвичайно малої величини частинок теплова дія на рідку фазу в зоні розпилювання короткочасна. Запитання для самоконтролю 1. Дайте характеристику біохімічним функціям крові. 2. Наведіть особливості будови і складу крові. 3. У чому полягають особливості хімічного складу і фізико-хімічних властивостей крові забійних тварин? 4. Охарактеризуйте основні фракції білків плазми крові. Які небілкові компоненти плазми крові ви знаєте? 5. Який склад і функції формених елементів крові? 6. Дайте характеристику гемоглобіну. Які основні функції він виконує? 7. У чому полягає суть процесу згортання крові? 8. Які речовини беруть участь у процесі згортання крові? 9. У чому полягає суть процесу стабілізації крові? 10. Який механізм дії стабілізаторів крові і яка їх природа? У чому полягає процес дефібринування крові? 11. Дайте характеристику явищу гемолізу. 12. Які автолітичні перетворення відбуваються у вилученій крові? 13. Які біохімічні процеси відбуваються в крові під дією мікробів?
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.012 с.) |