
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема №3.Біохімія сполучної тканиниСодержание книги
Поиск на нашем сайте Самостійна робота №4. План 1. Хімічний склад сполучної тканини. Зміни колагену при тепловій обробці Теоретичні відомості 1. Води в сполучній тканині міститься значно менше, ніж у м'язовій. До складу сухого залишку входять органічні речовини, особливо білки, вміст яких варіює, деяка кількість вуглеводів, ліпідів, екстрактних і мінеральних речовин. Проте в кількісному співвідношенні вміст цих речовин в окремих видах сполучної тканини різний. У кістковій тканині особливо багато мінеральних речовин, у хрящовій — мукополісахаридів, у щільній сполучній тканині (наприклад, сухожиллях) — колагену тощо. Білкові речовини, їхня характеристика і властивості. Найбільш характерними компонентами сполучної тканини є специфічні білкові речовини, головним чином, структурні білки — склеропротеїни: колаген, еластин, ретикулін, які створюють міцні та еластичні волокнисті структури. Особливістю білків цієї групи є подовжена форма молекули, зумовлена паралельно розташованими поліпептидними ланцюгами. У складі елементарних волокон склеропротеїнів є мукополісахариди. До складу основної речовини сполучної тканини входять специфічні білки муцини і мукоїди, що відрізняються від інших склеропротеїнів за будовою та фізико-хімічними властивостями. У сполучній тканині містяться в меншій кількості й інші білки — альбуміни, глобуліни, нуклеопротеїди і та ін. Колаген — найбільш поширений представник групи протеїноїдів. На нього припадає близько 30% усіх білків тваринного організму (табл. 4.1). Таблиця 4.1. Розподіл колагену в різних тканинах
За елементарним хімічним складом колаген відрізняється від більшості білків (наприклад, альбумінів, глобулінів) підвищеним вмістом азоту — в середньому 17,5%. Гліцин становить майже 1/4, пролін і оксипролін також 1/4 частину всіх амінокислотних залишків колагену. Оксипролін у таких великих кількостях знайдений лише в колагені. Колаген — основа колагенових волокон (діаметр їх 2-10 мкм), що є пучками найдрібніших фібрил. Період поперечного покреслення колагенових волокон 64 нм, що свідчить про повторюваність певних хімічних груп у структурі молекули. Колаген має фібрилярну будову і складається, головним чином, з ниткоподібних частинок (протофібрил), для яких характерне явище подвійного променезаломлення. За даними електронної мікроскопії діаметр протофібрил становить 50-100 нм. Наявність проліну і оксипроліну, в яких відсутні NH-групи, зумовлює наявність, крім пептидного зв'язку, зв'язку типу -СО^< з іншими властивостями. Оскільки на частку цих амінокислот припадає 22% залишків, то в молекулі колагену немає a -спіралі. Загальна кількість амінокислот у поліпептидному ланцюзі (первинній структурі колагену) становить близько 1000. Молекулярна маса такого ланцюга близько 120 000. Амінокислотний ланцюжок, закручений у спіраль, складає вторинну структуру колагену. Молекула колагену побудована з трьох поліпептидних ланцюжків (триплет), скручених разом навколо загальної осі (мал. 4.1). Вони утворюють третинну структуру колагену з молекулярною масою близько 360 000, завдовжки 280 і діаметром 1,4 нм. Таку молекулу називають тропоколагеном (ідентичний проколагену). Частинки такого розміру і будови є структурною одиницею — мономер, або молекула колагену. Особливість амінокислотного складу проколагену полягає в тому, що в ньому немає тирозину, тоді як у колагені його міститься близько 1%. На відміну від колагену, він порівняно добре розщеплюється трипсином. В результаті агрегації молекул тропоколагену в поздовжньому (кінець з кінцем) і поперечному напрямках відбувається утворення четвертинної структури колагену — протофібрил, які є якнайтоншими волокнами. Протофібрили об'єднуються у фібрили — більші одиниці, що мають діаметр у межах сотень нанометрів, видимі в електронному мікроскопі.
а — триланлюжкова молекула;б — поліпептидний ланцюжок;в — третинна структура У будові тропоколагену, протофібрил і фібрил беруть участь глюкоза, різні мукополісахариди (гіалуронова кислота, хондроїтин-сульфат С), які виконують роль стабілізуючої, цементуючої речовини. У складі колагену становить 0,86% вуглеводів. Нативний колаген нерозчинний у воді та органічних розчинниках і в дуже слабкому ступені піддається дії розведених кислот, лугів і протеолітичних ферментів. Проте триваліша дія кислот, лугів і ферментів викликає зворотну зміну колагену. Для колагенових волокон характерна значна механічна міцність: вони лише злегка розтягуються — межа пружності вологих волокон складає 7% до початкового стану. Нерозчинність і стійкість колагену пояснюється наявністю особливих поперечних міжмолекулярних і внутрішньомолекулярних зв'язків (мал. 4.1) і залежить від виду і віку тварини, а також від тканин, у яких він міститься. Із збільшенням віку тварини кількість поперечних зв'язків в структурі колагену зростає і його стійкість підвищується. Ізоелектрична точка колагену тварин різного віку неоднакова; для колагену зі шкури теляти вона знаходиться при рН 6,36, зі шкури великої рогатої худоби — при рН 7,0.
Колаген здатний до значного поглинання води. Вміст вологи в дермі, що дуже обводнена, доходить до 200% від маси сухої речовини і залежить від виду тварини, її віку і від топографічної ділянки. Висока гідратація колагену пов'язана з вмістом у його молекулі великої кількості бічних полярних груп. Зв'язування води колагеном зумовлене гідратацією функціональних груп, пептитдних зв'язків білка за рахунок утворення водневих зв'язків: ОН-група зв'язує 2-3 молекули Н2О; СООН-група зв'язує 3-4 молекули Н2О; СО-група зв'язує 2 молекули Н2О; NH-група зв'язує 1 молекулу Н2О. Зв'язана вода під час взаємодії з білком змінює свої властивості. Вона втрачає здатність розчиняти сторонні речовини і не замерзає навіть за t = -20°С. Здатність колагену до набухання має велике значення для м'ясного, желатинового і шкіряного виробництва. Під час нагрівання колагену з водою (до 65°С) його волокна деформуються, згинаються, довжина їх скорочується до 1/3 первинного розміру. Одночасно з цим вони втрачають здатність до поперечної покресленості (в розчин переходить близько 60% мукоїдів), стають еластичнішими (каучукоподібними) і прозоро-склоподібними. Під мікроскопом можна спостерігати дуже сильну гомогенізацію їх мікроструктури. Незворотна деформація колагену, під час нагрівання його у водному середовищі, називається зварюванням, а температура, за якої вона відбувається, — температурою зварювання. Процес зварювання колагену незворотний — після охолоджування колаген у початковий стан не повертається (в процесі зварювання розриваються поперечні міжмолекулярні зв'язки). Під час зварювання колагену відщеплюються молекули води, зв'язані в його структурі. Зварений або такий, що перейшов у желатин, колаген легко перетравлюється трипсином, оскільки зважаючи на порушення водневих зв'язків у молекулі колагену і втрати просторової орієнтації поліпептидних ланцюгів, руйнування четвертинної, третинної структур збільшується доступність пептидних зв'язків білка для ферментативної дії. Є зв'язок між температурою зварювання і вмістом оксипроліну в колагені, оскільки оксипролін бере участь в утворенні поперечних зв'язків. Чим більше оксипроліну міститься в колагені, тим вища температура зварювання. Попереднє руйнування поперечних зв'язків лугом знижує температуру зварювання. Швидкість переходу колагену в желатин залежить від виду тварини, самої сировини, температури і попереднього оброблення, головним чином лугами і кислотами. Найістотніша відмінність зварювання від денатурації — це вплив обох процесів на форму молекул. Денатурація завжди характеризується збільшенням асиметрії частинок, тобто витягуванням їх. Зварювання призводить якраз до зворотного ефекту. Витягнута уздовж осі волокна молекула колагену в результаті зварювання втрачає витягнуту форму — коротшає. Наслідком цього скорочення є усадка звареного зразка. Якщо колаген тривалий час нагрівати у воді за температури 65-90°С, то відбувається його денатурація: він переходить у водорозчинну речовину — глютин. Процес перетворення колагену на глютин називають пептизацією. Практично одночасно з пептизацією починає розвиватися гідроліз глютину, що утворився, з утворення глютоз. За відмінністю утворення желатину під дією гарячої води колаген поділяється на волокнистий (у дермі та сухожиллях), гіаліновий (у кістковій тканині — осеїн), хондриновий (у складі хрящів), іхтуліновий (у складі риб'ячого міхура). Іхтуліновий колаген переходить у клей вже за температури 40°С. Желатин у розчиненому стані є золем, у застиглому — гелем. Під час нагрівання до 45°С він розчиняється, оскільки підвищення температури і коливальні рухи молекул сприяють розриву лабільних зв'язків. Під час кип'ятіння зі слабкими кислотами або у воді желатин швидко гідролізується і втрачає здатність до утворення гелю. Характерною властивістю желатину є його здатність до набухання. Мінімальне набухання відбувається в ізоелектричній точці (рН 4,7). Набухання посилюється і досягає 100-1000% при зрушенні рН у кислий бік до 3,3-3,6, а при зрушенні реакції в лужний бік це збільшення менш значне. Продукти проміжного гідролітичного розпаду желатину за тривалого його нагрівання (термолізі) — поліпептиди — одержали назву желатоз. їх багато утворюється під час тривалого оброблення колагену гарячою водою. Такий продукт називається клеєм. Еластин входить до складу еластичних волокон, які мають жовтувате забарвлення, абсолютно не схожих на колагенові. Вони безструктурні, здатні розгалужуватися та з'єднуватися між собою. Довжина еластичних волокон на відміну від колагенових під час розтягування може збільшуватися удвічі. За механічними властивостями еластин дуже схожий на каучук. Волокна його беруть участь в утворенні тканин (зв'язки), для яких характерні тривалі напруги і повернення після закінчення розтягування в первинний стан. За будовою еластин близький до мукоїдів. Еластин дуже стійкий. Він не розчиняється в холодній і гарячій воді, розчинах солей, розведених кислотах і лугах; навіть міцна сірчана кислота діє на нього слабко. У протилежність колагену з еластину не утворюється желатин. До складу еластину входять специфічні амінокислоти, не характерні для інших білків, — десмозин та ізодесмозин, кожна з яких складається з чотирьох молекул лізину. Десмозин та ізодесмозин утворюють поперечні зв'язки (зшивання) між поліпептидними ланцюгами еластину. Еластин містить 7% полярних бічних груп (колаген 34%), що зумовлює низьку гідратацію еластину. Ретикулін — складний білок (простетична група — полісахарид), майже не набухає у воді, а також досить стійкий (не розчиняється протягом багатьох годин у міцних кислотах, лугах і гарячій воді). За наявності сірчистого натрію волокна ретикулінів, частково руйнуються. Муцини і мукоїди входять до складу сполучної тканини в порівняно невеликій кількості. У міжклітинній речовині ці білки спільно з мукополісахаридами утворюють комплекси, які утримують фіблярні і клітинні компоненти в певному структурному розташуванні. Разом з тим муцини є обов'язковою складовою частиною багатьох секретів: слини, слизової шлунку тощо. У слизовій сполучній тканині муцинів і мукоїдів досить багато. Вони відносяться до групи складних білків — глюкопротеїдів. До складу простетичної групи муцинів і мукоїдів входять галактоза, глюкоза, глюкозамін або галактозамін і глюкуронова кислота, а також оцтова і сірчана кислоти. Альбуміни і глобуліни. Білки, що мають властивості альбумінів і глобулінів, трапляються в сполучній тканині, головним чином, в її клітинах. Вміст їх порівняно з іншими білками невеликий. За наявності цих білків желатин стає каламутним. Високий вміст альбумінів і глобулінів (4,9-5,5%) присутній у вухах і губах. Мукополісахариди. У сполучній тканині та її похідних широко представлені різні складні полісахариди, які виконують роль цементуючого компоненту міжклітинної речовини, беруть участь в утворенні міжмолекулярних зв'язків пептидних ланцюгів колагену, ретикуліну, еластину, входять до складу муцинів і мукоїдів, а також бувають у вільному стані. Ці самі речовини виконують і захисну роль у сполучній та інших тканинах і органах по відношенню до мікроорганізмів. До кислих мукополісахаридів належить значна кількість хімічно споріднених, але різних за будовою сполук. Найпоширеніші в тканинах тварин кислоти гіалуронова, гепарин, кератосірчана і хондроїтинсірчана. З мукополісахаридів найпоширеніша гіалуронова кислота, яка частіше трапляється у вільному стані. Будучи основною речовиною міжтканинних і міжклітинних утворень організму, гіалуронова кислота виконує важливі біологічно захисні функції. Запитання для самоконтролю 1. Охарактеризуйте особливості будови сполучної тканини. 2. Назвіть основні речовини, що формують хімічний склад сполучної тканини. 3. Дайте характеристику основним властивостям білкових речовин сполучної тканини. 4. Яку роль відіграють мукополісахариди в будові сполучної тканини? 5. Назвіть мінеральний склад сполучної тканини. 6. Перерахуйте і дайте характеристику основним функціям в організмі тварин сполучної тканини. 7. Які існують різновиди сполучної тканини? У чому полягають особливості їхньої будови й хімічного складу?
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.008 с.) |

 Мал. 4.1. Структура колагену:
Мал. 4.1. Структура колагену: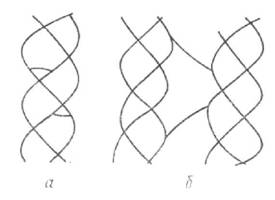 Мал. 4.1. Поперечні зв'язки в молекулі колагену: а — внутрішньомолекулярні поперечні зв'язки; б — міжмолекулярні поперечні зв'язки.
Мал. 4.1. Поперечні зв'язки в молекулі колагену: а — внутрішньомолекулярні поперечні зв'язки; б — міжмолекулярні поперечні зв'язки.


