
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневі структури бактеріальної клітиниСодержание книги
Поиск на нашем сайте
Незважаючи на зовнішній простий вигляд, бактеріальна клітина є складним живим об’єктом (рис. 28), будова якого за багатьма ознаками нагадує будову клітин рослинного чи тваринного походження. Бактеріальна клітина оточена щільною оболонкою – клітинною стінкою. У багатьох бактерій ззовні від клітинної стінки розташовані капсула або слизові шари, пілі (ворсинки) та джгутики. Всередину від клітинної стінки розташована цитоплазматична мембрана (обов’язкова структура клітин усіх бактерій), яка оточує цитоплазму. В цитоплазмі знаходиться бактеріальне ядро, рибосоми, запасні речовини та інші бактеріальні структури. Структури, розташовані ззовні від цитоплазматичної мембрани, називають поверхневими. Клітинна стінка належить до обов'язкових структур бактеріальної клітини. Винятком є мікоплазми та L-форми бактерій, які позбавлені цієї структури. Клітинна стінка – це структура ригідна, але в той же час вона до певної мірі й еластична. Вона визначає форму бактеріальної клітини. Це легко демонструється експериментально: якщо порушити цілісність клітинної стінки, утворюються сферопласти або протопласти, які змінюються морфологічно.
Клітинна стінка захищає внутрішній вміст клітини від механічних і осмотичних впливів зовнішнього середовища, відіграє важливу роль у регуляції росту, поділу клітини. Хімічний склад і будова клітинної стінки різних еубактерій відрізняються між собою, що зумовлює здатність клітини по різному фарбуватися за Грамом (табл. 5).
Таблиця 5 Хімічний склад клітинних стінок грампозитивних І грамнегативних прокаріот
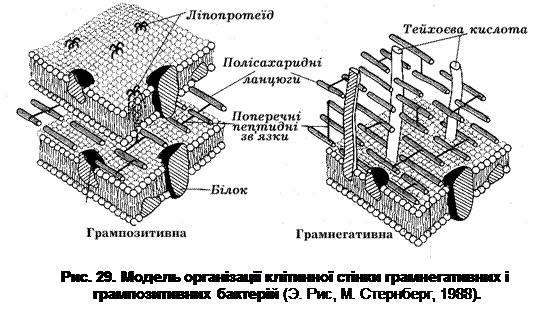
Важливим структурним компонентом клітинної стінки як грампозитивних, так і грамнегативних бактерій є біополімер – мукопептид (пептидоглікан, глюкозамінопептид, глікопептид, або муреїн (лат. murus – стінка) (рис. 29). Саме цей біополімер і визначає ригідність бактеріальної клітинної стінки. Його вміст у клітинних стінках грампозитивних прокаріот досягає 50-90% за масою. У більшості видів грамнегативних бактерій вміст пептидоглікану коливається від 1 до 10%. В клітинних стінках ціанобактерій, які мають грамнегативний тип організації клітинної стінки, визначається 22-52% муреїну.
За допомогою електронної мікроскопії було показано, що клітинна стінка грампозитивних прокаріот має вигляд гомогенного електронно-щільного шару. Товщина цього шару коливається у різних видів бактерій від 20 до 50 нм. Клітинна стінка грацилікутних бактерій являє собою багатошарову (гетерогенну) структуру, яка включає: - внутрішній електронно-щільний шар завтовшки 2-3 нм, представлений пептидогліканом; - ззовні до нього примикає шар завтовшки 8-10 нм, який складається з двох електронно-щільних смужок, розділених електронно-прозорим проміжком. Таку трикомпонентну структуру клітинної стінки грамнегативних бактерій, яка нагадує елементарну мембрану, називають зовнішньою мембраною; а простір між ЦПМ і зовнішньою мембраною – периплазматичним.
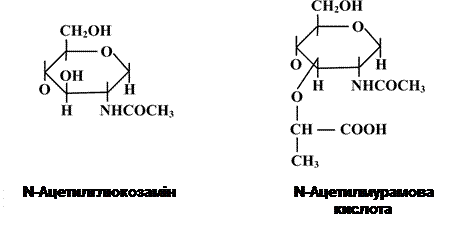
Таким чином, клітинні стінки грампозитивних і грамнегативних прокаріот суттєво відрізняються між собою за ультраструктурою та хімічним складом. Метод диференціації бактеріальних клітин був запропонований у 1884 р. датським ученим Х. Грамом (1853-1938) і увійшов у мікробіологічну практику як метод Грама. Суть методу полягає в тому, що в певних видів бактерій деякі компоненти клітинної стінки при взаємодії з генціановим (або кристалічним) фіолетовим у присутності йоду утворюють стійкий комплекс, який не вимивається спиртом або ацетоном. Такі бактерії звуться грампозитивними (або фірмакутними). Бактерії, які не фарбуються за методом Грама, називають грамнегативними (або грацилікутними). Фарбування за Грамом є одним з важливих методів диференціації бактерій. Теоретично всі бактерії можна розділити на дві групи: грампозитивні та грамнегативні. Реально мають місце випадки, коли один і той же мікроорганізм характеризується як грамваріабельний, тобто залежно від віку культури фарбується за Грамом як позитивно, так і негативно. Отже, клітинні стінки грампозитивних і грамнегативних бактерій відрізняються між собою за ультраструктурою та хімічним складом, але обов’язковим і одним з основних їх компонентів є пептидоглікан. Цей біополімер не виявляється в клітинах інших організмів, тобто він є унікальною структурою прокаріот. Молекула пептидоглікану має скелет, який утворюється залишками N-ацетилглюкозаміну (N-Ac.Gl.) і N-ацетилмурамової кислоти (N-Ac.M.). N-Ac.Gl. – це похідне глюкози, в якій гідроксильна група при другому атомі вуглецю заміщена аміногрупою, до якої приєднується ацетильний залишок. Молекула N-Ac.M. – це ефір N-Ac.Gl. і молочної кислоти. Ця сполука зустрічається виключно в клітинах прокаріот, тобто
є унікальною для них сполукою.
Обидві молекули з’єднуються між собою b-1,4-глюкозидними зв’язками, утворюючи лінійну структуру – глікан (рис. 30).
Елементи, що утворюють глікан, подібні до таких дисахаридів як целобіоза чи хітин. Але на відміну від целобіози й хітину до структури глікану входять карбоксильні групи, які і визначають його кислотні властивості До карбоксильної групи молочної кислоти в молекулі N-Aс.M. приєднується пептид. У багатьох випадках – це тетрапептид. Пептидний залишок включає L- i D-форми амінокислот (неприродна конфігурація, оскільки біологічну активність проявляють лише L-форми), які чергуються між собою. До складу тетрапептиду часто входить також незвична амінокислота – диамінопімелінова (DAP), яка знаходиться в мезоформі.
До карбоксильної групи N-Aс.M. у молекулі глікану приєднується аміногрупа амінокислоти, яка стоїть у першому положенні пептиду (рис. 31). Найчастіше такою амінокислотою є L-аланін, інколи L-форма серину або гліцину. У другому положенні знаходиться D-глутамінова кислота. Вона з’єднується в подальшому з діамінокислотою, яка займає третє положення у пептидному залишку пептидоглікану. Диамінокислотою (третє положення) найчастіше служить m-диамінопімелінова кислота (m-DAP). Інколи в третьому положенні може знаходитися: LL-DAP, D-лізин, L- або D-орнітин, m-2,6-диаміно-3-гідрокси-b-пімелінова, 2,4-диаміномасляна кислота або гомосерин. Четвертою амінокислотою в багатьох випадках пептидогліканів виявляється D-аланін. Пептидний залишок пептидоглікану не обов’язково має чотири амінокислотних залишки. Інколи пептид може включати два термінальних D-Ala, в інших випадках він може мати всього три амінокислотних залишки. D-глутамінова кислота має дві карбоксильні групи. Одна з них залишається вільною або служить місцем з’єднання з амінокислотним залишком другого пептиду, тобто є місцем зшивання двох пептидів. Вивчення пептидогліканів різних бактерій показало, що всі вони організовані однотипово і мають глікановий ланцюг, пептидні ланцюги і перехреснозв’язуючі містки, які з’єднують пептидні залишки. Усе це створює сітчасту структуру цього біополімеру, схема просторової організації якого представлена на рис. 32.
При вивченні ферментних гідролізатів пептидогліканів було виділено декілька мінорних компонентів: - похідне мурамової кислоти, в якій гідроксил у С6 заміщений О-ацетильною або фосфатною групою. Остання зв’язує пептидоглікани з іншими полімерами клітинної стінки, наприклад, із тейхоєвими кислотами; - у деяких залишках мурамової кислоти замість залишку N-Aс.Gl. визначається N-ацетилманозамін; - інколи виявляється мурамова кислота з вільною, тобто неацильованою, аміногрупою; - визначається невелика кількість мурамової кислоти, яка замість N-ацетильних має N-гліколільні групи.
Товщина одного шару пептидоглікану коливається в межах 1,5-2,0 нм, тобто можна вважати, що пептидоглікан грамнегативних бактерій є одно- або двошаровим, а в грампозитивних – має 20-40 шарів, що визначається товщиною клітинної стінки.
Пептидоглікан виконує низку функцій: - виявляє ригідність (цупкість, механічну міцність), отже, він визначає форму бактеріальної клітини; - протидіє тургорному тиску вмісту клітини, тобто запобігає осмотичному лізису; - зумовлює значною мірою антигенну специфічність бактеріальної клітини; -
деякі елементи клітинної стінки виявляють неспецифічний ад’ювантний ефект. Ад’юванти – це речовини, що посилюють імунну відповідь на введення антигена. У випадку пептидоглікану це, як правило, трипептиди, з’єднані з N-AcM:
- наявність вільних карбоксильних (СОО-) або аміногруп (NH+) визначає поверхневий заряд клітини.
Таким чином, пептидоглікан є одним з важливих компонентів клітинної стінки бактерій, але його структура, як біополімера, може варіювати. Оскільки пептидоглікан деяких бактерій має антигенні властивості, можливість інгібування його синтезу має велике значення для медицини. Муреїновий шар грампозитивних і грамнегативних бактерій можна зруйнувати літичними ферментами або інгібувати його синтез антибіотиками пеніцилінового ряду: бензилпеніциліном, 2-оксибензил-пеніциліном, n-гептилпеніциліном, п-амілпеніциліном та ін. Ефект інгібування синтезу речовини клітинної стінки виявляють також бацитрацин, ванкоміцин, цефалоспорин, циклосерин. Ферменти, які руйнують структуру пептидоглікану, вперше були описані О. Флемінгом у 1922 р., вони відомі як лізоцими. Лізоцим (ацетилмурамідаза) – бактерицидний фермент, який виявляється в сльозовій рідині, носовому слизу, яєчному білку, молоці. Цей фермент виділений також з клітин деяких бактерій (наприклад, E. coli, деяких представників роду Streptomyces) і бактеріофагів. Він розриває в молекулі муреїну глюкозидні зв’язки між першим атомом вуглецю N-Аc.M. і четвертим – у молекулі N-Аc.Gl. Унаслідок такої дії полісахаридні ланцюги розриваються до дисахаридних фрагментів. Місце розриву молекули пептидоглікану залежить від ферменту, який використовується з цією метою (рис. 33): - ендо-N-ацетилглюкозаміл-N-ацетилмурамідаза (глюкозидаза) – розриває зв’язки після N-ацетилглюкозаміну; - ендо-N-ацетилмураміл-N-ацетилглюкозиламідаза (глюкозидаза) – діє на зв’язки після N-ацетилмурамової кислоти; - N-ацетилмураміл-N-аланінамідаза – відщеплює тетрапептид від молекули глікану.
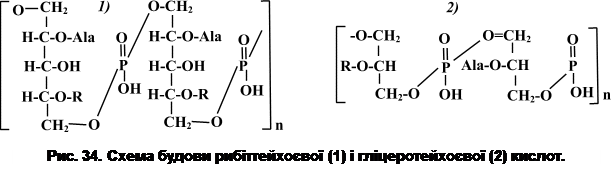
Порушити цілісність структури пептидоглікану можна також дією ендопептидаз – ферментів, які розривають зв’язки в молекулі тетрапептиду або між двома пептидами. Внаслідок такої дії утворюються сферопласти – структури, частково позбавлені клітинної стінки, або протопласти – структури, повністю позбавлені клітинної стінки. Експериментально функція пептидоглікану вперше була продемонстрована С. Вейбелом у 1953 р. З цією метою він помістив клітини B. megaterium в ізотонічний розчин сахарози, а потім додав лізоцим. Паличкоподібні клітини перетворилися на клітини сферичної форми – протопласти, які зберігали дихальну активність, синтезували білок і нуклеїнові кислоти. Через те, що протопласти не мають клітинної стінки, вони набувають найрізноманітнішої форми: видовженої, роздутої, грушоподібної, спіральної тощо. Таким чином, було показано, що лізис клітинної стінки не призводить до порушення метаболічних функцій: протопласти дихають подібно до інтактних клітин, а якщо до цього мало місце ініціація процесу спороутворення, то воно завершується утворенням спори. В гіпотонічних розчинах протопласти руйнуються. Через те, що в протопластів відсутня клітинна стінка, вони стають більш чутливими до дії хімічних речовин і тому є зручною моделлю для проведення фізіологічних досліджень. Вважається, що гіпертонічні розчини є стабілізуючим фактором для клітин, які позбавлені клітинної стінки, внаслідок чого вони набувають сферичної форми. Крім того, встановлено, що певну роль в отриманні сферопластів відіграє також речовина, з якої було одержано гіпертонічний розчин. При утворенні сферопластів з E. coli гіпертонічний розчин, одержаний із сахарози, добре зберігає протопласти, тоді як у гіпертонічному розчині із целобіози вони руйнуються. Якщо протопласти відмити від лізоциму і помістити в оптимальне середовище, вони збільшуються в розмірах і виявляють обмежену здатність до розмноження. Але вони не відновлюють здатності до синтезу речовини клітинної стінки. Регенерація клітинної стінки відбувається лише в деяких спеціальних умовах, тоді клітина набуває своєї вихідної форми. В гіпертонічних або в ізотонічних розчинах протопласти більш-менш стабільні, в гіпотонічних – відбувається осмотичний лізис. Гідроліз муреїну грамнегативних бактерій під дією літичних ферментів не призводить до видалення зовнішньої мембрани. При цьому утворюються чутливі до зміни осмотичного тиску структури, які називаються сферопластами. Сферопласти, як і протопласти, більші за клітини, з яких вони утворюються, в 3-10 разів. Але на відміну від протопластів, вони містять залишки мурамової та диамінової кислот і легше ревертують у вихідні форми. L-форми – це бактерії, які позбавлені клітинної стінки, але здатні до розвитку. Вперше L-форми спостерігали вчені Лістерівського інституту (Великобританія) у 1935 р., звідки і походить їхня назва. Було помічено, що культура Streptobacillus moniliformis може утворювати атипові форми колоній, в яких виявляються анормальні клітини. Якщо такі клітини помістити в середовище, котре містить сироватку крові, вони можуть розмножуватися невизначено довго. Початково вважали, що це контамінанти або симбіонти (чи паразити) Streptobacillus moniliformis, але згодом була показана можливість деяких із цих клітин переходити (ревертувати) у вихідну ( паличкоподібну) форму. На агаризованих середовищах L-форми утворюють колонії, які вростають у поживне середовище і нагадують форму яєчні. Ріст таких колоній до-сить повільний. В колоніях визначаються структури, що відрізняються і морфологічно, і за розмірами: елементарні тіла розміром 0,2-1,0 мкм, які проявляють мінімальну здатність до розмноження; тіла кулястої або неправильної форми розміром від 1,0 до 5,0 мкм;структури ниткоподібної форми різних розмірів;великі тіла (5,0-10,0 мкм); безструктурні маси. У грампозитивних бактерій пептидоглікан є багатошаровою структурою. При цьому муреїновий матрикс ковалентно зв’язаний з іншими макромолекулами, до яких належать і тейхоєві кислоти (гр. teixos – стінка). Тейхоєві кислоти були відкриті Беділі зі співавт. у 1958 р. в клітинних стінках Bacillus subtilis, Staphylococcus aureus i Lactobacillus arabinosus. Згодом було доведено, що тейхоєві кислоти визначаються в клітинних стінках більшості грампозитивних бактерій. У еубактерій їх вміст може досягати 50%, а в актиноміцетів – 20-30%. Основою молекули тейхоєвої кислоти є полімерний ланцюг, в якому чергуються з’єднані ефірними зв’язками залишки рибітфосфату (або гліцеринфосфату). Одна молекула тейхоєвої кислоти може включати від 7 до 15, а інколи до 50 спиртових залишків. Деякі гідроксильні групи спиртів заміщені залишками D-Ala, глюкози, N-Ac.Gl. або N-Ac.галактозаміну (R). Залежно від характеру багатоатомного спирту рибіту чи гліцерину тейхоєві кислоти поділяють на дві головні групи – рибіттейхоєві й гліцеротейхоєві кислоти (рис. 34), причому клітинна стінка може містити обидві групи тейхоєвих кислот.
Вільні гідроксили фосфорної кислоти надають тейхоєвій кислоті поліаніонних властивостей. У гліцеротейхоєвій кислоті фосфатні залишки розташовані близько один до одного, що дозволяє їм захоплювати двовалентні катіони. Фосфатні групи рибіттейхоєвих кислот знаходяться на більшій відстані одна від одної, ніж у випадку гліцеротейхоєвих кислот, тому вони мають меншу спорідненість до двовалентних катіонів. Вільні аміногрупи аланіну надають тейхоєвим кислотам амфотерних властивостей і можуть нейтралізувати їхній внутрішній заряд. Клітинна стінка бактерій може містити як гліцеротейхоєві, так і рибіттейхоєві кислоти. Всі мембранні тейхоєві кислоти є гліцерофосфатними. Вважається, що тейхоєві кислоти є головними антигенами бактеріальної клітини. Їх антигенність посилюється при частковому гідролізі муреїну. Гліцеротейхоєві кислоти мембрани бактеріальної клітини ковалентно зв’язані з гліколіпідом. Такі комплекси називаються ліпотейхоєвими кислотами. Тейхоєві кислоти клітинної стінки можуть виконувати різні функції. Вони є додатковими елементами просторової організації структури клітинної стінки; тейхоєві і ліпотейхоєві кислоти виявляють антигенні властивості і визначають певною мірою антигенну специфічність клітинної поверхні; вуглеводневі компоненти тейхоєвих кислот входять до складу рецепторів для бактеріофагів; будучи поліаніонами, тейхоєві кислоти визначають поверхневий заряд клітини і впливають на катіонний обмін клітини; в деяких бактерій тейхоєві кислоти беруть участь у регуляції активності автолітичних ферментів – гідролаз, здатних лізувати власний пептидоглікан. Часто тейхоєві кислоти зв’язують власні літичні ферменти. При порушенні таких зв’язків клітина може лізуватися. Таким чином, крім пептидоглікану, до складу клітинних стінок грампозитивних бактерій входять тейхоєві кислоти, які служать додатковими елементами її просторової організації і виконують ряд інших важливих функцій. За хімічним складом клітинні оболонки архебактерій відрізняються від клітинних стінок грампозитивних та грамнегативних еубактерій, але їм також властива диференціація при фарбуванні за Грамом. Відмінність у структурі клітинної стінки еубактерій і архебактерій полягає, насамперед, у відсутності в складі клітинних оболонок архебактерій істинного пептидоглікану. Лише в клітинних стінках окремих архебактерій (наприклад, у представників роду Methanobacterium) визначається речовина, подібна до муреїну, яку називають псевдомуреїно м (рис. 35). Молекула псевдомуреїну має скелет, утворений N-Ac.-D-Gl. і N-Ac.-L-талозамінуроновою кислотою, з’єднаних між собою b-1,3-зв’язками. Така структура нагадує глікан. До N-Ac.-L-талозамінуронової кислоти приєднується пептид (пента- або тетрапептид). Пептидні фрагменти включають лише L-форми амінокислот: глутамінову, аланін, лізин та ін. Мурамова кислота в структурі псевдомуреїну не виявляється. Відсутні також D-форми амінокислот. Електронною мікроскопією показано, що клітинна стінка таких бактерій має вигляд однорідного шару завтовшки 15- 40 нм (як і в грампозитивних еубактерій). Описані також випадки (наприклад, деякі метаногенні бактерії), коли товщина клітинної стінки досягає 500 нм. При фарбуванні таких клітин за Грамом вони забарвлюються як грампозитивні. Такі клітинні стінки побудовані виключно з кислого гетерополісахариду, в складі якого виявляється галактозамін, нейтральні цукри та уронові кислоти.
У складі клітинних стінок деяких архебактерій (наприклад, екстремальні галофіли) муреїн не визначається. Частіше клітинна стінка складається з гетерополісахариду (у представників Halococcus) або глікопротеїну (Halobacterium). Гетерополісахаридну природу мають і клітинні стінки Methanosarcina barkeri. В такому випадку речовина клітинної стінки включає цукри, аміноцукри й уронові кислоти. Клітинна стінка деяких галобактерій і метанобактерій утворена білком. Інколи білки мають зв’язок з аміноцукрами. Незвичну будову має клітина Methanospirillum hungatii (рис. 36). Вона одягнута білковим циліндричним чохлом, який вкриває всю спіральну багатоклітинну нитку. Між окремими клітинами є проміжки (спейсери), де може відбуватися розрив нитки, тобто її дроблення, розпад.
Отже, клітинні стінки різних груп бактерій відрізняються між собою як за хімічним складом, так і за організацією. До їх складу входять речовини, які належать до різних класів хімічних сполук, що забезпечує поліфункціональність клітинної стінки. Клітини багатьох бактерій здатні синтезувати органічні речовини, які відкладаються із зовнішнього боку клітинної стінки у вигляді слизу або капсул (рис. 37).
Інколи клітина має і капсулу і аморфний слиз однакового хімічного складу. Наприклад, клітини Leuconostoc mesenteroides мають капсулу декстранової природи і слиз такого ж самого складу, який розчиняється в середовищі. Капсулою називають шар, який служить зовнішнім покривом клітини і зберігає зв’язок із клітинною стінкою. Залежно від її товщини і консистенції розрізняють: макрокапсули, мікрокапсули, слизові шари і розчинний слиз. Макрокапсули – це структури, які добре видно у світловому мікроскопі після обробки препарату китайською тушшю або нігрозином. При такій обробці капсули виглядають світлими структурами на темному фоні (рис. 38). Тонші капсули визначаються при обробці гомологічними сироватками. Картина, яка виникає при цьому, нагадує набухання.
Вода складає 95-98% речовини капсули, а на інші компоненти припадає 2-5%. Хімічний склад сухої речовини досить різноманітний, але всі речовини сухого залишку гідрофільні, з негативним зарядом і мають високу молекулярну масу (~1 000 000).
Найпоширенішими є капсули полісахаридної природи (Streptococcus, Aerobacter, деякі представники роду Bacillus). Наприклад, капсульний полісахарид B. polymyxa має у своїй структурі залишки манози, глюкози, галактози та глюкуронової кислоти в рівних співвідношеннях – 1:1:1:1. Речовина капсули може бути представлена як гомо-, так і гетерополісахаридами. Полісахарид S. pneumoniae, наприклад, складається із залишків глюкози і глюкуронової кислоти, які чергуються. Інші полісахаридні капсули містять галактозу, рамнозу, 2-кето-3-дезоксигалактонат, манозу та інші цукри. У багатьох бацил (B. anthracis, B. subtilis та ін.) капсула складається з поліпептидів, які побудовані залишками D- і L-глутамінової кислот. У деяких представників роду Bacillus речовина капсули утворена лише полі-D-глутаміном. Речовина капсули B. megaterium має більш складну структуру – до її складу входять поліпептидний і полісахаридний компоненти. Полісахаридна оболонка представників роду Aerobacter чи Klebsiella за своїми розмірами теж належить до макрокапсул. Вона містить складний гетерополісахарид, який складається з олігосахаридних одиниць, що повторюються. Олігосахарид Aerobacter aerogenes має, наприклад, такий склад:
У деяких мікроорганізмів, наприклад M. tuberculosis, речовина капсули складається з гетерополісахаридів, ліпідів та інших високомолекулярних сполук. Такий склад капсули сприяє виживанню клітин цих бактерій у несприятливих умовах довкілля. При світлопольних методах дослідження капсула має вигляд гомогенної структури. На електронних мікрофотографіях виявляютьсяфібрили, розташовані перпендикулярно або паралельно клітинній стінці. Інколи такі фібрили утворюють сітчасту структуру. На щільних поживних середовищах капсульовані клітини утворюють блискучі колонії S-типу. При мутаціях капсульні форми перетворюються на безкапсульні, а колонії набувають R-типу. Синтез речовини капсули в різних груп мікроорганізмів досить різноманітний. В більшості випадків капсульні полісахариди синтезуються із сахаронуклеотидних попередників. Глікозильні залишки при цьому послідовно переносяться на ланцюги полісахариду за участю ліпідного переносника цитоплазматичної мембрани. Вважається, що цукри, які утворюють речовину капсули, синтезуються самою клітиною, а склад середовища мало впливає на їхній біосинтез. Якщо речовиною капсули є декстран (поліглюкоза) або леван (поліфруктоза), то її синтез йде за рахунок екзогенного субстрату – дисахариду сахарози (a-глюкозил-b-фруктоза). У процесі біосинтезу левану має місце послідовне приєднання фруктозильних одиниць до акцепторної молекули сахарози:
При синтезі декстрану має місце послідовне приєднання глюкозильних одиниць до залишку молекули сахарози. Таким чином, декстран – гетерополісахарид, який складається із залишків a-D-глюкози, з’єднаних у положенні 1,6, тобто декстран – цеa-1,6-глюкан, паралельні ланцюги якого утворюють сітку. Було помічено, що багато мікроорганізмів особливо інтенсивно утворюють слиз на середовищах, які містять сахарозу. Одним з таких мікроорганізмів є Leuconostoc mesenteroides – представник гетероферментативних молочнокислих бактерій. За короткий проміжок часу цей мікроорганізм трансформує розчин цукру в декстрановий гель, через що на цукрових підприємствах він отримав назву “бактерія жаб’ячої ікри”. Мікрокапсули інколи розглядають як частину клітинної стінки. Вони мають товщину менш як 0,2 мкм. Найкраще мікрокапсули вивчені в представників родини Enterobacteriaceae; вони мають гетерополісахаридну речовину. Струшуванням або гомогенізацією бактеріальних суспензій капсули можна відділити від поверхні мікробної клітини або можна отримати безкапсульні мутанти. Ці процедури не призводять до загибелі клітини, тобто капсула не є життєво важливою структурою. Виходячи зцього, можна було б думати, що капсула – це інертна структура клітини, але це не так. Капсула виконує низку важливих функцій: - захищає (екранує) клітину від дії токсичних речовин; - оскільки речовина капсули має негативний заряд, на поверхні клітини концентруються катіони, створюється катіонний пул, який може використовуватися для потреб клітини; - будучи речовиною сильно гідрофільною, сприяє поглинанню води клітиною, що важливо в умовах дефіциту вологи; - покращує адгезивні властивості клітини; - речовина капсули виявляє антигенну специфічність, що використовується для серотипування багатьох груп бактерій (К-антиген); - у деяких бактерій речовина капсули служить для імунологічної мімікрії – утворення мікроорганізмом антигена, близького до антигенів макроорганізму – організму хазяїна. У таких випадках імунна система макроорганізму не спроможна виробляти антитіла до цього мікроорганізму, бо вона їх не розпізнає. Наприклад, речовина капсули Y. pestis має антиген, який є спорідненим з антигеном еритроцитів О-групи крові, і в таких випадках людина стає беззахисною при інфікуванні.
Зв’язок капсули з клітинною стінкою може бути різним. Деякібактерії синтезують слизові речовини, котрі легко відділяються від клітин, особливо при культивуванні в рідкому поживному середовищі. В інших випадках зв’язок між капсулою і клітинною стінкою настільки стійкий, що її інколи розглядають як частину клітинної стінки. Наявність капсули залежить від штаму мікроорганізму й умов його культивування. Речовина, яка оточує клітину, може мати аморфний, безструктурний вигляд і легко відділятися від поверхні клітини. В такому випадку говорять про слизові шари. Інколи слиз зв’язує окремі клітини, утворюючи специфічні угрупування. Так, Acetobacter xylinum виділяє целюлозу, яка зв’язує окремі клітини в щільну плівку. В Sarcina ventriculi клітини з’єднуються за допомогою целюлози в “агрегати” правильної форми. Целюлоза служить у цих випадках зв’язуючою речовиною. За своєю структурою йфункцією вона відрізняється від речовини капсули. Втрата здатності до утворення целюлози в мутантів не порушує росту мікроорганізмів, але при цьому змінюється характер угрупувань, які утворюють клітини. Чохли, на відміну від капсул, мають, як правило, тонку структуру. Часто в них визначається декілька шарів з різною будовою. Інколи чохол може оточувати декілька клітин. Це особливо характерно для нитчастих бактерій, наприклад, для Sphaerotillus natans – бактерії, що окиснює залізо. У воді цей мікроорганізм формує нитки, які утворюють згустки, котрі можуть забивати труби, відстійники, ями для стоків тощо. Така нитка має декілька клітин, вкритих загальним чохлом. У випадку Sphaerotillus natans ця структура включає (у %): вуглеводи (36); гексозаміни (~11); білки (~27); ліпіди (~5); сполуки фосфору (~0,5). Чохли S. natans часто інкрустовані окислами заліза. На поверхні деяких бактерій визначаються також шипи. Шипи – це структури циліндричної форми білкової природи, які закріплюються на поверхні зовнішньої мембрани. Довжина шипів коливається в межах 1-3 мкм, а товщина становить ~65 нм. Білок шипів – спінін (лат. spina – шип) має молекулярну масу 19 000. Шипи виявляються на поверхні клітин деяких псевдомонадоподібних планктонних морських бактерій. Їх легко можна обірвати (порушити) дією механічних факторів, органічних розчинників. На поверхні однієї клітини визначається до 10 шипів. Клітини, які мають шипи, як правило, нерухомі. Вони мають більшу щільність і легше осідають. Функції шипів вивчаються. У деяких бактерій відбувається направлене виділення слизу, внаслідок чого утворюються стеблинки (рис. 39 ), які можуть забезпечувати бактеріям можливість обмеженого переміщення (наприклад, Nevskia, Gallionella).
Між цими надоболонковими структурами в прокаріот встановлено багато перехідних форм, через що інколи не можна чітко відмежувати капсулу від слизових виділень клітини чи капсулу від чохла. Пілі (фімбрії) – це прямі циліндричні білкові структури, які виступають над поверхнею клітини і закріплені в клітинній стінці. Трубочка пілі проходить крізь шар муреїну і зовнішню мембрану клітини на її зовнішній бік. Одна й та сама клітина може мати пілі різних типів, які відрізняються як за будовою, так і за функціями. Загальною функцією пілей є те, що вони беруть участь в адгезії – прикріпленні бактеріальної клітини до субстрату або склеюванні клітин між собою (рис. 40).
Діаметр нитки пілі може коливатися від 3,0 до 10,0 нм, а довжина – від 0,3 до 4 мкм. На одній клітині визначається від 10 до кількох сотень пілей. Пілі виявляються на поверхні клітин з джгутиками, так і таких, які позбавлені джгутиків. Від них необхідно відрізняти статеві пілі або пілі типу F, які виявляються в клітинах-донорах. F-пілі визначаються по одній (інколи по дві) на клітину. Нитка пілі являє собою білок пілін з молекулярною масою 14 500 – 26 200. Білкові мономери зібрані в спіральні ланцюги навколо порожнинної серцевини. Найбільш детально пілі вивчені в клітин E. coli. В цих бактерій розрізняють пілі загального типу і статеві. Пілі загального типу поділяються на дві групи. Пілі типу 1 досить міцно зв’язані з клітиною. Вони стійкі до дії хімічних реагентів. Їх можна зруйнувати кип’ятінням у розчинах з низькими значеннями pH, що супроводжується денатурацією білка. Білок пілей цього типу має молекулярну масу 17 000. На поверхні бактеріальної клітини може визначатися від 50 до 400 пілей типу 1. Довжина пілі досягає 1,5 мкм, зовнішній діаметр становить ~7 нм, а діаметр внутрішнього отвору – 2,0-2,5 нм. Пілі типу 1 розташовуються перитрихально і виконують певні функції, а саме: - викликають аглютинацію еритроцитів, що зумовлено здатністю пілей приклеюватися до них; - визначають здатність клітини до адгезії; - надають клітині гідрофобності, внаслідок чого при рості в рідкому поживному середовищі такі бактерії утворюють поверхневу плівку; - знижують електрофоретичну рухомість клітин.
Пілі типу 2 антигенно і структурно нагадують пілі типу 1, але вони не сприяють утворенню плівки при рості таких бактерій у рідкому поживному середовищі і не викликають аглютинації еритроцитів. Можливо, що вони являють собою мутантну форму пілей типу 1. В ентеропатогенних штамів E. coli пілі є одним з факторів патогенності – вони забезпечують здатність клітин прикріплюватися до епітелію кишок. Це веде до колонізації епітелію бактеріями, внаслідок чого посилюється вплив бактеріального ентеротоксину на клітини епітелію кишок, порушується водний обмін тканин. При цьому бактерії інтенсивно розмножуються в тонких кишках, а потім у великих кількостях виносяться з фекаліями у довкілля. Статеві пілі – це білкові циліндри, розташовані перпендикулярно до поверхні клітини. Молекулярна маса білка, який виявляється в пілях цього типу, – 11 800. Товщина нитки статевої пілі коливається в межах 8,5-9,5 нм, а довжина досягає 1,1 мкм. При струшуванні бактеріальної суспензії вони легко руйнуються. Статеві пілі утворюються на клітинах донорських штамів, характерною особливістю яких є наявність особливого генетичного детермінанта – статевого фактора, або фактора трансмісивності. Останній може бути автономним репліконом (F-фактор), входити до складу автономного реплікона, або інтегруватися з бактеріальною хромосомою. Синтез F-піліну відбувається на рибосомах, зв’язаних з ЦПМ. В цитоплазмі він не виявляється. Пул піліну накопичується в ЦПМ. Кожна молекула має сигнальний пептид, який відщеплюється в процесі транспорту піліну через ЦПМ. Утворенню статевих пілей перешкоджає наявність у середовищі ціаніду, азиду натрію, динітрофенолу. F-пілін – це гідрофобна структура, яка легко дисоціює в розчинах додецилсульфату натрію і руйнується органічними розчинами. Клітини, що мають F-пілі, малорухливі і мають тенденцію до автоаглютинації (наприклад, при зниженні pH середовища). F-фактор має гени, які
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.78.182 (0.015 с.) |







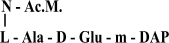







 Синтез леванів каталізується позаклітинною левансахаразою. Левановий тип капсул характерний для багатьох мікроорганізмів (Bacillus subtilis, B. cereus, Streptococcus salivarius, S. mutans, Azotobacter chroococcum та ін.).
Синтез леванів каталізується позаклітинною левансахаразою. Левановий тип капсул характерний для багатьох мікроорганізмів (Bacillus subtilis, B. cereus, Streptococcus salivarius, S. mutans, Azotobacter chroococcum та ін.).




