Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневі структури прокаріотичної клітиниСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цитоплазматична мембрана та внутрішньоклітинні Структури бактерій Цитоплазма – це вміст клітини, оточений цитоплазматичною мембраною ( ЦПМ). Вона є середовищем, яке зв’язує всі внутрішньоклітинні структури в єдину систему. Внутрішню порожнину клітини заповнює цитозоль – напіврідка колоїдна маса, що складається на 70-85% з води, РНК, білків (включаючи ферменти), продуктів і субстратів метаболічних процесів. У цитоплазмі знаходяться структури клітини (рибосоми, нуклеоїд та ін.), цитоплазматичні мембранні утвори (газові вакуолі, мезосоми, хроматофори, тилакоїди), включення, оточені білковою мембраною (хлоросоми, фікобілісоми, аеросоми, мегнетосоми, карбоксисоми), а також структури, позбавлені мембрани, котрі розглядаються як запасні речовини. ЦПМ є обов’язковим і життєво важливим структурним елементом кожної клітини. Порушення цілісності ЦПМ супроводжується втратою клітиною життєздатності. ЦПМ виконує низку важливих функцій: - служить вибірковим бар’єром між внутрішнім вмістом клітини і зовнішнім середовищем; - ЦПМ клітин багатьох груп прокаріот відіграє значну роль в енергетичному обміні клітини, чого не спостерігається в клітин еукаріот. Наприклад, в аеробних бактерій дихальна система перенесення електронів “вмонтована” в ЦПМ. (В еукаріот ця система локалізована в мітохондріях). При цьому бактерії з інтенсивним типом дихальної системи мають досить складну структуру ЦПМ – утворюються численні вп’ячування, які проникають у цитоплазму;
- вважається, що на внутрішній поверхні ЦПМ знаходяться спеціальні ділянки, до яких прикріплюється ДНК. Це підтверджується і тим, що ріст мембрани (її подовження) супроводжується поділом геномів. - ЦПМ виявляє певну пружність, але в той же час здатна і розтягуватися. Наприклад, якщо клітини Acholeplasma laidlawii помістити в гіпотонічний розчин NaCl, то їх поверхня збільшується приблизно на 50% без порушення цілісності мембрани.
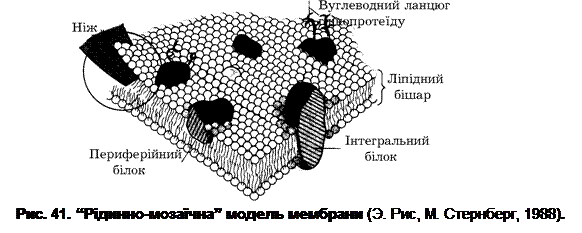
На долю ЦПМ припадає 8-15% сухої маси клітини. На електронних мікрофотографіях ультратонких зрізів ЦПМ має тришарову структуру (рис. 41): два електронно-щільних шари, які обмежують електронно-прозорий проміжок. При цьому осмофільні електронно-щільні шари мають товщину 2-3 нм кожен, а електронно-прозорий проміжок між ними – 4-5 нм.
За хімічним складом ЦПМ є білково-ліпідним комплексом, який містить 50-75% білків, 15-45% ліпідів та невелику кількість вуглеводів. У ліпідах мембран багатьох прокаріот виявлено низку специфічних жирних кислот, яких немає в мембранах еукаріотичних клітин. Найдетальніше вивченим компонентом мембран мікроорганізмів є ліпіди. В деяких бактерій, зокрема в грампозитивних, основна частина клітинних ліпідів локалізована в мембрані протопластів. Ліпіди мембрани складаються з фосфо- і нейтральних ліпідів. Фосфоліпіди є основними ліпідами ЦПМ бактеріальної клітини. Вони становлять ~20-30% сухої маси клітини, або 70-90% сухої маси ЦПМ. Скелет молекули мембранних Р-ліпідів утворюється фосфатидною кислотою (ФК), до складу якої входять гліцерин і залишки жирних кислот (R) ( рис. 42). До ФК приєднуються залишки спиртів, амінокислот та інших сполук (Х).
Найбільш поширеними серед мембранних Р-ліпідів є: фосфатидилетаноламін (ФЕ):
Склад Р-ліпідів може значно змінюватися, але функції мембрани, як правило, не порушуються. Але якщо вміст фосфатидилетаноламіну зменшується більше як на 50%, ріст клітини припиняється. Такий ефект не спостерігається навіть за повної відсутності кардіоліпіну. Близько 50% поверхні мембрани зайнято білками. Деякі з них мають слабкий зв’язок з ЦПМ і при зміні іонної сили розчину можуть вивільнятися. Ці білки називають периферійними. Частина білків має досить стійкий зв’язок з ліпідами ЦПМ, утворюючи білково-ліпідні комплекси, які становлять ~10% маси мембрани. Такі білки називають інтегральними. Білковий склад ЦПМ досить різноманітний. У мембрані E. coli, наприклад, визначається близько 120 різних білків. Серед них особливе місце займають транспортні білки, до яких належать пермеази, і білки, які забезпечують активний транспорт речовин, а також біосинтетичні ферменти, які здійснюють кінцеві етапи синтезу мембранних ліпідів і макромолекул клітинної стінки (муреїну, тейхоєвих кислот, ліпополісахаридів). У мембрані прокаріот знаходяться компоненти апарату регенерації АТР, а в пурпурових бактерій (Rhodospirillum) у ЦПМ локалізований і фотосинтетичний апарат клітини. Більшість мембран мікроорганізмів містять 2-5% вуглеводів. У деяких випадках вони можуть бути залишковим матеріалом клітинної стінки, що прилип до мембрани. Є дані, що в мембранах грампозитивних бактерій містяться гліколіпіди. Так, мембрани Micrococcus lysodeikticus містять манозилдигліцерид, а в Streptococcus faecalis виявляються моноглюкозилдигліцерид і галактозилглюкозилдигліцерид. Площа ЦПМ може змінюватися за рахунок інвагінацій. Останні утворюються в центрі клітинного поділу. Вважається, що такі інвагінаційні структури беруть участь у побудові поперечної перетинки в клітині під час її поділу. Інвагінаційні утвори необхідні також для розміщення центрів дихальної і фотосинтетичної активності. Це підтверджується, зокрема, тим, що такі інвагінації визначаються в мембранах бактерій з високою дихальною активністю (Azotobacter, нітрифікуючі бактерії). Таким чином, ЦПМ прокаріотичної клітини, в цілому, подібна до мембрани еукаріотичної клітини, але в бактерій вона багатша на білки. Раніше були описані відмінності між прокаріотичними і еукаріотичними клітинами щодо їх мембранних систем (див. табл. 1). Відсутність у прокаріот типових органел, тобто структур, повністю відмежованих від цитоплазми елементарними мембранами, – принципова особливість їхньої клітинної організації. Серед внутрішньоцитоплазматичних мембран розрізняють декілька видів (табл. 7). Розвинута система внутрішньоцитоплазматичних мембран характерна для більшості фотосинтезуючих прокаріот. Оскільки доведено, що в цих мембранах локалізований фотосинтетичний апарат клітини, вони дістали загальну назву фотосинтетичні мембрани. Усі фотосинтетичні мембрани, як і всі внутрішньоклітинні, – похідні цитоплазматичної мембрани, що утворилися внаслідок її розростання і глибинного вп’ячування (інвагінації) в цитоплазму. В деяких бактерій (наприклад, пурпурових) фотосинтетичні мембрани зберігають тісний зв’язок з ЦПМ і легко виявляються при електронно-мікроскопічному дослідженні ультратонких зрізів клітини. В ціанобактерій такий зв’язок менш виражений. Таблиця 7 Мембрани прокаріот
* Не виявляється в зелених бактерій і ціанобактерій Gloeobacter violaceus. ** Сильно розвинуті в нітрифікуючих, азотфіксуючих, метанокиснюючих бактерій.
Внутрішньоцитоплазматичні мембрани фотосинтезуючих бактерій можуть мати вигляд трубочок, пухирців (везикул, хроматофорів) або сплющених замкнутих дисків (тилакоїдів), утворених двома тісно зближеними мембранними пластинами (ламелами). Система фотосинтетичних мембран дуже пластична. Її морфологія і ступінь розвитку в клітині визначаються багатьма факторами зовнішнього середовища (інтенсивність світла, концентрація кисню, наявність поживних речовин) та віковими характеристиками культури. Проте в групі зелених бактерій та ціанобактерій Gloeobacter violaceus внутрішньоклітинні фотосинтетичні мембрани не виявляються. Основні компоненти їхнього фотосинтетичного апарату локалізовані в ЦПМ, і лише світлозбираючі пігменти (хлоросоми в зелених бактерій і фікобілісоми у ціанобактерій) знаходяться в особливих структурах, які прилягають до ЦПМ і не мають елементарної мембрани. У прокаріотичних організмів описані локальні вп’ячування ЦПМ – мезосоми, які добре розвинені і складно організовані в грампозитивних бактерій. У грамнегативних прокаріот ці структури виявляються рідше і вони простіше організовані. Мезосоми – це відносно прості, а інколи й досить складні вп’ячування ЦПМ. Вони відрізняються розмірами, формою і локалізацією в клітині. Виділяють три основних типи мезосом: ламелярні (пластинчасті), везикулярні (мають форму пухирців) і тубулярні (трубчасті) (рис. 43).
Часто можна спостерігати мезосоми змішаного типу, вони можуть складатися з ламел, трубочок і пухирців. За розташуванням у клітині розрізняють: мезосоми, які утворюються в зоні клітинного поділу і формування поперечної перетинки (септи); мезосоми, до яких прикріплений нуклеоїд; мезосоми, які сформовані внаслідок інвагінації периферійних ділянок ЦПМ. Термін «нуклеїдосоми» відноситься до мезосомальноподібних утворень, зв'язаних з хромосомою. Зв’язок ДНК зі специфічною ділянкою мембрани необхідний для функціонування геному, проте, як й істинні мезосоми, нуклеїдосоми виявляються не в усіх бактерій і не завжди, тобто їх наявність у клітині не обов’язкова.
Існують різні точки зору щодо ролі мезосом у прокаріотичній клітині. Деякі автори вважають, що вони не є обов’язковими структурами прокаріот, а служать лише для підсилення певних функцій клітини, збільшуючи загальну “робочу” поверхню мембрани. Є також дані, що з мезосомами пов’язане підсилення енергетичного метаболізму клітин. Вважається, що ці структури відіграють певну роль у реплікації хромосоми та її розходженні між дочірніми клітинами. Встановлено, що мезосоми деяких грампозитивих бактерій беруть участь у секреторних процесах. Висловлюється також думка, що мезосоми не беруть активної участі в процесах клітинного метаболізму, а виконують структурну функцію, забезпечуючи компартменталізацію прокаріотичної клітини, тобто просторове розмежування внутрішньоклітинного вмісту на відносно відокремлені ділянки, що створює більш сприятливі умови для перебігу певних ланок ферментативних реакцій. Таким чином, одночасне існування різних гіпотез відносно ролі мезосом у прокаріотичній клітині свідчить про те, що їхні функції продовжують залишатися не з’ясованими. Добре розвинута система внутрішньоцитоплазматичних мембран, яка морфологічно відрізняється від мезосомальних, описана в представників трьох груп грамнегативних хемотрофних бактерій (азотфіксуючих, нітрифікуючих, метанокиснюючих), для яких встановлена висока активність дихання, а також здатність метаболізувати розчинні в рідкому середовищі газоподібні сполуки. Хроматофори. Для деяких груп мікроорганізмів характерна наявність мембранних систем, які є похідними ЦПМ і просторово зв’язані з нею, хоча такий зв’язок не завжди виявляється. На внутрішньоклітинних мембранних системах, які визначаються як хроматофори, локалізовані процеси фотосинтезу в пурпурових бактерій. У Rhodospirillum, Thiocystis, Chromatium і багатьох інших пурпурових бактерій мембранні структури хроматофора мають вигляд трубочок і пухирців діаметром 20-100 нм. Трубочки та пухирці утворюють у клітині складну мембранну сітку і в численних ділянках зберігають зв’язок з ЦПМ. На репліках із сколів таких мембран на внутрішній поверхні виявляються частинки діаметром 7 і 10 нм. У деяких пурпурових бактерій (наприклад, Thiocapsa pfennigii) хроматофор утворений системою трубочок, розташованих паралельними або розгалуженими рядами. Хроматофори Rhodopseudomonas gelatinosa і R. tenue являють собою подвоєні мембранні пластинки, котрі є виростами ЦПМ. Такі подвоєні мембрани називають тилакоїдами. В клітинах деяких пурпурних бактерій тилакоїди зібрані в стоси. Стоси дисковидних тилакоїдів виявляються в клітинах деяких видів Rhodopseudomonas і Ectothiorhodospira. Пурпурові бактерії, які брунькуються (наприклад, Rhodomicrobium, Rhodopseudomonas viridis), мають хроматофори у вигляді пластинок, розташованих паралельно клітинній стінці. Такий хроматофор складається інколи з декількох тилакоїдів, на полюсі клітини він має отвір, через який у бруньки може переходити ДНК після поділу нуклеоїду. При брунькуванні тилакоїди залишаються в материнській клітині, а в бруньках вони утворюються заново.
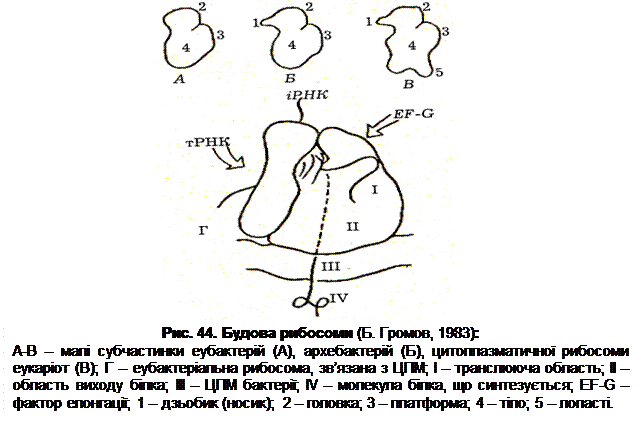
На відміну від хлоропластів рослин, хроматофори бактерій можуть зникати й утворюватися заново. Це явище спостерігається в бактерій, здатних до гетеротрофного розвитку в темряві. При цьому хроматофори в темряві зникають і знову з’являються при вирощуванні бактерій на світлі. Розвиток системи внутрішньоклітинних мембран властивий метанокиснюючим бактеріям. У них виявляється два типи таких мембран. Мембрани типу I складаються із стосів щільно упакованих везикулярних дисків, розташованих по всій цитоплазмі. Такий тип структур виявлено в Methylomonas, Methylobacter, Methylococcus. Ці структури утворюються за рахунок інвагінації ЦПМ на одному з полюсів, хоча точка контакту внутрішньоклітинних структур і цитоплазматичної мембрани може бути дещо зміщена від полюса клітини. Мембрани типу II характерні для Methylosinus, Methylocystis, Methylobacterium – це спарені мембранні шари, розташовані по периферії цитоплазми. Функціональна роль внутрішньоклітинних мембранних систем метилотрофів до кінця не вивчена, але є думка, що завдяки їхній наявності збільшується локальна концентрація субстратів (метану й кисню) метанмонооксигенази, відбувається просторове зближення всіх компонентів, які беруть участь в окисненні метану. Бактеріальні рибосоми служать місцем синтезу білка. Це округлі рибонуклепротеїнові частинки розміром 16-18 нм, розташовані в цитоплазмі. В рибосомах міститься 80-85% усієї бактеріальної РНК. Рибосома складається з двох субчастинок: у бактерій – це субчастинки 30S та 50S, які утворюють рибосому 70S типу, тобто рибосому, яка при ультрацентрифугуванні осідає зі швидкістю біля 70 одиниць Сведберга (S), їх називають 70S-рибосомами. Бактеріальна клітина має приблизно від 5 000 до 90 000 рибосом, що визначається інтенсивністю синтезу білка. Еукаріоти мають рибосоми 80S типу. 30S субчастинка має одну молекулу 16S РНК і, в більшості випадків, по одній молекулі білка 21 виду. Білкові молекули позначаються S1-S21 відповідно до їх положення в поліакріламідному гелі при хроматографії. 50S-субодиниця складається з двох молекул РНК (23S і 5S) і по одній копії білків 34 видів – L1-L34. Більшість рибосомальних білків знаходяться в одній копії і виконують структурну функцію. Будова рибосоми еубактерій, архебактерій та еукаріот у загальних рисах подібна (рис. 44). Разом з тим мають місце і деякі відмінності: рибосоми архебактерій і еукаріот мають дзьобик (носик), відсутній в еубактеріальних рибосом; рибосома еукаріот відрізняється від бактеріальної наявністю лопастей. Таким чином, бактеріальна клітина містить у цитоплазмі всі необхідні структури, які забезпечують її життєдіяльність. Запасні речовини знаходяться в осмотично інертній формі, але якщо умови змінюються і стають сприятливими для росту, то вони включаються в метаболічні процеси (табл. 8). За консистенцією ці речовини можна поділити на рідкі (наприклад, полі-b-гідроксимасляна кислота – ПОМК), напіврідкі (сірка) та тверді (глікоген).
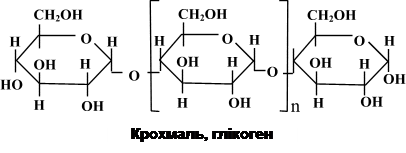
Для мікроорганізмів, як і для організмів тварин, вуглеводи не є основним будівельним матеріалом. Це характерно лише для рослин, котрі є джерелом вуглеводів для всіх інших живих істот. Мікроорганізмам властиве накопичення деяких вуглеводів як запасних поживних речовин. До таких речовин належать глікоген, який називають тваринним крохмалем, бо він утворюється в організмі людини і тварин і використовується як запасний енергетичний матеріал. Запасні полісахариди бактерій (глікоген) – це глюкани, котрі на відміну від полісахаридів клітинної стінки утворюються з a-D-глюкози. Скелет молекули має глюкозидні зв’язки a(1-4)-типу та зв’язки в точках галуження a-(1-6)-типу. Галуження відходять у середньому через кожних 12 залишків глюкози в основному ланцюзі. При реакції з розчином Люголя полісахариди утворюють червоно-фіолетове (або коричневе) забарвлення. Молекулярна маса глікогену може досягати 1 000 000. Глікоген, або тваринний крохмаль, має риси подібності з амілопектином, але його ланцюги мають більше галуження. Він виявляється в клітинах дріжджів і деяких бацил (B. polymyxa), багатьох представників родини Enterobacteriaceae (Escherichia, Salmonella), у Sarcina, Arthrobacter.
Таблиця 8 Запасні речовини прокаріот
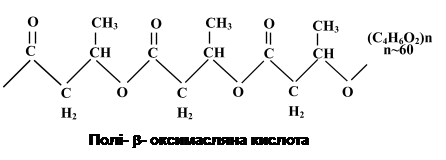
При мікроскопії глікоген має вигляд округлих електронно-щільних гранул діаметром до 200 нм. Гранули можна розчинити шляхом обробки гарячим KOH. Завдяки a–глюкозидним зв’язкам поліглюкозні ланцюги не витягнуті в довжину, а закручені гвинтоподібно. Накопичення полісахаридних гранул стимулюється дефіцитом азоту при надлишку джерела вуглецю й енергії в середовищі. При культивуванні бактерій в оптимальних умовах глікоген накопичується при переході культури у фазу стаціонарного розвитку. У клітинах деяких бактерій вміст полісахаридів може досягати 25% їхньої маси. Жироподібні речовини. Гранули крапель жиру дуже часто зустрічаються в клітинах мікроорганізмів у формі полі-b-оксимасляної кислоти (ПОМК) – поліефіру b-оксимасляної кислоти, в якій окремі мономери з’єднані складним ефірним зв’язком за рахунок карбоксильної та гідроксильної груп сусідніх молекул b-оксимасляної кислоти.
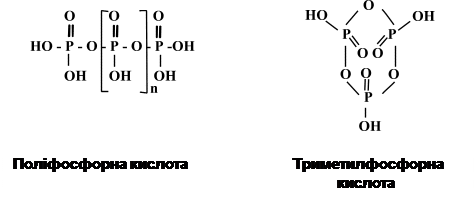
ПОМК, як запасна речовина, виявляється в клітинах Azotobacter, Rhizobium, Bacillus, фототрофних бактерій і практично не зустрічається в облігатних анаеробних хемотрофів. У деяких бактерій, які окиснюють вуглеводні, полі-b-оксимасляна кислота становить до 70% сухої речовини клітин. Накопичення ліпідів у клітині відбувається в умовах, коли середовище багате на джерело вуглецю і бідне на азот. ПОМК в клітинах має вигляд округлих, інколи довгастих гранул розміром 200-800 нм. У клітинах їхній вміст може досягати 80% від сухої маси. Для їх виявлення використовують ліпофільні барвники – судан 3 (гранули забарвлюються в червоний колір), судан чорний (гранули ПОМК мають чорний колір). Такі суданофільні гранули розчиняються у хлороформі, спиртах, піримідині, диоксані, толуолі, 1 М NaOH, камфорі і практично нерозчинні у воді, ефірі, метиловому й етиловому спиртах, ацетоні. Гранули ПОМК оточені білковою мембраною, товщина якої коливається від 2,2 до 8,0 нм. З мембраною зв’язані ферменти синтезу і розпаду цієї запасної речовини. У клітинах деяких бактерій, наприклад у B. cereus, представників роду Azotobacter, посилення синтезу ПОМК спостерігається при внесенні в середовище глюкози, а у Micrococcus halodenitrificans – у присутності гліцерину, пірувату або ацетату. Важливим фактором, який стимулює синтез ПОМК, є лімітування екзогенного джерела азоту. Якщо клітини, які містять гранули ПОМК, помістити в середовище без джерела вуглецю й енергії, то вони починають енергійно використовувати ПОМК. Еукаріотичні організми не мають ферментів синтезу чи розпаду ПОМК, тому бактерії, які накопичують у своїх клітинах цю речовину, небажано використовувати для виробництва харчових чи кормових добавок. У клітинах мікобактерій, нокардій і актиноміцетів у вакуолях можуть накопичуватися інші жироподібні речовини, здатні навіть виділятися у середовище. Так, у клітинах мікобактерій до 40% сухої маси становлять воски (складні ефіри вищих жирних кислот і спиртів). Ліпіди служать для клітини хорошим джерелом вуглецю та енергії. Поліфосфати. Багато бактерій і зелені водорості виявляють здатність запасати фосфорну кислоту у вигляді гранул поліфосфату. Вперше вони були виявлені в клітинах Spirillum volutans, тому їх називають волютиновими гранулами. Іншу свою назву – метахроматичні гранули – вони дістали через те, що поліфосфати викликають у деяких барвників (метиленовий синій, толуїдиновий синій) характерні зміни кольору – метахромазію. Волютин фарбується основними барвниками, наприклад нейтральним червоним, толуїдиновим синім, метиленовим синім. Два останніх барвники дають метахроматичне забарвлення, при якому включення зафарбовуються у фіолетово-червоний колір. Фарбування волютину краще проводити при низьких значеннях pH, оскільки вони зберігають забарвлення в кислому середовищі, це є основним показником належності включень до волютинових.
В основі метахроматичного забарвлення лежить взаємодія полікатіонів, якими є основні барвники, з поліаніонами, тобто з поліфосфатами, що викликає поглинання барвниками хвиль більшої довжини. Суть цієї реакції полягає в полімеризації барвника на макромолекулах поліаніона. Зерна поліфосфатів розчиняються в гарячій воді і слабких лугах. Вони нерозчинні в спиртах, ефірі та хлороформі. У значних кількостях волютин накопичується в клітинах деяких корінеформних бактерій. У клітинах Corynebacterium diphtheriae ці включення називають тільцями або зернами Бабеша-Ернста (на честь вчених, які вперше звернули на них увагу). Волютин утворює гранули діаметром до 1 мкм, які складаються переважно з поліфосфатів, але в препаратах гранул виявляється також РНК, ДНК, білок. Вважається, що волютинові гранули виконують функцію депо фосфатів, за рахунок яких клітина може ділитися при дефіциті фосфору в середовищі. В деяких випадках відмічається залежність накопичення і розкладу волютину від стадій клітинного циклу бактеріальної популяції. Так, при вивченні синхронних культур Corynebacterium diphtheriae було встановлено, що волютин накопичується в клітинах перед їх поділом і витрачається в процесі останнього. Особливо енергійно волютин синтезується при перенесенні бактерій із середовища, лімітованого за фосфором, у середовище, багате на фосфати. Поліфосфати використовуються клітинами як джерело фосфору. Питання, чи можуть вони служити джерелом енергії в прокаріот, залишається дискусійним. Специфічною запасною речовиною ціанобактерій є ціанофіцинові гранули. Хімічний аналіз показав, що вони складаються з поліпептиду, який містить аргінін і аспарагінову кислоту в еквімолярних кількостях. Скелет молекули побудований із залишків аспарагінової кислоти, з’єднаних пептидними зв’язками, а до її b-карбоксильної групи приєднані залишки аргініну. Для початку синтезу ціанофіцину необхідні молекули АТФ, іони K+ і Mg2+. Поява ціанофіцинових гранул при культивуванні ціанобактерій у середовищі з азотом та їх зникнення при його виснаженні свідчить про те, що вони служать резервом азоту, який мобілізується при його дефіциті в середовищі. Бактерії, метаболізм яких пов’язаний зі сполуками сірки, здатні відкладати у своїх клітинах молекули сірки. Сірка накопичується, коли у середовищі є сірководень, і окиснюється до сульфату, якщо весь сірководень вичерпується. Для аеробних тіонових бактерій, які окиснюють H2S, сірка служить джерелом енергії, а для анаеробних фотосинтетичних – донором електронів. Газові вакуолі – це структури, які оточені мембраною й утворені скупченням газових пухирців (везикул). Вони виявляються тільки в прокаріотичних клітинах. Газовий пухирець має форму циліндра завдовжки 200-1000 нм і діаметром біля 75 нм. Білкова оболонка, яка оточує вакуоль, має товщину до 2 нм, вона побудована з білкових субодиниць із молекулярною масою 14 000. Гідрофобні амінокислоти оболонки повернуті всередину вакуолі, а гідрофільні – на зовнішній бік. Така упаковка амінокислот оболонки перешкоджає проникненню води всередину газової вакуолі. Склад повітря, яке визначається у вакуолях, відповідає його складу в навколишньому середовищі. При мікроскопії у світлому полі газові вакуолі мають вигляд оптично- порожнього простору, яке сильно заломлює світло. При електронній мікроскопії вони мають вигляд порожнистих циліндрів з конічними кінцями, розташованими паралельними рядами. Утворення газових вакуолей (аеросом) характерне для багатьох водних бактерій, особливо фототрофних, але ряд безбарвних бактерій (Pelonema, Peloploca), галобактерії (Halobacterium halobium) і деякі представники роду Clostridium також містять газові вакуолі. Вони надають клітині здатності змінювати свою середню щільність і залишатися в завислому стані, через що деякі бактерії можуть у стратифікованих озерах утримуватися в шарі води з оптимальними умовами для їх розвитку. Аноксигенні фототрофні бактерії, зокрема пурпурові (Lamprocystis, Amoebobacter, Thiodictyon) і зелені (Pelodictyon), ростуть у водоймах в анаеробній зоні (в гіполімніоні). Вважається, що плавучість цих організмів є достатньою для того, щоб вони могли перебувати в суспендованому стані в холодному (більш важкому) шарі води гіполімніону, але не забезпечує підйомної сили, котра дозволяла б їм триматися в теплому (більш легкому) шарі води. Оксигенні ціанобактерії (Oscillatoria agardhii, Aphanizomenon flos-aquae, Microcystis aeruginosa) розташовуються у більш теплих шарах води. Існує думка, що плавучість цих бактерій регулюється за допомогою фотосинтезу, тургору клітин, а також зміни кількості і розміру газових пухирців. Параспоральні тіла. В клітинах Bacillus thuringiensis і родинних видів (B. laterosporus, B. medusa) виявляються особливі кристалоподібні включення – параспоральні тільця (рис. 45). За хімічною природою це білок, дуже токсичний для кровосисних комарів. Такі бактерії знайшли своє практичне застосування як засіб біологічної боротьби не тільки з кровосисними комарами, а й з личинками метеликів.
Магнетосоми виявляються в клітинах бактерій, здатних до магнетотаксису, тобто здатних рухатися вздовж силових ліній магнітного поля. Вони являють собою оточені мембраною частинки Fe3O4. У клітинах Aquaspirillum magnetotacticum, наприклад, магнетосоми мають форму куба зі сторонами 40-50 нм і розташовані в ряд уздовж клітини. Форма, кількість і характер розташування цих структур у різних груп мікроорганізмів різні.
Локомоторні органи бактерій Рухомість бактеріальної клітини може забезпечуватися різними способами. Найхарактернішими є плаваючий і ковзний типи руху. Локомоторним органом бактерій з плаваючим типомруху є джгутик. Джгутикові форми зустрічаються серед усіх відомих груп бактерій. Це свідчить про те, що джгутики є дуже давніми утворами бактеріальної клітини. Розрізняють кілька типів розташування джгутиків на поверхні мікробної клітини (рис. 46): - монотрихальний тип джгутикування, при якому один джгутик розташований на одному з полюсів клітини (Vibrio comma, Pseudomonas aeruginosa, Neurospora europea, Thiobacillus ferrooxidans) або один джгутик локалізований субтермінально (Rhizobium lupini);
- на одному з полюсів клітини може бути пучок джгутиків – лофотрихи. Такий тип джгутикування характерний для Pseudomonas fluorescens, P. putida, Chromatium okeanii та представників роду Sphaerotillus (субполярне розташування пучка джгутиків); - в амфітрихів пучки джгутиків виявляються на обох полюсах мікробної клітини (біполярні політрихи) – Spirillum; - джгутики можуть локалізуватися по всій поверхні клітини – перитрихальний тип джгутикування. Він властивий, наприклад, представникам родів Proteus, Escherichia, Salmonella.
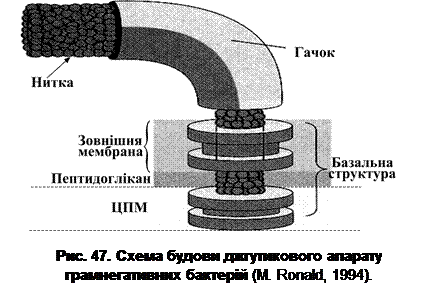
Кількість джгутиків та характер їх розташування може бути однією з диференційних ознак. Однак слід пам’ятати, що ця ознака визначається умовами культивування, а також те, що в процесі виготовлення препаратів, джгутики можуть обламуватися. Для виявлення джгутиків бактерій використовують спеціальні методи, зокрема, метод фазового контрасту або темного поля (Bdellovibrio, Chromatium оkenii, Pseudomonas, Spirillum). Хороші результати дає електронна мікроскопія. При мікроскопії у світлому полі застосовують спеціальні методи фарбування, які передбачають потовщення нитки джгутикового апарату. У прокаріот розрізняють два типи джгутиків – прості і складні. Товщина простого джгутика коливається в межах 12-18 нм, довжина – 3-15 мкм. Складні джгутики покриті додатковим чохлом білкової природи. Білок чохла з молекулярною масою 55 000 відрізняється як від білків оболонки клітини, так і від білків самого джгутика. Товщина складного джгутика становить ~18 нм. Цей тип джгутиків зустрічається в деяких представників роду Pseudomonas (P. rhodos), Rhizobium (R. lupini). Швидкість обертання джгутика відносно велика. Джгутики спірил, наприклад, обертаються зі швидкістю 40-60 об./сек (~3 000 об./хв). Швидкість руху клітини за допомогою джгутика в різних груп мікроорганізмів різна, і її неможливо пов’язувати з кількістю джгутиків. Наприклад, клітини B. megaterium, які мають перитрихальний тип джгутикування, рухаються зі швидкістю ~27 мкм/сек., а Vibrio comma (монотрихи) – ~200 мкм/сек. Швидкість руху клітини за допомогою джгутиків становить від 300 до 3 000 довжин тіла за хвилину (900-9 000 мкм/хв) при довжині тіла клітини ~3 мкм. Якщо уявити, що людина зростом 1,5 м рухалася б із такою швидкістю, то вона становила б 27-270 км/год. Апарат джгутика складається з нитки, гачка і базальної структури (рис. 47). За хімічною природою нитка джгутика це білок флагелін з молекулярною масою 25 000-60 000. Вивчено білкові субодиниці (мономери) джгутика. Встановлено, що вони зібрані в спіральні ланцюги, закручені навколо порожнинної серцевини. Особливістю будови білка флагеліну джгутика є відсутність у його складі гістидину, проліну, тирозину, триптофану, цистеїну. Білок джгутика виявляє антигенну специфічність. Його називають Н-антигеном, який широко використовується при ідентифікації бактерій. Білок гачка дещо відрізняється від білка нитки джгутика як за молекулярною масою, так і за антигенною специфічністю. Він стійкіший до низьких значень pH, нагрівання, дії сечовини.
Базальна структура джгутика складається з центрального стрижня (палички-осі), вмонтованого у систему кілець. У грамнегативних бактерій ця структура має дві пари кілець: внутрішню (M i S) та зовнішню (P i L); у грампозитивних – лише одну пару кілець (M i S). Внутрішня пара кілець локалізована на рівні ЦПМ. При цьому М-кільце ніби занурене в цитоплазматичну мембрану. Кільце S локалізоване дещо вище, воно майже прилягає до внутрішньої поверхні пептидоглікану. L-кільце розташоване на рівні шару ЛПС зовнішньої мембрани клітинної стінки грамнегативних бактерій, а Р – на рівні муреїнового шару. Довжина базальної структури коливається в межах 25-30 нм і визначається товщиною клітинної стінки. Зв’язок кілець з паличкою-віссю відносно слабкий, про що свідчать електронні мікрофотографії, на яких деякі кільця відсутні. Головна функція базальної структури полягає у фіксації (закріпленні) джгутика. А оскільки ця структура складна, кожен її елемент має своє призначення. Виходячи з того, що кільця L і P виявляються лише в структурі джгутика грамнегативних бактерій, можна вважати, що вони служать для додаткової фіксації джгутика і що для функціонування джгутикового апарату досить лише внутрішньої пари, тобто кілець S i M. Найбільш детально рух джгутиків вивчений у бактерій з лофо- і амфітрихальним типом джгутикування. У більшості лофотрихів джгутики (подібно до корабельного гвинта) проштовхують клітину через середовище. У бактерій з перитрихальним джгутикуванням окремі латерально розташовані джгутики функціонують, як вважається, ніби оди
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 933; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.165.234 (0.021 с.) |


 ; фосфатидилгліцерин
; фосфатидилгліцерин  (ФГ):
(ФГ):  та дифосфатидилгліцерин (кардіоліпін – КЛ):
та дифосфатидилгліцерин (кардіоліпін – КЛ): 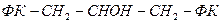 .
.