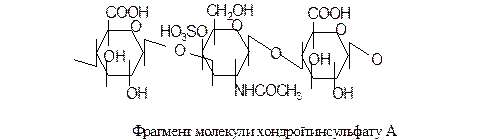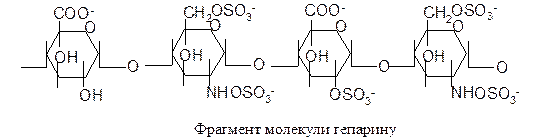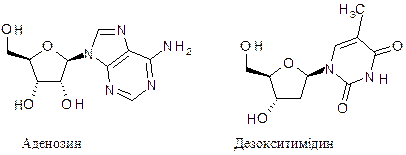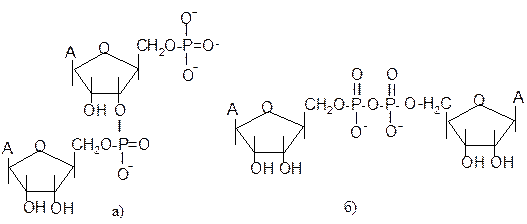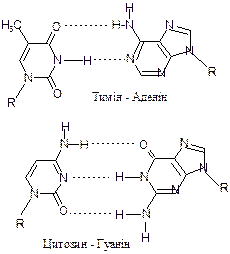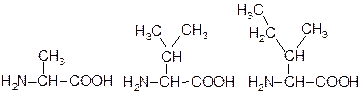Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурні з'єднуючі полісахаридиСодержание книги
Поиск на нашем сайте
За хімічною природою полісахариди цієї групи відрізняються від інших великим вмістом амінопохідних та кислотних груп. Їх стара назва – кислі мукополісахариди, сучасна – глікозаміноглікани. Як правило, ці полісахариди утворюють комплекси з білками – протеоглікани, в яких частка полісахариду в комплексі складає більше 95%. Глікозаміноглікани тварин у складі протеогліканів є міжклітинним цементуючим комплексом, зокрема у хрящовій і кістковій тканинах, у рослин заповнюють прошарок між волокнами целюлози у клітинній стінці. Завдяки наявності груп, негативно йонізованих за фізіологічних значень рН, а також сильно гідратованому стану, вони забезпечують в’язкість, мастильні властивості рідин організму, йонізацію поверхні мембран, її проникність. Гіалуронова кислота входить до складу основної міжклітинної речовини тваринних тканин. В її молекулі повторюються дисахаридні фрагменти, утворені D-глюкуроновою кислотою і N-ацетил-D-глюкозаміном, з’єднаними b(1®3)-зв’язком. Між фрагментами з’єднання відбувається за допомогою b(1®4)-зв’язку:
Інший компонент міжклітинної речовини – хондроїтинсульфат – побудований за таким самим принципом, але замість глюкозаміну містить залишок галактозамін-4-(або-6-) сульфату:
Вважають, що протеогліканові агрегати в хрящовій тканині складаються з центральної великої молекули (Мr 270-500 кД) гіалуронової кислоти (1), до якої приєднуються протеогліканові субодиниці, що складаються з центрального білкового ланцюга (2), сполученого з чисельними короткими ланцюгами типу хондроїтинсульфату (Мr 40 – 50 кД) (3):
Гепарин синтезується клітинами печінки, легень і секретується в кров, де відіграє роль антикоагулянта. Його молекула (Мr 20 кД) складається із залишків D-уронової кислоти і D-глюкозаміну, що сполучаються зв’язками a(1®4) і сульфатовані здебільшого по аміногрупі і 6 положенню глюкозаміну і 2 положенню уронової кислоти:
Невеликі гетеросахаридні фрагменти (від 1 до 30% маси молекули) входять до складу гліколіпідів та глікопротеїнів клітинних мембран. Більшість позаклітинних білків також містять вуглеводні компоненти Специфічні олігосахаридні групи глікопротеїдів на поверхні клітин вибірково зв’язуються з певними білками лектинами, що приводить до їх злипання (аглютинації). Ця взаємодія визначає сумісність груп крові, тканин донора і реципієнта при трансплантації, імунну реакцію на чужерідні молекули.
НУКЛЕЇНОВІ КИСЛОТИ Нуклеїнові кислоти – це біополімери, які виконують найважливіші біологічні функції – збереження спадкової інформації та її реалізації протягом життя клітини. У більшості організмів функцію збереження спадкової інформації виконує ДНК (дезоксирибонуклеїнова кислота). При поділі клітин дочірні клітини одержують точну копію спадкової інформації. Різні види РНК (рибонуклеїнових кислот) забезпечують реалізацію спадкової інформації в клітині протягом її існування шляхом участі в синтезі специфічних білків, закодованих в структурі ДНК. За хімічною будовою нуклеїнові кислоти є полінуклеотидами, а за хімічним складом характеризуються постійним вмістом фосфору (8 – 10%) і нітрогену (15 – 16% за масою). Мононуклеотиди Мононуклеотиди складаються з трьох компонентів: залишків азотистої основи, пентози та ортофосфорної кислоти. Це найбільш складно побудовані мономери з тих, що утворюють біомолекули. До складу нуклеїнових кислот входять азотисті основи двох типів – пуринові і піримідинові. Нуклеотиди, які не утворюють полімерів, наприклад деякі коферменти, містять інші нітрогеновмісні гетероцикли, що проявляють основні властивості (наприклад, нікотинамід). Азотисті основи є похідними гетероциклів пурину і піримідину. До складу нуклеїнових кислот входять пуринові основи аденін і гуанін і піримідинові – тимін, цитозин, урацил:
Крім них є основи, які рідко зустрічаються, і тому названі мінорними, наприклад:
Вони виконують специфічні функції в нуклеїнових кислотах. Азотистим основам властива кето-енольна таутомерія. В складі нуклеотидів вони знаходяться в кетоформі і лише в ній можуть утворювати характерні водневі зв’язки, стабілізуючі полімер, а піримідинові основи і зв’язки з пентозою. Сполука, утворена азотистою основою і залишком пентози – рибози або дезоксирибози, називається нуклеозидом. Це b-глікозид, в якому пуринова основа утворює зв’язок по атому азоту N9, а піримідинова – N1, наприклад:
В залишках пентози атоми карбону позначають номером із штрихом, наприклад, 3/, щоби не плутати нумерацію атомів в пентозі і основі. Мононуклеотиди є фосфатними естерами нуклеозидів – нуклеозидмоно-, ди- або трифосфатами:
Назви нуклеозидів і нуклеотидів наведені в таблиці 4.1. Таблиця 4.1. Номенклатура нуклеозидів і 5/-рибонуклеотидів
Теоритично фосфатні естери можуть утворюватись за будь-якою з вільних гідроксильних груп залишку пентози. В організмі переважно містяться 5/-нуклеозидфосфати. Нуклеозидфосфати, крім того, що утворюють полінуклеотиди, виконують важливі самостійні біологічні функції. Нуклеозидтрифосфати служать вихідними активними формами, що використовуються в біосинтезі полінуклеотидів. Нуклеозидтрифосфат АТФ відіграє центральну роль в енергообміні клітин. Енергоносіями і активаторами в різних біологічних процесах є і інші нуклеозидтрифосфати ҐТФ (біосинтез білка), ЦТФ (біосинтез фосфоліпідів), УТФ (біосинтез полісахаридів і гліколіпідів. Нуклеозиддифосфати також можуть використовуватись в енергозабезпеченні організму. Циклічні нуклеозидмонофосфати – 3/,5/-цАМФ і 3/,5/-цГМФ є регуляторами обмінних процесів, посередниками дії в клітині певних гормонів, які не проникають в неї через мембрану, наприклад адреналіну. Слід зауважити, що при рН, близькому до нейтрального, фосфорильні залишки нуклеотидів дисоційовані і несуть негативний заряд, що надає особливих властивостей молекулам. При конденсації двох мононуклеотидів утворюється динуклеотид, причому реалізуються два типи сполучення: а) фосфодиефірний зв’язок, б) пірофосфатний зв’язок:
Динуклеотид, утворений за допомогою фосфодиефірного зв’язку, можна продовжити (наростити) з обох боків з утворенням полінуклеотидного ланцюга. Оскільки напрямок нарощування ланцюга має при біосинтезі велике значення, кінцевий нуклеотидний залишок, що містить фосфат в 5/-положенні називають 5/-кінцем молекули, а залишок нуклеотиду, який має вільний гідроксил в 3-му положенні пентози – 3/-кінцем молекули. Приєднання наступного мононуклеотиду до 3/-кінця молекули означає нарощування ланцюга в напрямку 5/®3/. В такому напрямку нарощуються полінуклеотидні ланцюги в живих системах. До динуклеотидів, побудованих за допомогою пірофосфатного зв’язку, належать, наприклад, коферменти НАД+, НАДФ+, ФАД. ДНК Перший дослідник нуклеїнових кислот, швейцарський лікар Фрідріх Мішер виділив у 1868 році з ядер гною так званий нуклеїн - комплекс нуклеїнових кислот та білків. Відокремити нуклеїнові кислоти тваринних клітин від білків вдалося вперше Р. Альтману, а рослинних клітин – А. М. Білозерському. Р. Альтман також довів, що нуклеїн має кислі властивості і запропонував у 1889 р. назву - нуклеїнові кислоти. На початку XX ст. вже був відомий нуклеотидний склад нуклеїнових кислот та спосіб об'єднання мононуклеотидів між собою. Однак уявлення про просторову структуру нуклеїнових кислот та їх роль в збереженні та реалізації спадкової інформації живих організмів сформувались лише порівняно недавно, в 50-ті роки. До цього вважалось, що загадка спадковості пов'язана з білками, і варто вивчити структуру білків, як молекулярні основи спадковості стануть зрозумілими. Але сталося так, що хімічна природа спадкового матеріалу була доведена ще раніше, ніж з’ясували просторову структуру білків. Вирішальним в доведенні спадкової функції нуклеїнових кислот був дослід А. Херші і М. Чейз, які за допомогою радіоактивної кишкової палички (Escherichia coli) в клітину попадає саме нуклеїнова кислота віруса, а не його білок. В переважній більшості організмів функцію збереження спадкової інформації відіграє ДНК. Вміст ДНК в різних клітинах організму однаковий і лише в статевих клітинах - вдвічі менший. В клітинах ссавців міститься 6-7×10-12 г ДНК, бактерій–0,01×10-12. В клітині ДНК зосереджена в ядрі, а також міститься у незначній кількості в мітохондріях і хлоропластах. До складу ДНК входять азотисті основи аденін, гуанін, тимін, цитозин і пентоза дезоксирибоза. В 1950 році Ервін Чаргафф із співробітниками встановили кількісні співвідношення, які носять назву правил Чаргаффа: 1. Кількість пуринових основ в ДНК дорівнює кількості піримідинових основ (А+Г=Т+Ц). 2. Кількість аденіну в ДНК дорівнює кількості тиміну (A=Т). 3. Кількість гуаніну в ДНК дорівнює кількості цитозину (Г=Ц). До цих правил можна додати ще одне співвідношення, встановлене А.М.Білозерським: кількісне співвідношення (Г+Ц)/(А+Т) є постійним для певного виду організмів, а отже, може служити видовою характеристикою. Для тварин це співвідношення становить 1,3 – 1,5, рослин – 1,1 – 1,7, і найбільший діапазон має для бактерій: від 0,35 до 2,7. Структура ДНК Молекули ДНК дуже великі, навіть в порівнянні з іншими біополімерами. Так ДНК з клітини людини містить близько трьох трильйонів азотистих основ. Тому їх структуру доцільно зображати за допомогою поняття про рівні укладки. Первинна структура ДНК - це послідовність мононуклеотидних залишків у полінуклеотидному ланцюгу. Полінуклеотид можна зобразити схематично, позначивши азотисті основи першими буквами їх українських або міжнародних назв, пентози – прямою лінією, а 3/-5/-фосфодиестерні зв’язки – косими лініями з буквою Ф (Р) посередині:
5/-кінець 3/-кінець. Цій схемі відповідає короткий запис: фАфЦфГфЦфТ (pApCpGpCpT), або А×Ц×Г×Ц Т (AUCGCT). Розшифровка первинної структури молекули ДНК вперше була здійснена Ф. Сенгером (1977 р.), який за цю роботу одержав свою другу Нобелевську премію. Зараз первинну структуру ДНК визначають за допомогою прилада секвенатора, який автоматично розшифровує біля одного млн нуклеотидів за добу. Одним із прикладів практичного застосування знань про первинну структуру ДНК є реконструкція ходу еволюції на підставі порівняння нуклеотидних послідовностей ДНК різних видів. В первинній структурі ДНК відкриті ділянки паліндроми, тобто послідовності, які однаково читаються в прямому і оберненому напрямі. Відомими прикладами паліндромів у мові є “А роза упала на лапу Азора”, “Аргентина манит негра”,“Madam, in Eden I’m Adam”. Паліндроми мають внутрішню вісь симетрії відносно якої можуть утворюватись комплементарні (див. нижче) вирости – “шпильки”, які виконують регуляторну роль. Вторинна структура ДНК була розшифрована на основі рентгеноструктурного аналізу і співставлення його результатів з кількісними співвідношеннями, виведеними Е. Чаргаффом. Застосування рентгеноструктурного аналізу, успішне для білка, у випадку ДНК ускладнилось тим, що довгий час не вдавалось виділити її кристали. В результаті довготривалої копіткої праці М. Уілкінса, Р. Франклін та інш. була одержана велика кількість рентгенівських знімків, які фіксували взаємне розташування частинок в різних ділянках ДНК. Найбільш вдала рентгенограма Р. Франклін (Рис. 4.1.) демонструє хрестоподібне розташування рефлексів, що вказує на спіральну структуру. Затемнені зони відповідають основам, які ідуть одна за іншою.Аналіз цих знімків був блискуче виконаний Джоном Уотсоном і Френсісом Кріком. В результаті в 1953 р. була сформульована гіпотеза про подвійну спіраль. Вона добре узгоджувалась з фактичними даними і пояснювала функції ДНК. Запропоновану структуру з деякими виправленнями приймають і зараз, а Ф. Крік, Дж. Уотсон і М. Уілкінс одержали в 1962 р. Нобелівську премію за встановлення молекулярної структури ДНК і її ролі в передачі генетичної інформації. Вторинна структура ДНК представляє собою подвійну спіраль, утворену двома антипаралельними полінуклеотидними ланцюгами. Цю структуру часто порівнюють з гвинтовими сходами, в яких “сходинки” утворені азотистими основами, оберненими назустріч одна іншій всередину, а “обіччя” - це залишки пентози і фосфату, що чергуються (Рис. 4.2.) Напроти аденіну завжди розташовується тимін, а напроти гуаніну - цитозин, що узгоджується з правилами Чаргаффа. Така строга просторова відповідність азотистих основ називається комплементарністю. Обидва ланцюги молекули, в цілому, комплементарні, тобто доповнюють один одного. Завдяки комплементарності всі "сходинки" спіралі мають однакову ширину – її діаметр становить 2,0 нм.. Спіраль стабілізується водневими зв'язками між комплементарними основами: двома між аденіном і тиміном і трьома між гуаніном і цитозином:
Між площинами ароматичних кілец існують також гідрофобні, так звані “стекінг” - взаємодії, завдяки яким пари основ утримуються як стовпчик монет. Спіраль правозакручена, плектономічна, тобто ланцюги не можна роз'єднати, не розкрутивши спіраль. Відомі розміри спіралі: відстань між парами азотистих основ складає 0,34 нм, а на один оберт спіралі, висота якого 3,4 нм, припадає 10 нуклеотидних пар Зараз відомо декілька форм спіралі, які, ймовірно, відповідають різним функціональним станам ДНК. Так, описана вище В-форма, як вважають, сприятлива для подвоєння ДНК. Більш компактна форма А (з розташуванням основ під нахилом і 11 парами основ на виток) ймовірно утворюється при біосинтезі РНК, а більш розтягнена форма С типова для інертного хроматину. Форми А і С правоcпіральні. Відома також лівоспіральна зигзагоподібна форма Z, яка може виконувати роль регуляторного сигналу. Відкриття Уотсона і Кріка привело до створення нової природничої науки - молекулярної біології, яка розкриває молекулярні механізми біологічних функцій і робить можливим практичне втручання в ці процеси. Термін "молекулярна біологія” ввів у 1940 р. У. Астбюрі, який вперше висунув припущення про тримірну структуру ДНК. Третинна структура ДНК. Розрахунки показують, що подвійна спіраль ДНК з ядра однієї клітини людини займає відстань 1,8 м. Зрозуміло, що в ядрі діаметром 5 мк вона повинна бути укладена дуже компактно у третинну структуру. Така структура у еукаріот утворюється за участю молекул білків. В результаті формується нуклеопротеїд хроматин. Укладка досягається шляхом суперспіралізації і здійснюється в три етапи: Перший, нуклеосомний підрівень нагадує буси, де кожна бусинка - це нуклеосома, яка формується накручуванням подвійної спіралі ззовні, як нитки на котушку, на октамери (поєднання вісьми молекул) білків гістонів. Кожна нуклеосома має діаметр 10 - 11 нм і містить до 160 нуклеотидних пар. 85% ДНК знаходиться в складі нуклеосом. Між “бусинками” – нуклеосомами розташовуються ділянки з'єднуючої “нитки” –лінкерна ДНК, що містять 20 – 120 нуклеотидних пар. Посередині цієї ділянки розташована ще одна маленька “бусинка” - молекула гістону (Рис. 4.3.). Упаковочний коефіцієнт для нуклеосом становить 5-7. Другий підрівень, супербідний, утворюється завдяки утворенню супервитків діаметром до 30-35 нм. Це своєрідний соленоїд, на один виток якого припадає 6-8 нуклеосом. Ця структура стабілізується за рахунок розташованого вздовж осі фібрили гістонового стрижня. Третій підрівень, – це петлева структура. Соленоїдні структури випетлюються від білкового стрижня хромосоми. В результаті цього лінійні розміри ДНК зменшуються ще у 180 разів.. Таким чином, сама ДНК має біспіральну організацію і досягає висококомпактного стану суперспіралі при взаємодії з білками і утворюючи разом з ними хроматин, в якому на білок припадає близько 60 %, ДНК – 35 %, РНК – 5 % за масою. Властивості ДНК Молекулярна маса ДНК довгий час не була адекватно визначена, так як при виділенні її довгі молекули зазнавали гідродинамічного розриву. Молярна маса 1000 нуклеотидних пар (типовий розмір гену) становить 660 тис д. Молярна маса ДНК із самої великої хромосоми плодової мушки становить 40 млр: д., а людини приблизно в чотири рази більша Для ДНК властиве світлопоглинання за рахунок гетероциклів в ультрафіолетовій частині спектру з максимумом біля 260 нм. Зовнішня поверхня молекули ДНК при рН > 4 несе негативний заряд, завдяки якому утворює комплекси з катіонами металів. Приблизно на 100 нуклеотидних пар припадає один катіон, переважно Mg2+. Також ДНК взаємодіє з поліамінами, які несуть позитивний заряд – високомолекулярними білками гістонами і низькомолекулярними, наприклад спермідином: H2N-(CH2)3-NH-CH2)4-NH2. Утворена таким чином оболонка виконує роль екрану, який захищає ДНК від дії оточення. Незважаючи на це, тисячі різних речовин та фізичні фактори можуть змінювати ДНК. Молекули антибіотиків та інших біологічно активних речовин можуть втручатись між ланками спіралі, деформуючи її. Радіоактивне випромінювання та радикали, які виникають в клітині, можуть уражати азотисті основи, приводячи до їх окиснення та інших модифікацій. В результаті цього порушується комплементарність ланцюгів, що, в свою чергу, може привести до зміни генетичної інформації – мутації. Наприклад, залишки тиміну, що розташовуються поруч у ланцюгу, під дією ультрафіолетового випромінювання легко утворюють тимінові димери:
Такі зміни можуть призвести до злоякісного перетворення клітин шкіри при тривалому перебуванні під сонячним промінням. Прикладом хімічного мутагену можуть бути нітрити, які у надлишковій кількості попадають в організм при неправильному харчуванні. Вони викликають дезамінування азотистих основ за схемою: R-NH2+HNO2®R-OH+N2+H2O Енольна форма дезамінованої основи перетворюється в кетонну і, в результаті, цитозин замінюється на урацил, аденін - на гіпоксантин, а гуанін – на ксантин. Створені міжнародні та національні регістри речовин, які викликають зміни в структурі ДНК. Вони нараховують більше 10 тис. різноманітних речовин, багато з яких є антропогенними забруднювачами. Зв’язки, які стабілізують вторинну структуру ДНК, є досить слабкими. Їх руйнування приводить до втрати просторової структури молекули – її денатурації. Як правило, денатурацію або плавлення ДНК викликають нагріванням. ДНК плавиться в діапазоні температур 850 - 950. Чим більше в молекулі пар Г-Ц, тим вище температура плавлення, так як зв’язки в них більш чисельні, ніж в парах А-Т. Критеріями денатурації є збільшення світлопоглинання при 260 нм (гіперхромний ефект), зменшення правого обертання, зменшення в’язкості і збільшення густини ДНК. Повна денатурація молекули ДНК приводить до розходження комплементарних ланцюгів. При швидкому охолодженні розчину денатурованої ДНК ланюги залишаються у відокремленому стані. Але, якщо протягом якогось часу підтримувати температуру дещо нижчою, ніж значення температури плавлення, то нативна структура можу відтворитися. На цій властивісті грунтується метод дослідження гомологічності нуклеїнових кислот з різних джерел шляхом гібридизації. Він застосовується як в науковому дослідження ДНК з різних організмів, так і в криміналістиці. В дослідах по гібридизації ДНК з двох різних джерел молекули нуклеїнової кислоти з одного джерела розщеплюють (наприклад, з допомогою ультразвуку) на фрагменти довжиною близько 1000 нуклеотидів і піддають денатурації. Денатуровану ДНК з іншого джерела наносять на певний носій, наприклад агаровий гель. Фрагменти денатурованої ДНК змішують з фіксованими ланцюгами ДНК. При цьому фрагменти ДНК, які мають високий ступінь комплементарності, гібридизуються з ланцюгом ДНК і затримуються на носії, тоді як фрагменти, які не мають комплементарних ділянок в цьому ланцюгу, вільно залишають носій. Ступінь гомології виражають кількісно. На його підставі можна, зокрема довести належність певного біологічного матеріалу конкретній людині, або її близьким родичам. РНК Відомо декілька типів РНК, кожний з яких виконує певні функції в реалізації спадкової інформації. На відміну від ДНК, до складу РНК входить замість тиміну азотиста основа урацил, та пентоза рибоза. В РНК досить високий вміст мінорних азотистих основ Молекулярна маса сильно відрізняється для різних типів РНК, а вміст залежить від функціонального стану клітини. РНК - одноланцюгова молекула. Основні типи РНК: матрична (інформаційна) - мРНК, транспортна - тРНК, рибосомна - рРНК, ядерна, вірусна. Матрична РНК або РНК-посередник (мессенджер) - синтезується в ядрі як копія, комплементарна певній ділянці ланцюга ДНК, і виходить з ядра в цитоплазму, де в рибосомах служить матрицею, тобто інформацією для синтезу певного білка. Зрозуміло, що залежно від того, який білок зашифрований в структурі мРНК, їх довжина і хімічний склад сильно змінюються. Їх молекулярна маса становить від 25 тис. до 1 млн д. Кількість копій з певної ділянки ДНК не є постійною і залежить від потреб клітини, тому вміст мРНК в клітині також коливається і становить менше 5% від загального вмісту РНК. мРНК має специфічну нуклеотидну послідовність. Змістовна частина, тобто інформація про закодований білок, займає центральну частину ланцюга. На кінцях молекули містяться незмістовні, але функціонально важливі ділянки, які зокрема забезпечують узнавання молекули рибосомою, захищають її від ферментативного гідролізу під час перенесення з ядра до рибосоми. Наприклад, на 5/-кінці молекули міститься так званий “кеп” (шапочка), в якому 7-метилгуаніловий нуклеозид, не фосфорильований по 5/ положенню з’єднаний із ланцюгом через три фосфатних залишки, а наступний за ним нуклеотидний залишок метильований за 2/-положенням дезоксирибози: 5/ 7-метилГ ффф 2/-метилХ-, де Х – будь-яка азотиста основа. В загальному первинну структуру мРНК можна представити так: 5/КЕП - 30-100 нуклеотидів (неінформативний фрагмент) – АУГ - інформативний фрагмент - УГА (УАА) - 100-1000 нуклеотидів - полі А (50 – 400 нуклеотидів) (неінформативний фрагмент) 3/. Значну частину клітинної РНК (80% за масою) складає рРНК. Вона поділяється на три групи, які відрізняються за молекулярною масою. Для рибосом еукаріотів вона становить відповідно 35 тис, 550 тис і 1 млн д. рРНК є структурною основою рибосом і виконує в них різноманітні функції, зокрема, забезпечує просторову взаємодію молекул, які беруть участь в біосинтезі білка. тРНК зв’язує амінокислоти в цитоплазмі і переносить їх в рибосоми, де вибірково включає в синтезований білок. Для кожної із 20 амінокислот є хоча б один вид тРНК. На тРНК припадає 10 – 20% від загального вмісту РНК. Кожен вид тРНК має індивідуальні особливості структури, проте в їх будові можна виділити спільні закономірності. Молекула тРНК нараховує в середньому 75 - 90 нуклеотидних залишків, на 5/ кінці містить фосфорильований гуаніловий нуклеотид, а на З/ кінці - послідовність фЦфЦфА-ОН. Отже, загальну структуру тРНК можна зобразити так: 5/ фГ - 75 – 90 нуклеотидів - фЦфЦфА-OH 3/. Молекулярна маса тРНК- 30 тис д. Для тРНК характерний досить високий вміст мінорних основ (до 10% від загального вмісту). Поряд з цим, в їх первинній структурі окремі ділянки є комплементарними. Тому ланцюг тРНК складається у вторинну структуру, яка за формою нагадує листок конюшини (рис. 4.4.). Комплементарні ділянки в цій структурі “злипаються”, а некомплементарні, на яких багато мінорних основ, утворюють петлі або “шпильки”. Активована амінокислота зв’язується з 3/ - кінцем тРНК. Ділянка узнавання матричної РНК, антикодон тРНК, комплементарний кодону мРНК, міститься в антикодоновій петлі. Для цієї петлі також характерна наявність специфічних мінорних основ. Інша петля – псевдоуридилова – містить тимін і нуклеотид, в якому залишок урацилу з’єднаний з рибозою по 5-му атому С (Y). Ця петля забезпечує зв’язування з рибосомою Крім того в молекулі є дигідроуридилова петля, що містить 5,6-дигідроурацил, і зумовлює зв’язування тРНК в цитоплазмі з ферментом аміноацил-тРНК-синтетазою під час взаємодії з амінокислотою. Вторинна структура тРНК скручується в більш компактну третинну структуру (рис. 4.5.) Ядерна РНК міститься в ядрі і бере участь в регуляції синтезу мРНК. Деякі віруси містять РНК в якості спадкового матеріалу (РНК-ові віруси). До них належать віруси грипу, СНІДу, тютюнової мозаїки (ВТМ), онкогенні. Структура РНК піддається розшифровці легше, ніж ДНК, так як молекули її значно коротші і існують у клітині в більшій кількості. Першими були розшифровані повні первинні структури тРНК для аланіна (Р. Холлі та інш., 1965р.) і валіна (О. О. Баєв та інш., 1967р.).
БІЛКИ Найважливішими біомолекулами є білки. В 1838 р. голландський вчений Мюльдер відобразив їх значення в назві “протеїни” (від грецького "протос" – первинний). На білки припадає не менше 50 % сухої маси клітини. За хімічною будовою білки – це біополімери, які складаються із залишків амінокислот, з’єднаних пептидними зв’язками. Для хімічного складу білків характерний постійний середній вміст нітрогену - біля 16%. Білки виконують важливі біологічні функції: а) каталітичну - найсуттєвішу, так як переважна більшість перетворень в організмі здійснюється тільки під впливом каталізаторів – ферментів, які є білками; б) структурну - білки у тварин утворюють рогові покриви, є основою сполучення між клітинами (на структурний білок сполучної тканини колаген припадає третина всіх білків організму за масою); в) рухову (скорочувальні білки у всіх живих організмів побудовані і функціонують за спільним принципом, наприклад, актин і міозин у м’язовому волокні); г) транспортну - переносять гази (гемоглобін, міоглобін), залишки жирних кислот (альбумін крові), здійснюють активний транспорт багатьох речовин через мембрану; д) регуляторну - швидкість біохімічних перетворень регулюють зокрема гормони гіпофізу, підшлункової залози, які є білками або похідними амінокислот, нейроолігопептиди забезпечують в головному мозку складні психічні і фізіологічні явища (пептид страху, пам’яті тощо), білки є регуляторами зчитування спадкової інформації з ДНК, рецепторами мембран, які забезпечують трансформацію і передачу в клітину інформації (гормонального сигналу); е) захисну - антитіла, які виробляються у відповідь на появу чужорідних молекул, зв’язують і знешкоджують їх - білки, серед них - інтерферон – єдиний відомий білок, який знешкоджує чужорідну нуклеїнову кислоту; токсини, наприклад бутулізму є захисними молекулами для організму, який їх виділяє; є) енергетичну - при повному окисненні 1 г білка виділяється біля 17 кДж енергії, проте білки не відкладаються про запас, а при їх розщепленні вивільняється токсичний продукт – аміак, на детоксикацію якого витрачається енергія. Половина з амінокислот, які утворюють білки, в організмі людини не синтезується і повинна поступати з їжею, тому використання білків в енергетиці є для організму вимушеним, пов’язаним із незбалансованим вмістом в їжі амінокислот, необхідних для побудови білків. Таким чином, білки забезпечують більшість життєвих проявів. Найпростішим живим організмом, який здатний реалізувати свою спадкову інформацію, є вірус – комплекс нуклеїнової кислоти і білка (вірус біологи жартома називають кепською новиною у білковому конверті). Амінокислоти До складу білків входять a-амінокислоти, тобто такі, в яких аміногрупа розташована біля другого атома С. Між аміно- і карбоксильною групами знаходиться тільки один a-С атом. В процесах обміну речовин утворюються і інші види амінокислот. Наприклад, g-аміномасляна кислота (ГАМК) - є медіатором центральної нервової системи. Відомо 20 a-амінокислот, які генетично кодуються, і декілька їх похідних, що утворюються шляхом ферментативної модифікації. Загальну формулу a-амінокислоти можна зобразити так:
де R- вуглеводневий радикал. Радикал може бути аліфатичний або циклічний, містити різні функціональні групи. Одна із двадцяти a-амінокислот (пролін) є не аміно-, а імінокислотою, тому що її атом азоту входить до складу циклу. Амінокислоти можна класифікувати за різними ознаками. Для вивчення білків зручний поділ за полярністю радикалів на неполярні, полярні незаряджені та полярні заряджені (позитивно або негативно) (Табл. 5.1.) Подані тривіальні назви амінокислот є найбільш вживаними. В схемах амінокислоти та їх залишки позначаються скорочено першими трьома буквами назви. Таблиця 5.1. Класифікація амінокислот за полярністю радикалу* Неполярний радикал
Аланін (Aла, Ala, A) Валін (Вал, Val, V) Ізолейцин (Ілей, Ile, I)
Лейцин (Лей, Leu, L) Метіонін (Мет, Met, M) Пролін (Про, Pro, P)
Фенілаланін (Фен, Phe, P) Триптофан (Три, Trp, W) Полярний незаряджений радикал
Гліцин (Глі, Gly, G) Серин (Сер, Ser, S) Цистеїн (Цис, Cys, C)
Треонін Аспарагін Глутамін Тирозин (Тре, Thr, T) (Асн, Asn, N) (Глн, Gln, Q) (Тир, Tyr, Y) Полярний заряджений радикал
Аспарагінова кислота (Aсп, Asp, D) Глутамінова кислота (Глу, Glu, E)
Лізин (Ліз, Lys, K) Аргінін (Арг, Arg, R) Гістидин (Гіс, His, H) * - в дужках подаються скорочені українська і англійська назви і міжнародний символ Кожна амінокислота, крім гліцину, містить один чи більше асиметричних атомів карбону, тобто проявляє оптичну активність. За абсолютною конфігурацією амінокислоти в організмах належать до L-ряду. Лише у складі пептидів деяких мікроорганізмів зустрічаються D-амінокислоти, наприклад в токсині бутулізму. Амінокислоти - слабкі електроліти. Вони містять групи як кислотного, так і основного характеру, тобто є біполярними йонами. Їх заряд залежить від кількості цих груп і рН середовища: рН<7 рН»7 рН>7
катіон біполярний йон аніон Сумарнй заряд певної амінокислоти при певному значенні рН обчислюють за константами дисоціації (рК) всіх її функціональних груп. Значення рН, при якому сумарний заряд амінокислоти рівний 0, називається її ізоелектричною точкою (рІ). Для 0,1 М розчинів аланіну рІ становить 6,02, для глутамінової кислоти - 3,22; лізину - 9,74. Кислотно-основні властивості амінокислот зумовлюють їх буферну здатність при рН близькому до рК їх функціональних груп. У складі білків з усіх амінокислот найбільше значення мають буферні властивості гістидину, оскільки лише його радикал має значення рК близьке до рН міжклітинної рідини та крові (≈7,4). Білок еритроцитів гемоглобін має великий вміст гістидину, що дуже важливо для його функції. Амінокислоти проявляють спільні хімічні властивості, пов’язані з наявністю карбоксильної та аміногруп, а також індивідуальні, зумовлені функціональними групами радикалу. Останні використовуються для ідентифікації окремих амінокислот. Наприклад, взаємодія з азотною кислотою, характерна для похідних бензолу, використовується для визначення фенілаланіну (ксантопротеїнова реакція), а взаємодія сульфідів з йонами свинцю - для визначення цистеїну (реакція Фоля). Для a-аміногрупи амінокислот характерна чутлива реакція з нінгідриновим реактивом: При нагріванні a-амінокислот з надлишком нінгідринового реактиву утворюється розчинний продукт лілового кольору. Імінокислота пролін дає з нінгідрином продукт жовтого кольору. Індивідуальні амінокислоти визначають за продуктами взаємодії їх a-аміногруп із 2,4-динітрофторбензолом (ДНФБ, реактивом Сенгера) у слаболужному середовищі. Утворені ДНФ-похідні ідентифікують хроматографічно. Пептидний зв'язок. Пептиди Амінокислоти здатні до конденсації при взаємодії карбоксильної групи однієї амінокислоти та аміногрупи - іншої:
Утворена сполука називається пептидом, а зв'язок - пептидним. При сполученні двох амінокислот утворюється дипептид, трьох - трипептид, а багатьох - поліпептид. Пептидний зв'язок міцний, він піддається гідролізу тільки при тривалому кип'ятінні в кислому або лужному середовищі. В пептиді виділяють N-кінець, на якому знаходиться вільна аміногрупа, та С-кінець, на якому міститься незаміщена карбоксильна група. Називаючи пептид, назвам всіх амінокислот, крім С-кінцевої, дають суфікс -ил або -іл, а назву останньої не змінюють, наприклад, гліцил-аланін, серил-тирозил-аргінін. Пептидний зв'язок має специфічну просторову форму. Неподілена пара електронів азоту взаємодіє з p-електронами карбонільної групи, утворюючи делокалізовану систему електронів, розподілену між атомами О, С і N. Тому зв'язок С-О слабший, ніж подвійний, а зв'язок С-N міцніший, ніж одинарний. Навколо зв'язку С-N неможливе вільне обертання груп, оскільки він не одинарний. В одній площині знаходяться атоми С, N, О, Н і a-вуглецеві атоми. Причому атоми О і N знаходяться в транс -положенні. Вільно обертатися можуть лише радикали навколо a-вуглецевих атомів. Така будова пептидного зв’язку обмежує можливості просторових конформацій пептидів.
Наявність пептидного зв'язку визначають біуретовою реакцією, характерною для амідів, зокрема, для біурету: Першим біуретову реакцію пептидів вивчав О. Я. Данилевський. Суть її полягає у взаємодії пептидноі групи з йонами міді (II) в лужному середовищі з утворенням розчинного комплексу фіолетового кольору. Ця реакція дуже чутлива і використовується як для якісного, так і для кількісного визначення пептидів. Відомо багато пептидів, які виконують важливі біологічні функції. Наприклад, глутатіон (g-глутаміл-цистеїніл-гліцин, g-глу-цис-глі, GSH). Цей пептид, на відміну від білків, містить g-амінокислотний залишок. Він викликає величезний інтерес біологів і медиків, оскільки є найбільш поширеною низькомолекулярною речовиною в клітині, виконує біля ста функцій в життєдіяльності майже всіх істот. Він бере участь в захисті клітин від токсичних хімічних речовин, продуктів радіоактивного розпаду, впливає на активність багатьох ферментів і стан субклітинних структур. Переважно його дія пов'язана із взаємоперетворенням двох форм - окисненої і відновленої:2GSH ®GSSG + 2H Пепт
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 889; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.110.182 (0.012 с.) |