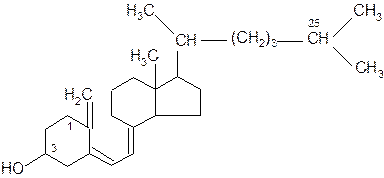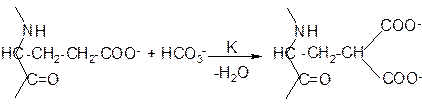Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Класифікація і номенклатура ферментів. Практичне використання ферментівСодержание книги
Поиск на нашем сайте
Для найбільш досліджених і поширених ферментів часто використовують тривіальні назви, які походять від назви субстрату, або типу реакції і мають суфікс – “аза”: амілаза, протеаза, дегідрогеназа та інші. Загальноприйнятими є назви найбільш відомих ферментів, пов’язані з їх відкриттям. Наприклад, пепсин походить від грецького “травлення”, трипсин - “розріджує”, папаїн - від назви дерева, з соку якого він був виділений. Систематичні назви ферментів походять від назви субстрату (субстратів) та від характеру перетворення (гексокіназа, тріозофосфатізомераза). Однак, кожний субстрат може підлягати різним перетворенням, а для одного типу реакцій відомо декілька альтернативних каталітичних систем. Тому при першій згадці про фермент в тексті належить дати йому повну наукову назву. Сучасна наукова номенклатура ферментів грунтується на їх класифікації за характером перетворення. Ця класифікація, затверджена Комісією з ферментів Міжнародного біохімічного союзу (1961), поділяє ферменти на 6 класів за типом реакцій, які, в свою чергу, - на підкласи за характером субстрату, підкласи – на підпідкласи, які відрізняються коферментами або акцепторами груп (див. Додаток). І. Оксидоредуктази - окисно-відновні реакції (див. Част. ІІ. Процеси біологічного окиснення.) ІІ. Трансферази – реакції перенесення функціональних груп ІІІ. Гідролази – реакції гідролізу. IV. Ліази – реакції по місцю подвійного зв’язку без участі води. V. Ізомерази – реакції ізомеризації. VI. Лігази – реакції синтезу біополімерів з активованих попередників. Кожному ферменту відповідає назва, яка складається з хімічної назви субстрату і назви реакції. Якщо в реакції відбувається перенесення функціональної групи з однієї речовини на іншу, то вказується акцептор групи. Після назви ферменту в дужках подається його чотиризначний шифр згідно класифікації, де перша цифра відповідає класу, друга - підкласу, третя - підпідкласу і четверта - порядковому номеру ферменту в своєму підпідкласі. Наприклад, фермент, який здійснює перенесення залишку фосфорної кислоти від АТФ на гексозу, має систематичну назву - АТФ:гексоза-б-фосфотрансфераза (К.Ф. 2.7.1.1.). Шифр показує, що цей фермент належить до класу трансфераз, підкласу фосфотрансфераз, підпідкласу фосфотрансфераз, які використовують як акцептор гідроксильну групу, і має в своєму підпідкласі порядковий номер - 1. Його тривіальна назва -гексокіназа.
Практичне використання ферментів Ферментативний каталіз не має аналогів в неживій природі. Його унікальними рисами є висока специфічність та інтенсивність дії, безвідходність в поєднанні з м’якими умовами. Часто ферменти об’єднуються в надмолекулярні ансамблі, які узгоджено здійснить багатоетапне перетворення певної речовини. Діяльність ферментів дуже чутлива до змін умов процесу, тобто регулюється ними. Ці риси стають особливо привабливими в час, коли цивілізоване людство шукає нові технології одержання речовин і енергії, які б не загрожували екологічною, кризою. Важливим завданням, яке потрібно вирішити на шляху впровадження ферментативних процесів у промисловість, є створення оптимальних умов для їх дії. Ферменти зберігають свої якості лише у зв’язку з іншими компонентами біосистеми. Тому великий успіх мають розробки методів іммобілізації ферментів, тобто фіксації їх на водонерозчинних носіях. Носіями ферментів можуть бути кульки з пористого скла, найлонові трубочки, тонкі плівки, капсули або гранули з полімерних гелей. Іммобілізовані ферменти мають ряд переваг: вони легко відокремлюються від реакційного середовища, дозволяють вести процес неперервно і регулювати його швидкість, мають активність в тисячі, навіть, міліони разів вищу, ніж незв’язані молекули, мало чутливі до дії денатуруючих агентів. Іммобілізовані ферменти - основа одного з головних напрямків сучасної біотехнології. їх використовують при виробництві ряду антибіотиків, оптично активних сполук (амінокислот та інших). Одночасно розвиваються методи використання каталізаторів у складі мікроорганізмів, їх клітини можна розглядати як живі лабораторії, що містять необхідні ферменти. Крім промислових синтезів ферменти продовжують використовувати в традиційних галузях хлібопечіння, пивоваріння, виноробства. Тут необхідні ферменти розщеплення вуглеводів. В галузях, які займаються обробкою білкової сировини (шкіри, хутра, м’яса і молока), потрібні ферменти, які використовуються для прискорення розщеплення білків. В побутовій хімії набуло поширення використання ферментних добавок до миючих засобів.
В медицині використання ферментів пов’язане як з лікуванням, так і з діагностикою захворювань. Їх використовують при лікуванні хвороб травного тракту, для розчинення тромбів та видалення гною з ран, нормалізації обміну речовин, пригнічення пухлин. Використання ферментів у діагностиці ґрунтується на тому, що вони мають тканеву специфічність. Різні тканини одного і того ж організму відрізняються як за складом ферментів, так і за фізико-хімічними характеристиками ферменту, який виконує одну певну функцію, що зумовлено генетично або умовами синтезу в певній клітині. Множинні форми одного і того ж ферменту (ізоферменти) відомі не менш як для половини вивчених ферментів. Під час хворобливого процесу в клітині відбувається посилене руйнування специфічних ферментів і вимивання їх в русло крові. Тому біохімічний аналіз крові дозволяє провести діагностику захворювання. Наприклад, при зростанні в крові вмісту амілази, є підозра на захворювання підшлункової залози. Поява в крові трансамідінази свідчить про захворювання нирок. Діагностика інфаркту міокарду проводиться по зміні ізоферментного складу лактатдегідрогенази і т.д. Таким чином, розвиток вчення про ферменти є яскравим прикладом того, що фундаментальна наука рано чи пізно знаходить різноманітне застосування в житті суспільства. Вітаміни. Коферменти Під назвою “Вітаміни” об’єднують різноманітні за будовою і властивостями органічні речовини, які в невеликій кількості абсолютно необхідні для життєдіяльності. Назву "вітаміни", тобто “аміни життя”, запропонував у 1912 p. К. Функ, який вперше виділив вітамін В1 і довів, що він містить аміногрупу. Вітаміни належать до тих речовин, які не можуть утворюватись в самому організмі з інших, тобто є незамінними факторами харчування. З давніх часів люди помітили залежність свого здоров’я і працездатності від характеру харчування. Вимога вживати сирі рослинні продукти, урізноманітнювати раціон, значною мірою визначається саме тим, що необхідно забезпечувати себе вітамінами. Настої глиці, кори дерев врятовували життя мореплавцям, які внаслідок довготривалого одноманітого харчування захворювали на цингу. Вперше науково довів потребу у певних факторах харчування М. І.Лунін, який в 1880 p. повідомив результати досліджень двох груп мишей. Першу групу тварин він годував аналогом молока, який включав жир, білок казеїн, молочний цукор, другу - незбираним молоком. Через деякий час тварини першої групи загинули, а другої – нормально розвивались. Розрізняють три види порушень забезпечення організму вітамінами. При недостатньому вмісті вітамінів в їжі розвивається гіповітаміноз. Це найбільш поширена аномалія не лише для мешканців відсталих регіонів. Спостереження за різними групами населення в цивілізованих країнах показує, що і в їх раціоні кількість вітамінів в 2-4 рази менше потреби. Відсутність в їжі вітамінів викликає авітаміноз. Відомі випадки надмірного вживання вітамінів, які спричинюють гіпервітамінози. Крім неправильного харчування в економічно розвинених країнах причини авітамінозів все більше пов’язують з порушенням їх всмоктування у травному тракті. У зв’язку з видовими особливостями обміну речовин перелік вітамінів відмінний для різних видів. Наприклад, аскорбінова кислота є вітаміном для приматів і морських свинок. У всіх інших досліджених видів вона синтезується в організмі. Для людини відомо принаймні 13 вітамінів.
Серед незамінних факторів харчування вітаміни вирізняються тим, що вони не включаються в структуру тканин і не використовуються організмом як джерело енергії. Переважна більшість вітамінів входить до складу коферментів і бере безпосередню участь в каталізі реакцій в організмі. Назви вітамінам даються за їх хімічною природою (ретинол, цианокобаламін), умовні за допомогою букв латинського алфавіту (А, В12) та за назвами відповідних авітомінозів (антиксерофтальмічний, антианемічний). За фізичними властивостями вітаміни поділяють на жиро- і водорозчинні. Представники кожної з цих груп мають певні спільні ознаки. Жиророзчинні вітаміни За хімічною будовою жиророзчинні вітаміни А, Д, Е, К є похідними ізопрену і складаються з циклічної частини та довгого розгалуженого вуглеводневого радикалу, який служить “якірною ділянкою” при закріпленні молекули в неполярному шарі біомембрани. Жиророзчинні вітаміни всмоктуються з кишечнику в кров разом з ліпідами їжі і, можливо, внаслідок розчинності в ліпідах запасаються в печінці. Одноразове введення жиророзчинних вітамінів може забезпечити ними організм на декілька тижнів і місяців. Вітамін А (ретинол) є одноатомним спиртом, який складається з 20 атомів вуглецю. В організмі він перетворюється на альдегід ретиналь:
Повністю транс- ретиналь За положенням замісників по місцю подвійного зв’язку С11 вітамін А може бути в повністю транс- (див. зображення) і в цис- формі. Вітамін А виконує дві біологічні функції: фоторецепторну і соматичну. Фоторецепторна функція його вивчена досить добре. В сітківці ока є два види світлочутливих клітин - колбочки і палички. Перші дозволяють розрізняти різні відтінки кольорів, а другі - розпізнають лише світло і темряву, але дуже чутливо. Саме вони забезпечують зір в сутінках завдяки функціонуванню протеїду родопсину. Він складається з білкової частини – опсину та простетичної групи – ретиналю. Механізм фоторецепторної функції ретиналю пов’язаний з цис-транс- ізомерією. У складі родопсину в темряві він міститься в цис -формі. Під дією світла відбувається перетворення цис -ретиналю в транс - і його відокремлення від білку опсину. Зміна конформації ретиналю приводить до збудження нервового імпульсу. В темряві молекула родопсину регенерується:
Механізм передачі сигналу, спричиненого розпадом молекули родопсину, в зоровий центр невідомий. Вважають, що родопсин є трансмембранним білком, зміна конформації якого під дією світла змінює проникність мембрани для Са2+ і стан самих мембран, що ініціює нервовий імпульс. Соматична функція вітаміну А полягає в його участі в підтриманні структурної цілісності організму. Він міститься в комплексах Гольджі, де синтезуються структури надмембранних шарів, зокрема хондроїтинсульфат. Вважають, що соматична функція вітаміну А також пов’язана з цис-транс -ізомерією. Одним з перших проявів гіповітамінозу А є куряча сліпота, тобто послаблення зору в сутінках, пов’язане з порушенням фоторецепторної функції. Більш небезпечним для організму є порушення соматичної функції. У молодих тварин при нестачі вітаміну А зупиняється ріст, відбувається заміна слизистого епітелію на кератинизуючий. Таке ураження епітеліальних клітин очей – ороговіння сітківки ока або ксерофтальмія - відбувається щорічно у десятків тисяч дітей віком 18-36 місяців переважно в тропічних країнах. Надлишок вітаміну А при надмірному вживанні не виводиться з організму. Гіпервітаміноз проявляється в розростанні кісток, дерматитах, тобто також пов’язаний з порушенням соматичної функції. Відомі випадки загибелі полярників, які з’їдали печінку білого ведмедя, багату на вітамін А. Вітаміну А багато у печінці риб, риб’ячому жирі. Червоном’якотнї рослини містять пігмент каротин, який ферментативно перетворюється на вітамін А в тваринному організмі, переважно в кишечнику. Мінімальна щоденна доза вітаміну А в харчуванні дорослої людини становить 660-750 мкг. Причому доза рослинних каротинів, як попередників вітаміну А повинна бути в 2 - 6 p. вищою. Основна маса вітаміну А у стані провітаміну поступає в організм саме з рослинною їжею (морква, перець, буряк, помідори, гарбуз, салат). Він є у вершковому маслі. Найбільше збагачений вітаміном А риб’ячий жир. При надмірному вживанні в печінці може накопичуватись річний його запас. Вітамін D (кальциферол) представлений групою подібних молекул, які в організмі утворюються на світлі з стеролів шкіри:
Холекальциферол (D3) Біологічну активність проявляє не сам вітамін D, а його окиснене похідне - кальцитріол, який утворюється в два етапи, перший з яких відбувається в печінці, а другий - в нирках: 7-дегідрохолестерол ↓hn, шкіра холекальциферол (D3) ↓ печінка 25-гідроксихолекальциферол (25(ОН)-D3) ↓ нирки 1, 25-дигідроксихолекальциферол (кальцитріол) (1, 25 (OH)2-D3) Кальцитріол традиційно розглядають серед вітамінів, але механізм його утворення та дії свідчить, що це гормон. Як і всі гормони, це біологічно активна речовина, яка утворюється в одній тканині, а діє в інших, причому як регулятор, а не структурний компонент ферменту. Кальцитріол регулює фосфорно-кальціевий обмін в організмі. Він посилює транспорт йонів Са2+ і фосфату в кишечнику і мобілізацію резерву Са2+ з кісток. У людей з штучною ниркою ці процеси значно послаблені. Механізм його дії подібний до механізму дії стероїдний гормонів. Він проникає в ядра клітин і стимулює транскрипцію генів, зокрема того, що кодує синтез кальцій-зв’язуючого білка. Інші генні продукти, які індукуються кальцитріолом, не ідентифіковані.
Найбільш відчутно гіповітаміноз D проявляється у дітей. У них виникає хвороба кісток, що ростуть, - рахіт. При ній не здійснюється остання стадія утворення кістки - відкладення мінеральних речовин на органічному матриксі. У дітей, хворих на рахіт, спостерігаються різні деформації скелету. У дорослих також при нестачі цього вітаміну спостерігається порушення мінералізації кісток – остеомаляція. В середніх широтах достатньо протягом 30 хвилин щоденно знаходитись на повітрі, щоб забезпечити потребу в ньому. У північних народів вітамін D забезпечується традиційно за рахунок харчування морською рибою. Новонароджені діти особливо чутливі до наявності вітаміну D в раціоні, або адекватного сонячного опромінення, оскільки вони не мають його запасу в організмі. Якщо протягом довгого часу вживати збільшену дозу вітаміну D (в 10 разів вище норми), відбувається збільшення вмісту Са2+ і фосфату в сироватці крові, кальцифікація м’яких тканин, розсмоктування кісткової тканини. У таких хворих спостерігаються множинні переломи кісток, утворення каменів у нирках. Рекомендована щоденна доза вітаміну D становить 20 мкг. Джерелом його крім ендогенного холестеролу на світлі служить риб’ячий жир, вершкове масло, молоко, печінка. Вітамін Е (токоферол - від грецького “tokos” - потомство) завдячує назві спостереженню, що відсутність його в їжі приводить до втрати здатності давати потомство. Найбільшу поширеність і біологічну активність серед токоферолів проявляє a-токоферол:
Різноманітні сполуки, які мають структуру подібну до токоферолу, серед них феноли і хінони, проявляють аналогічну дію. Встановлено, що цей вітамін пригнічує самоокиснення ненасичених жирних кислот, тобто проявляє антиоксидантну активність. При його нестачі в тканині відбувається перекисне окиснення ненасичених жирних кислот. Внаслідок цього порушується структура мембран мітохондрій, лізосом, інших органел, що приводить до таких зовнішніх проявів його недостатності як м’язова дистрофія, зниження дихання, загибель ембріонів, втрата рухливості сперматозоїдів, гемоліз еритроцитів. Вітамін Е потрапляє в організм з рослинними оліями, ліпідами зеленого листя (салат та ін.). Він є тим природним антиоксидантом, який захищає поліненасичені жирні кислоти олії від псування, гальмує руйнування вітаміну А. Дуже чутливі до нестачі вітаміну Е травоїдні тварини. Вони гинуть від дистрофії м’язів за декілька тижнів. У людини нестача токоферолу спостерігається при порушенні всмоктування ліпідів у травному тракті. В інших випадках потреба в ньому задовольняється різноманітними продуктами. Вітамін К (філохінон) за хімічною будовою є хіноном. Ряд речовин, які проявляють аналогічну активність, відрізняються довжиною вуглецевого ланцюга, або не мають його (менадіон):
Вітамін К1 Менадіон Цей вітамін необхідний для синтезу в печінці чотирьох проферментів системи зсідання крові:
При порушенні цього процесу спостерігається геморрагічний стан. Однак при нормальному всмоктуванні ліпідів в травному тракті додаткове введення цього вітаміну непотрібне, оскільки він утворюється мікрофлорою кишечнику. Ознаки авітамінозу К можуть бути у новонароджених дітей і тривають, доки в кишечнику ще немає бактерій. В медичній практиці застосовується препарат вікасол, який проявляє активність вітаміну К1 і, на відміну від нього, є водорозчинним. Він був синтезований у 1943 p. під керівництвом академіка О. В. Паладіна і успішно застосований у військових госпіталях як засіб боротьби з кровотечами.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 512; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.108.254 (0.014 с.) |