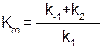Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Властивості ферментів. Ферментативна кінетикаСодержание книги
Поиск на нашем сайте
Специфічність дії ферментів Просторова відповідність субстрату і активного центру є обов’язковою умовою ферментативного каталізу. Деякі ферменти каталізують перетворення лише однієї певної речовини, тобто проявляють абсолютну специфічність. Наприклад, фермент уреаза каталізує розщеплення амідного зв’язку лише в сечовині -H2N-CO-NH2 - і не діє на амідні зв’язки в інших сполуках. Ферменти, які каталізують перетворення оптично активних речовин проявляють стереоспецифічність. Наприклад, a -глюкозидази каталізують розщеплення у вуглеводах лише a -глікозидних зв’язків, а b -глюкозидази діють лише на b -глікозидні зв’язки. Багато ферментів діє на певний хімічний зв’язок, або на певну хімічну послідовність в різних молекулах певного класу. Така специфічність називається груповою. Так, хімотрипсин, дія якого описана вище, діє на пептидні зв’язки в різних пептидах, але лише при умові, що карбонільна група зв’язку належить ароматичній амінокислоті. Фермент пепсин розщеплює пептидні зв’язки лише між двома гідрофобними амінокислотами, трипсин - пептидні зв’язки, карбонільна група яких належить аргініну або лізину. Амінопептидаза відщеплює останній з N-кінця амінокислотний залишок, а карбоксипептидаза – останній з С-кінця, діючи на різні білки. Активність ферментів і концентрація субстратів. Ферментативна кінетика Важливою характеристикою ферменту є активність. Її вимірюють за зміною концентрації субстрату або продукту каталізу за одиницю часу. За одиницю активності ферменту приймається така активність, при якій здійснюється перетворення 1 мкмоль речовини за 1 хвилину при 25°С в оптимальних умовах дії ферменту. Активність ферментів вимірюють при оптимальному рН і концентрації субстрату, близькій до насичуючої, тобто при умові, що концентрація ферменту є єдиним лімітуючим фактором реакції. Звичайно визначають питому активність, тобто активність ферменту в розрахунку на 1 мг білка. Більш наочним показником активності є число обертів ферменту, яке показує, скільки молекул субстрату перетворюється одним активним центром ферменту (або однією молекулою ферменту) за одиницю часу. Наприклад, карбоангідраза, яка каталізує реакцію гідратації вуглекислого газу в крові (СО2 + Н2О ® Н2СО3), перетворює 36 млн молекул вуглекислого газу за 1 хвилину. Без ферменту ця реакція відбувається дуже повільно. Карбоангідраза - один з найактивніших ферментів. Для ферментів, які розщеплюють полісахариди, число обертів становить: для b -амілази - 1 100 000 і для a-амілази - 12 500 на одну молекулу ферменту. Каталаза, яка розкладає пероксид водню, має число обертів 18 млн. При надлишку субстрату швидкість реакції залежить від каталітичної здатності самого ферменту, тобто від того, наскільки швидко фермент може перетворити одну молекулу субстрату і вивільнитись для перетворення іншої. Швидкість реакції в цих умовах є максимальною (Vmax). При менших концентраціях субстрату швидкість реакції (V0) зростає пропорційно збільшенню його концентрації. Кількісно залежність швидкості від концентрації субстрату і властивостей самого ферменту виражаться рівнянням:
де Кm - константа Міхаеліса – Ментен, яка характеризує співвідношення коефіцієнтів розпаду (k-1 і k2) та утворення (k1) фермент-субстратного комплексу:
Чисельно вона відповідає концентрації субстрату, при якій швидкість реакції дорівнює половині максимальної (рис 6.1.А.). Графічно значення Vmax і Km зручно обчислювати за рівнянням, оберненим до виразу V0 (метод подвійних обернених величин Лайнуївера – Берка) (рис. 6.1.Б.):
В умовах клітини концентрації субстратів можуть істотно коливатись впливати на швидкість реакцій. Вплив температури При оптимальних для життя температурах дуже мала кількість реагуючих молекул знаходиться в активованому стані. Тому і перетворення їх неферментативним шляхом в організмі практично не відбуваються. Якби температура живих істот могла збільшуватись на десятки градусів, кількість активних молекул, а отже і швидкість їх перетворення, зросли би так сильно, щоби не вистачило запасів кисню і їжі для забезпечення стабільного стану організму. Ферменти, як і всі білки, є термолабільними, їх активність у більшості ферментів найвища при температурах, близьких до 400 (рис. 6.2.). Зміна температури впливає на слабкі взаємодії, які підтримують специфічну просторову форму молекули ферменту і беруть участь у взаємодії із субстратом. Причому стабільність водневих і електростатичних взаємодій послаблюється при нагріванні, а гідрофобних - при охолодженні. Отже, вплив температури на кожний конкретний фермент залежить від того, які саме слабкі взаємодії зумовлюють його активність.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 447; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.246.53 (0.007 с.) |