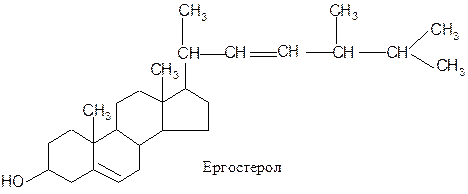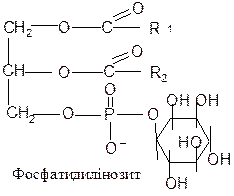Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: вступ. Хімічні особливості живого. Вода і її властивості в живих системахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Тема: Вступ. Хімічні особливості живого. Вода і її властивості в живих системах План 1. Біохімія як наука і навчальний предмет 2. Історія розвитку біохімії 3. Хімічні особливості живого Біологічна хімія - це наука, яка вивчає хімічний склад, будову та перетворення речовин в живих організмах. Живі істоти відрізняються від неживого за комплексом ознак:, до яких можна віднести здатність до розмноження, ріст, рух, подразливість, постійний обмін речовиною і енергією із зовнішнім середовищем. Біохімія вивчає живе на молекулярному рівні і може розглядатись як складова широкого фізико-хімічного напряму в біології, що використовує ідеї, методи і підходи хімії, фізики і математики для пояснення механізмів життєдіяльності. Плідність молекулярного підходу проявила себе у всіх галузях біології. Фізико-хімічні поняття і категорії є базовими в клітинній біології, імунології, мікробіології, фізіології, генетиці, екології. Великі успіхи, досягнуті у з’ясуванні фізико-хімічних основ життя, створюють враження, що життя може бути повністю пояснене на підставі властивостей складових частин, молекулярних процесів. Ця позиція має свою назву - "нічого крім" (nothing but ness). Сучасною біохімією навіть припускається, що «розум» і «особистість» - це вираз особливої хімічної структури і метаболізму мозку, тобто форми поведінки можна описати мовою хімії. Проте, не зважаючи на ефективність молекулярного підходу, він не є універсальним і не в стані осягнути всього багатства проявів і сутності життя, пояснити, чому на Землі з'явились саме ці організми, які нас оточують, чим визначається їх поведінка і стосунки. Принципи біохімічних процесів плідно застосовуються в промисловості, зокрема в біотехнології, для створення технологій високо ефективних і екологічно сумісних виробництв. Сучасна людина повинна володіти основами біохімічних знань для вироблення принципів раціонального способу життя - харчування, поводження серед величезної кількості чужорідних хімічних речовин, що оточують - препаратів побутової хімії, косметичних засобів, консервантів, ліків, забруднювачів середовища. 2. Історія розвитку біохімії В розвитку біохімії можна виділити чотири періоди. І. Передісторія (з давніх часів до ХV ст.) - накопичення практичного досвіду (технології хімічної обробки речовин біологічного походження, вивчення їх хімічних властивостей) та формування наукових понять здійснювались відокремлено.
П. Період бурхливого накопичення фактів і спроби застосування наукових надбань до вивчення живого (XV - початок XIX ст.). Досліджується елементний і речовинний склад живого. Перші складні вуглецеві речовини були відкриті як продукти життєдіяльності - карбонові кислоти, гліцерин, крохмаль, глікоген, амінокислоти, нуклеїнові кислоти (дослідження К. Шеєле, К. Бернара, К. С. Кірхгофа, М. Шевреля. А. Браконно, Ф. Мішера). Таким чином, було показано, що живі організми складаються з хімічних сполук, для яких справджуються спільні хімічні закони. Ш. Період становлення і розвитку (друга половина ХІХ - перша половина ХХ ст.). Біохімія виділилась у самостійну науку. У 1903 р. К. Нейберг ввів термін «біохімія». Вивчається структура біомолекул: білків (Е. Фішер, О. Я. Данилевський*), нуклеїнових кислот (А. Коссель, Альтман, О. М. Білозерський), вуглеводів (Е. Фішер), ліпідів, вітамінів (О. В. Палладін). Створено основні положення ферментативного каталізу (Е. Фішер, Е. Бухнер), теорії біологічного окиснення (О. М. Бах*, В. І. Палладін*), з’ясовано роль макроергічних сполук, зокрема АТФ в обміні речовин, м’язовому скороченні (В. О. Енгельгардт, А. Сент-Дьордьї, В. О. Беліцер) відкриті основні проміжні продукти та шляхи обміну речовин (Г. Кребс, М. В. Ненцький*, І. І. Горбачевський*, Я. О. Парнас*, О. Є. Браунштейн).[1] ІУ. Сучасний період (з 40-х років до наших днів) характеризується активною інтеграцією точних наук та їх методів для пояснення молекулярних механізмів біологічних функцій. Здійснено видатні відкриття, що дало підставу назвати П-у половину ХХ ст. “золотим віком біології”. З’ясовано просторову структуру білків (Ф. Сенгер*, Л. Полінг*, М. Корі*, Дж. Кендрю*, М. Перутц*, Ю. О. Овчінніков) і нуклеїнових кислот (Дж. Уотсон*, Ф. Крік*, Ф. Сенгер*, Р. Холлі*, О. О. Баєв), механізм функціонування ферментів, дії вітамінів і гормонів (В. Сазерленд*), біосинтезу білків та його регуляції (М. Ніренберг*, Х. Г. Корана*, Ф. Жакоб* і Ж. Моно*, А. Корнберг*, С. Очоа*, В. Темін*), створено теорію біологічної трансформації енергії (П. Мітчел*, В. П. Скулачев).[2] Активно вивчається біохімія імунної системи, нервової діяльності, диференціації клітин, роль структурної організації клітини в біохімічних процесах.
Біохімічне дослідження включає такі етапи та методичні прийоми: 1. Механічне подрібнення біологічного матеріалу - гомогенізацію і фракціонування, наприклад, за допомогою центрифугування; 2. Розділення молекул за їх фізико-хімічними характеристиками – молекулярною масою, розчинністю, зарядом (ультрацентрифугування, хроматографія, електрофорез); 3. Вивчення складу і будови окремих молекул (гідроліз та виявлення продуктів гідролізату), їх просторової структури, ферментативної активності оптичними (спектрофотометрія), електрохімічними (потенціометричне титрування), радіоспектроскопічними (ЕПР, ЯМР) методами, рентгеноструктурним аналізом (метод дифракції рентгенівських променів). При вивченні обміну речовин застосовується метод мічених атомів. В біохімічному експерименті дуже важливе дотримання оптимальних умов (рН, температура, осмотичний тиск). 3. Хімічні особливості живого Елементний склад В живому організмі містяться практично всі відомі хімічні елементи. За масовим вмістом вони поділяються на макроелементи (на них припадає більше 0,001% маси тіла), мікроелементи (0,001 – 0,000001%), ультрамікроелементи (менше 0,000001%). Макроелементи O, C, H, N. P, Cl, S, Ca, K, Na, Mg, складають 99,9% маси тіла людини. До макроелементів належать також Fe, Zn, Rb, вміст яких в організмі людини масою 70 кг становить відповідно 3 г, 2,3 г, 1,2 г. Мікроелементи: Cu (100 мг), Mn (20 мг), Со (5 мг), Сг (6 мг), J, Br, Mo, V, Si, Se. Ультрамікроелементи: Pb, Ag, Ni, Hg, Au, Cs. За кількісним вмістом в організмі елементи утворюють ті самі групи, але співвідношення їх відрізняються від масових (табл. 1.1.). Для аналізу біологічної функції елементів більш корисним є характеристика їх кількісного вмісту. Наприклад, вона показує, що для атомів організму найбільш характерне сполучення з гідрогеном, ніж з оксигеном, тобто відносно відновлений стан. Таблиця 1.1. Відносний вміст хімічних елементів у організмі людини
Хімічні елементи виконують в організмі певні функції у відповідності до особливостей будови їх атомів та йонів. Атоми карбону утворюють “кістяк” біомолекул (ланцюги і цикли) з певною просторовою конфігурацією. Атоми оксигену і нітрогену, внаслідок високої хімічної активності, зумовлюють високу реакційну здатність молекул, зокрема оксиген – в окисно-відновних реакціях, утворюють полярні групи, які забезпечують гідрофільні властивості біомолекул. Йони Na+, K+, Cl- містяться у вільному стані і є головними неорганічними йонами організму, причому К+ - в клітинах, а Nа+ - в рідинах тіла. Вони забезпечують передачу нервового імпульсу, урівноважують заряд органічних йонів, безпосередньо використовуються у каталітичних процесах. Двовалентні метали та метали перемінної валентності містяться в організмі у вигляді йонів і знаходяться переважно у зв’язаному стані. Вони впливають на взаємну орієнтацію різних ділянок макромолекул, утворюючи координаційні зв’язки з їх функціональними групами. Йони металів перемінної валентності служать переносниками електронів в процесах біологічного окиснення.
Значення для організму того чи іншого елементу зовсім не визначається його концентрацією в організмі. Так мікроелемент кобальт в складі вітаміну В12 необхідний для процесу кровотворення і при його нестачі розвивається злоякісна анемія. Поряд з цим, функція в організмі макроелементу рубідію нез’ясована. Необхідність певного елементу для організму в мікрокількостях указує на те, що він виконує каталітичну функцію, тобто входить до складу ферменту. Функція кожного елементу специфічна. Так для зв’язування молекули кисню в дихальних білках гемоглобіні і міоглобін використовується залізо (П). Лише у деяких членистоногих аналогічну функцію виконує мідь. Йони кальцію забезпечують “скріплення” компонентів у кістковій тканині. В умовах отруєння радіоактивним стронцієм (90Sr) відбувається часткова заміна ним кальцію, що веде до накопичення радіоактивності в кістках. Обчислення кількості атомів певного елементу в клітині показує, що навіть для ультрамікроелементів, таких як миш’як, свинець, срібло, біологічна функція яких не з’ясована, вона досить значна. Так в одному еритроциті на 3·108 молекул білка припадає 7·105 атомів міді, 105 атомів олова, які є життєвонеобхідними, і 2·104 атомів срібла, 7·105 атомів миш’яку, 7·104 атомів свинцю, які мають токсичну дію. Лише чотири елементи (Ас, Ро, Ра і Rа) присутні в кількості менше 1 атома на клітину. Живі організми здатні накопичувати хімічні елементи із середовища в 104 і більше разів (явище біоакумуляції). Багато важких металів акумулюється в печінці, кадмій, ртуть і марганець – в нирках, миш’як і йод – у волоссі, зв’язуючись з певними функціональними групами, наприклад сульфгідрильними. Речовини живого Живі організми і тканини істотно відрізняються за хімічним складом. Він також змінюється з віком і залежно від функціонального стану. Наприклад, вміст води в організмі може коливатись від 97% для ембріона тварини або зеленої рослини до 40% для кісткової тканини. Приблизний склад метаболічно активної клітини відображено в табл. 1.2. Таблиця 1.2. ХІМІЧНИЙ СКЛАД КЛІТИНИ Es herichia coli (Зенгбуш П., 1982)
Найбільший вміст серед речовин в клітині має вода (біля 70%). Як полярний розчинник вона визначає стан речовини в колоїдному розчині, яким є вміст клітини і рідин організму, забезпечує дифузію речовин, бере безпосередню участь в хімічних процесах. Основними складниками живих істот, після води, є сполуки карбону з великою молекулярною масою. Біля 50% сухого вмісту клітини становлять білки. Багато інших біомолекул – нуклеїнові кислоти, вуглеводи, ліпіди утворюють з білками надмолекулярні комплекси – структури, які забезпечують узгоджене в часі і просторі протікання біохімічних процесів. Це хромосоми і рибосоми (нуклеопротеїди), клітинні мембрани (ліпопротеїди), клітинні стінки (глікопротеїди). Переважна більшість перетворень в організмі неможлива без участі каталізаторів – білків. Найпростіші живі істоти – віруси – являють собою нуклеопротеїди. Тому узагальнене визначення: “Життя – це спосіб існування білкових тіл” (Ф. Енгельс) не втрачає актуальності. Перша молекулярна особливість живого - це високий рівень структурної організації речовини. Основними хімічними складовими живого є полімери, які укладаються в просторі в компактні частинки із специфічною формою, причому ця укладка здійснюється самовільно. Зміна характерної просторової форми приводить до зміни функціональної активності молекули. Різні речовини (йони і молекули), впливаючи на просторову форму макромолекулярних структур, регулюють їх функцію. Принцип функціонування біомолекул грунтується на їх специфічній взаємодії за просторовою відповідністю (комплементарністю). Комплементарність забезпечує точну передачу генетичної інформації, знешкодження чужорідних частинок, розпізнавання молекул - регуляторів, унікальну специфічність біокаталітичних процесів тощо. Друга молекулярна особливість живих систем - їх відкритий характер - постійний обмін з оточуючим середовищем речовиною і енергією, який забезпечує постійність середовища, високоорганізованого стану і функції і з припиненням якого припиняється саме життя. Процеси обміну є саморегульованими.
Тема 2. ЛІПІДИ. БІОМЕМБРАНИ Ліпіди - це органічні речовини біологічного походження, які нерозчинні у воді і добре розчинні в неполярних розчинниках. Більшість з них за хімічною будовою являються естерами багатоатомних, високомолекулярних або специфічно побудованих спиртів з вищими жирними кислотами, або належать до їх похідних чи складників. За хімічною будовою ліпіди поділяють на прості і складні. Прості ліпіди не містять інших компонентів крім залишків спирту та вищих жирних кислот. До них належать жири, воски та стериди. Складні ліпіди крім залишків спирту та жирних кислот містять ще інші компоненти, за хімічним складом яких поділяються на фосфоліпіди, гліколіпіди, сульфоліпіди. Жирні кислоти Жирні кислоти, які входять до складу ліпідів, містять, переважно, парну кількість атомів карбону, найчастіше - 16 або 18. Серед них є насичені і ненасичені (Табл. 2.1.).
В більшості ненасичених жирних кислот подвійний зв'язок розташований між 9-м і 10-м атомами карбону. Додаткові подвійні зв'язки розташовуються між С9 подвійним зв'язком і СН3-кінцем молекули, причому між ними міститься метиленова група:. -СН=СН-СН2-СН=СН. Подвійні зв'язки знаходяться переважно в цис -конформації, що приводить до сильного згину вуглецевого ланцюга:
а – насичений ланцюг б – цис -ненасичений ланцюг Радикали жирних кислот з кількома подвійними зв’язками мають декілька згинів ланцюга, а тому є компактними, тоді як насичені, завдяки вільному обертанню навколо sp3-гібридизованих атомів С, - витягнуті. Ця відмінність будови проявляється у особливостях агрегатного стану. При температурі тіла насичені жирні кислоти від С12 до С24 знаходяться у твердому віскоподібному стані, а ненасичені – у рідкому. Радикали ненасичених жирних кислот хімічно активні. За місцем кратних зв’язків вони вступають в реакції приєднання, окиснення, полімеризації. Тому їх можна якісно виявити за допомогою бромної води (реакція приєднання), знебарвлення розчину перманганату калію (реакція окиснення). Для кількісного визначення ступеня ненасиченості ліпідів використовують йодометричне титрування. Ненасичені кислоти слабкими окисниками окиснюються в диоксикислоти, а при енергійному окисненні відбувається розрив -С=С- зв'язку з утворенням двох молекул карбонових кислот: В поліненасичених жирних кислотах -СН2- групи, розташовані між двома подвійними зв'язками, також проявляють високу реакційну здатність, оскільки в результаті відщеплення від них атома гідрогену утворюється стабільний аніон з делокалізованим негативним зарядом: -СН=СН-СН2-СН=СН- → -СН ¼ СН ¼ СН ¼ СН ¼ СН- Взаємодія цих СН2 груп з киснем приводить до утворення гідропероксидів: >НС-О-О-Н. Пероксиди розкладаються, при цьому відбувається полімеризація, утворюються поперечні зшивки між ланцюгами. Перекисне окиснення ліпідів (ПОЛ) протікає в біологічних системах з незначною інтенсивністю, але посилюється в присутності деяких токсичних (чужорідних) речовин, наприклад йонів важких металів, або під дією проникаючої радіації. Одним з кінцевих продуктів перекисного окиснення є малоновий диальдегід: НОС-СН2-СОН, за концентрацією якого судять про інтенсивність ПОЛ. Він та інші продукти ПОЛ мають руйнівну дію на різноманітні клітинні структури і молекули. В природних сумішах ліпідів містяться антиоксиданти, які певною мірою захищають ненасичені радикали від руйнування. До них, зокрема, належить вітамін Е, каротиноїди. Самі ненасичені жирні кислоти також проявляють антиоксидантні властивості. Вода, вуглекислота, гемоглобін також «гасять» збуджені електронні стани. Таблиця 2.1. ВИЩІ ЖИРНІ КИСЛОТИ – СКЛАДНИКИ ЛІПІДІВ
Примітка: а – першим йде число атомів карбону, потім число подвійних зв’язків. В скобках подається номер першого з атомів карбону при подвійному зв’язку і тип зв’язку – цис -(с) або транс -(t). б – систематичні назви в цьому випадку дуже складні і майже не використовуються; наприклад назва ліноленової кислоти – цис, цис, цис -9,12,15-октадекатрієнова кислота На підставі вищесказаного можна було би вважати, що ненасичені жирні кислоти є небажаними компонентами природних ліпідів. Проте вони абсолютно необхідні для забезпечення агрегатного стану біологічних мембран. Крім того, вони, на відміну від насичених жирних кислот, необмежено розчиняються у неполярних розчинниках, і тому протидіють відкладенню холестерину на стінках кровоносних судин та інших утворень ліпідної природи. Поліненасичені жирні кислоти в організмі людини не синтезуються і повинні поступати з їжею. Їх основним джерелом є рослинні олії. Рекомендована доза складає для соняшникової олії біля однієї столової ложки на добу. Окрему групу біологічно активних речовин утворюють циклічні похідні ненасичених С20 кислот – простагландини:
Їх вперше вдалося одержати в кристалічному стані в 1960 р. Зараз відома вже ціла родина простагландинів. Представники її відрізняються наявністю окси- або кетогруп. Вони викликають скорочення гладкого м'язу при концентрації всього 10-9 М, тоді як в сім'яній рідині їх вміст становить біля 10-3 М. Надзвичайний інтерес і перспективу представляє дослідження їх участі в протіканні запального процесу, алергічних реакцій. Прості ліпіди Жири (тригліцериди) - це естери вищих жирних кислот та трьохатомного спирту гліцерину. Структура гліцериду:
При їх повному гідролізі в слаболужному середовищі в організмі утворюються гліцерин та мила (солі жирних кислот), а при частковому -ди- та моногліцериди, в яких естерифіковані відповідно дві або одна гідроксильні групи в молекулі гліцерину. Природні жири при зберіганні піддаються гідролізу за участю мікроорганізмів (згіркають). Неприємний запах, який при цьому з'являється, зумовлений утворенням низькомолекулярних жирних кислот. Якість жиру визначають за його хімічними параметрами. Кількість вільних жирних кислот в жирі характеризується кислотним числом жиру, яке показує скільки міліграмів лугу (КОН) потрібно для нейтралізації вільних жирних кислот, що містяться в 1 г жиру. Загальне число жирних кислот (вільних і зв’язаних) в складі жиру характеризують числом омилення жиру, яке показує, скільки міліграмів гідроксиду калію необхідно для нейтралізації всіх вищих жирних кислот, що містяться в 1 г жиру. Ступінь ненасиченості жиру визначають як масу йоду, г, яка може прореагувати з 100 г жиру (йодне число). Йодне число, наприклад, волового жиру становить - 38-46, а конопляної олії - 150. Жири виконують важливі функції в тваринних та рослинних організмах. Вони відкладаються в жировій тканині тварин - підшкірній жировій клітковині та навколо окремих органів і використовуються по мірі потреби як джерело енергії. 90 % видів рослин мають великі запаси жиру в насінні. У соняшника вони досягають 60 % ваги насіння. Жири е найбільш ефективним енергетичним ресурсом. При повному окисненні 1 г жиру вивільняється біля 39 кДж енергії, тоді як при окисненні 1 г вуглеводів або білків - 17 кДж. Вони енергетично забезпечують довготривалу м'язову роботу, наприклад, сезонну міграцію птахів, забезпечують життєдіяльність тварин під час зимової сплячки, голодування. В нормі резервні ліпіди становлять 10-15 % від маси тіла. При ожирінні їх вміст збільшується до 25-35 %. Жири захищають організм від переохолодження. Так, у "моржів" збільшений шар підшкірної жирової тканини, а в насінні рослин помірного поясу накопичуються жири у 80 % видів, тоді як в тропіках лише у 5 % рослин. При повному окисненні жирів утворюється досить багато води (107 г на 100 г жиру). Тому, наприклад, відкладення жиру в горбі у верблюда служить джерелом ендогенної води. Воски - естери вищих спиртів і вищих жирних кислот. В складі восків знайдено декілька десятків кислот і спиртів, переважно насичених. Найчастіше зустрічаються спирти цетиловий (С16Н33ОН) і мірициловий С30Н61ОН. У бджолиному воску, наприклад, переважає пальмітиновомірициловйй ефір: С15Н31СООС30Н61. Воски зустрічаються як у тваринному, так і в рослинному царстві, де виконують, в основному, захисні функції. Так, в рослинах вони покривають тонким шаром листки, стебла, плоди, охороняючи їх від води і проникнення мікроорганізмів. Бджолиний віск оберігає мед, личинок бджіл. Ланолін - тваринний віск - оберігає волосся і шкіру від дії води. У фітопланктону воски виконують функцію клітинного палива. Цікавим прикладом ролі жирів і восків у біологічній адаптації є їх використання кашалотом. В його голові, маса якої становить третину маси тіла, над верхньою щелепою знаходиться спеціальний утвір – спермацетовий мішок, на який припадає 90 % маси голови. В ньому міститься до 4 т спермацету – суміші, багатої на ненасичені вищих жирних кислот За допомогою цього мішку кашалот регулює плавучість. При температурі 370 спермацет рідкий, а при 310 – твердий. Тому кашалот може до 50 хв. знаходитись на великій глибині, полюючи на кальмарів, і підніматись на поверхню на короткий час для поповнення запасів кисню, підтримуючи, завдяки різному стану спермацету, плавучість, відповідну густині води.
Стериди - це естери специфічно побудованих циклічних спиртів стеролів (стеринів) і вищих жирних кислот В організмі переважно поширені вільні стероли (близько 90 %), а не їх естери. Стероли є продуктами окиснення поліциклічного вуглегідрогену циклопентанопергідрофенантрену. Вони містять чотири конденсованих кільця (це гідрофобна частина молекули) і полярну групу – ОН. Головним стеролом у людини і тварин є холестерол (холестерин), в грибах міститься ергостерол, для рослин типовий сітостерол:
Холестерол (холестерин)
Холестерид (естер холестеролу)
Стериди є обов’язковими структурними компонентами біомембран. Особливо багато їх у зовнішніх мембранах клітин (до 30 % всіх мембранних ліпідів). Важливу біологічну роль виконують похідні стеролів, у яких вкорочений (окиснений) бічний ланцюг. До яких належать стероїдні гормони, жовчні кислоти, вітамін Д. Серед наведених нижче прикладів кортикостерон є одним з найбільш поширених гормонів кори наднирників, естрадіол – жіночий статевий гормон, тестостерон – чоловічий статевий гормон, холева кислота – одна із жовчних кислот:
Холева (3,7,12-тригідроксооксихоланова) кислота
Всього в організмі людини міститься біля 140 г холестеролу. Його концентрація в крові становить біля 2 г/л, причому третина його знаходиться у вільному стані. За нормальних умов він знаходиться у твердому стані (t0пл.=1480). Одне з найбільш поширених сучасних захворювань - атеросклероз - пов'язане з відкладанням стеролів та стеридів на внутрішній поверхні кровоносних судин, що приводить до обмеження кровотоку, а отже інсульту, інфаркту або інших паталогій. Складні ліпіди Складні ліпіди можна розглядати як похідні простих ліпідів, в яких залишок спирту сполучений з полярною групою. Молекули складних ліпідів мають загальний план будови. Вони містять декілька (2, 4) неполярних довгих вуглеводневих радикалів (з яких хоча б один ненасичений) і які, переважно, належать залишкам вищих жирних кислот Це гідрофобні “хвости” молекули, сполучені із залишком спирту (який також може утворювати неполярний радикал, як, наприклад, сфінгозин). Полярна група (“голова”) представлена фосфатом, азотистою основою, вуглеводом, або його сульфопохідним. Таким чином, складні ліпіди – це дифільні молекули, які складаються з полярної “головки” і декількох неполярних хвостів:
У водному середовищі такі молекули утворюють міцели, моношари або бішари, в яких полярні “голови” орієнтовані до води, а неполярні “хвости” обернені до гідрофобної фази або повітря, уникаючи контактів з водою:
Фосфоліпіди – найбільш поширені складні ліпіди. Їх полярна група містить залишок ортофосфорної кислоти і азотистої основи або багатоатомного спирту. Фосфоліпіди, залежно від природи спирту, сполученого із залишками вищих жирних кислот, поділяються на фосфогліцериди і сфінгоміеліни. Фосфогліцериди складаються із залишку гліцерину, з’єднаного по С1 і С2 із залишками вищих жирних кислот (по С2, як правило, ненасиченої) і по С3 – із залишком фосфорної кислоти. Утворена сполука називається фосфатидною кислотою. Через залишок фосфату вона з’єднується з азотистою основою (найчастіше холіном, етаноламіном або серином) або циклічним спиртом інозитолом.
Кардіоліпіни є “подвійними” фосфогліцеридами. У них два залишки фосфатидної кислоти об’єднуються гліцероловим “містком”.
До фосфогліцеридів належать також ацетальфосфатиди (плазмологени), які відрізняються від розгянутих вище представників тим, що замість одного із залишків вищої жирної кислоти містять α, β-ненасичений спирт, який утворює етер із залишком гліцерину. В розбавлених кислотах вони гідролізують з утворенням альдегіду відповідного ненасиченого спирту.
Сфінгоміеліни містять залишок ненасиченого аміноспирту сфінгозину. Він з’єднується із залишком вищої жирної кислоти амідним зв’язком. Утворене похідне носить назву цераміду:
За фізіологічних умов (рН біля 7,0) залишки фосфату, аміно- і карбоксильні групи полярних голів іонізовані. Фосфоліпіди є структурними компонентами біомембран. На їх частку припадає до 50 % всіх мембранних ліпідів. Кардіоліпіни у великих кількостях містяться у внутрішніх мембранах мітохондрій. Сфінгоміелінів особливо багато в мієлінових оболонках нервових клітин певного типу. Крім того вони входять до складу ліпідів крові, багатьох інших тканин. Гліколіпіди та сульфоліпіди В молекулах гліколіпідів полярним компонентом служить не фосфат, а залишок вуглеводу (галактози, глюкози, манози або олігосахариду), з'єднаний з центральною ланкою ефірним зв'язком. Центральною ланкою може бути гліцерин (такі гліколіпіди винайдені в бактеріях та зелених рослинах), або сфінгозин у цереброзидах та гангліозидах). Цереброзиди містять залишок моно- або дисахариду:
До складу гангліозидів входять дуже складні розгалужені олігосахариди, що містять хоча б один залишок N-ацетилнейрамінової (сіалової) кислоти:
Вища жирна кислота містить, як правило, 24 атоми С. В клітинних мембранах винайдено більш ніж 15 класів гангліозидів. Сульфоліпіди можна розглядати як похідні гліколіпідів, в яких залишок сульфату утворює естерний зв’язок з гідроксилом вуглеводного компоненту. Гліколіпіди, як свідчать їх назви, знаходяться у великих кількостях в нервовій тканині - мієлінових оболонках нервів, сірій речовині мозку, однак досить поширені і в інших тканинах. Гангліозиди входять до складу рецепторних ділянок мембран. При деяких хворобах гліколіпіди накопичуються в аномально великих кількостях у зв'язку з порушенням обміну. Природні ліпіди утворюють надзвичайно складні суміші, в яких компоненти зустрічаються в різноманітних поєднаннях. Ліпіди утворюють комплекси з білками за рахунок гідрофобних взаємодій з їх неполярними групами. Такі утворення є формою транспорту ліпідів в крові, характерні для клітинних мембран. Біомембрани Всі живі клітини оточені і перетинаються мембранами. Мембрани виконують такі біологічні функції: бар’єрну (відокремлюють клітину від зовнішнього середовища і поділяють її на компартменти); транспортну (забезпечують перенесення речовин між клітиною і оточуючим середовищам і між клітинними компартментами); структурну (зумовлюють чітку організацію речовин в клітині і збільшують ефективність перетворень за рахунок імобілізації (фіксації) ферментів і субстратів, узгодженості процесів у просторі і часі); сигнальну (забезпечують контакт з іншими клітинами, передачу нервових або гормональних сигналів). На підставі знань про властивості ліпідів, які входять до складу мембран, їх взаємодію з білками, вуглеводами та оточуючим водним середовищем, Гортер та Грендель ще в 1925 р. постулювали, що мембрани мають двошарову структуру (модель "бутерброду"), в якій дифільні молекули ліпідів орієнтуються полярними головками до оточуючого водного середовища, а гідрофобними хвостами - всередину шару. Уточнення структури та функції біомембран за допомогою електронної мікроскопії та хімічних методів привело до створення сучасної рідинно-мозаїчної моделі мембрани (С. Дж. Сінгер, Г. Ніколсон, 1972 р.), яка конкретизує уявлення про двошарову структуру мембран (рис. 2.1). На ліпіди припадає біля 40 % сухої маси мембран. В одній мембрані може поєднуватись більше ста різних ліпідів, причому у певному, визначеному для кожного типу мембрани, порядку. Головними ліпідами мембран є фосфоліпіди (біля 80 % всіх ліпідів) і холестерин (3 – 15 %). Масове співвідношення ліпід: білок становить для типових мембран 1:1, а для міеліну – 4:1. Біля 5 % маси мембран припадає на вуглеводи. Дифільні молекули фосфоліпідів утворюють подвійний шар товщиною біля 7 нм. За фізіологічних умов центральна частина мембрани знаходиться в рідкокристалічному стані. Ліпіди деяких ракових клітин, що утворюють більш рідкі плівки, ніж нормальні, визначають аномальну поведінку цих клітин. Для багатьох мембран, зокрема мітохондрій, існування у вигляді рідких кристалів забезпечується високим вмістом ненасичених радикалів. Більш рідкий стан плівки, що містить ненасичені ланцюги, пояснюється тим, що в місцях подвійних зв'язків порушується строга паралельність ланцюгів, вони легко згинаються і розміщуються хаотично. В мембранах мієлінової оболонки рідкий стан зумовлений надзвичайно високим вмістом холестерину (біля 25 % всіх ліпідів). В мембранах, багатих на ненасичені радикали, холестерин, навпаки, здійснює ущільнюючу дію, зменшуючи нахил між ланцюгами і збільшуючи їх впорядкованість. Отже холестерин у мембрані має функцію регулятора щільності, тобто агрегатного стану, необхідного для нормального функціонування. Хімічний склад гідрофобного шару мембрани визначає важливі її властивості, наприклад, проникність. При заміні ненасичених радикалів в мембранах бактерій на насичені, дифузія речовин сповільнюється в 20 разів. Через мембрани легко проникає вода, але вони практично непроникні для йонів типу Na+, Cl- або Н+ і для полярних молекул, наприклад глюкози. Таким речовинам, на відміну від гідрофобних, для проникнення через мембрану необхідні спеціальні транспортні системи, або переносники. Мембрани мають високий електричний опір, тобто є гарними ізоляторами. Полярні голови ліпідів, особливо йонізовані, на поверхнях мембрани утворюють кристалічну впорядковану структуру завдяки міцним взаємодіям протилежно заряджених та полярних груп. Поверхня мембрани впливає і на властивості близьких шарів води, збільшуючи кислотність, понижуючи температуру замерзання. Ліпідний склад біомембран може дещо змінюватись залежно від харчування, від температурного режиму існування. Наприклад, при пониженні температури середовища мембрани бактерій та рослин збагачуються ненасиченими жирними кислотами, чим забезпечують підтримання рідкого стану. Організми теплокровних тварин протидіють "затвердінню" мембран, підтримуючи постійну температуру тіла за рахунок обміну речовин. Цікаво адаптується до низьких температур пінгвін. У нього температура в ногах зменшується від тіла до кінцівок і відповідно збільшується вміст ненасичених жирних кислот в мембранах клітин. Білки біомембран поділяють на два типи. Білки першого типу - інтегровані, міцно зв'язані своїми гідрофобними радикалами з гідрофобними групами ліпідів. Деякі з них пронизують мембрану наскрізь. До них належать ферменти та транспортні білки. Білки другого типу - периферійні, слабо взаємодіють з мембраною, розташовуються на її поверхні і притягуються до її поверхні за рахунок електростатичної взаємодії. Деякі молекули досить вільно переміщаються в мембрані - це частина білків, ліпіди в площині мембрани. Тому досить популярним є уявлення про мембрану як про ліпідне море, в якому плавають білкові айсберги. Ліпіди в мембрані міняють своїх сусідів в середньому 10 раз в секунду. Інколи, пр
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 529; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.150.240 (0.021 с.) |