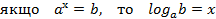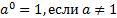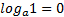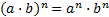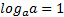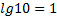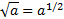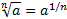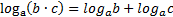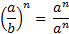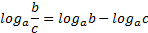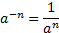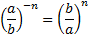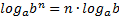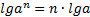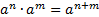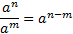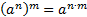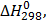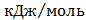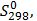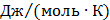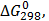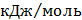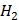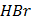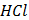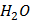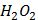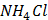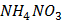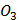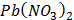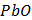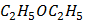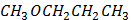Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Техніка безпеки в хімічній лабораторіїСодержание книги
Поиск на нашем сайте
ЗМІСТ
ВСТУП
Предметом вивчення медичної хімії є хімічний склад живих організмів та хімічні (біохімічні) реакції, що є основою життєдіяльності. Основними завданнями курсу є створення фундаментальної наукової бази майбутніх лікарів і розуміння ними загальних фізико-хімічних закономірностей, що лежать в основі процесів життєдіяльності людини в нормі та патології. Організація навчального процесу здійснюється за кредитно-модульною системою, відповідно до вимог Болонського процесу. На вивчення навчальної дисципліни відводиться 135 годин (20 годин лекцій, 50 годин практичних занять, 65 годин СРС), 4,5 кредиту ECTS. Програму курсу складають 2 модулі. Максимальна оцінка за практичне заняття виводиться з оцінок за виконання:
і відповідає 16 балам. Оцінці «5» за 4-бальною шкалою відповідає 16 балів; «4» - 13 балів; «3» - 10 балів; «2» - 0 балів. Загальна оцінка за практичне заняття не може бути позитивною, якщо певний вид роботи було оцінено у кількість балів, меншу мінімальної. За виконання індивідуальної самостійної роботи студент може отримати максимум 8 балів. Підсумковий модульний контроль складається з контролю практичних навичок (максимум 12 балів) і підсумкової письмової контрольної роботи (максимум 68 балів). Студенти, які пропустили практичні заняття зобов'язані відпрацювати їх і не допускаються до підсумкового модульного контролю без виконаних відпрацювань. Студенти, які набрали в сумі за практичні заняття менше 70 балів не допускаються до виконання підсумкового модульного контролю, а студенти, які набрали менше 6 балів за контроль практичних навичок не допускаються до підсумкової письмової контрольної роботи. Підсумковий модульний контроль вважається не зданим, якщо студент набрав < 50 балів. Максимальна оцінка за модуль складає 200 балів (120 балів за практичні заняття + 80 балів за підсумковий модульний контроль). Оцінка за дисципліну є середнім арифметичним з оцінок за модулі. Оцінці «5» за дисципліну за 4-бальною шкалою відповідає сума балів від 170 до 200; «4» - від 140 до 169; «3» - від 120 до 139; «2» < 120. ТЕХНІКА БЕЗПЕКИ В ХІМІЧНІЙ ЛАБОРАТОРІЇ Перед початком кожного заняття в хімічній лабораторії необхідно засвоїти мету роботи, її теоретичну основу і приступати до виконання практичного завдання лише після уявлення плану роботи. Під час роботи в лабораторії необхідно дотримуватися чистоти та порядку, а також правил техніки безпеки. Неохайне виконання операцій часто призводить до необхідності повторного виконання роботи. Перебуваючи в хімічній лабораторії, слід суворо дотримуватися загальних правил поведінки і дисципліни, пам’ятати, що їх порушення може призвести до нещасного випадку. Слід дотримуватися правил особистої гігієни – обов’язково вимити руки після закінчення роботи в лабораторії!
Одяг 1. Працювати треба в медичних халатах, шапочках і тільки на своєму робочому місці. 2. Забороняється носити в лабораторії відкрите взуття, шорти, тощо. 3. При роботі над відкритим полум’ям довге волосся необхідно охайно збирати пучком. Правила поведінки у хімічній лабораторії 4. У лабораторії строго забороняється палити, вживати їжу та напої. 5. Використовувати невідомі реактиви, проводити досліди не передбачені планом відповідної лабораторної роботи. 6. На робочому місці залишати лише необхідні речі (книги, зошит, ручка), а все інше (портфель, сумки) зберігати у спеціально відведеному для цього місці. 7. Завдання виконувати, дотримуючись всіх вказівок в описі досліду: кількості розчину, послідовності виконання дій, температури, тощо. 8. Після закінчення лабораторної роботи прибрати робоче місце. 9. У всіх випадках поранень, опіків та отруєнь негайно сповістити свого викладача, який допоможе організувати своєчасне і кваліфіковане надання медичної допомоги. КомплексНІ СПОЛУКИ Дослід 1. Одержання катіонного комплексу Завдання: - У пробірку внести приблизно 1мл розчину купрум (ІІ) сульфату, додати декілька крапель водного розчину аміаку. - Після спостереження результату додати ще 1-2мл розчину аміаку. - Записати спостереження та навести рівняння відповідних реакцій. ___________________________________________________________________ ____________________________________________________________________
Дослід 2. Одержання аніонного комплексу Завдання: - У пробірку внести приблизно 1мл розчину ферум (ІІІ) хлориду, додати 0,5-1мл розчину калій тіоціанату. - Записати спостереження та навести рівняння відповідної реакції. ________________________________________________________________________________________________________________________________________
Дослід 3. Одержання внутрішньокомплексної сполуки Завдання: - У пробірку внести 0,1-0,3мл розчину кальцій хлориду, додати декілька крапель розчину амоній оксалату. - Після спостереження результату додати 1-2мл розчину трилону Б. - Записати спостереження та навести рівняння відповідних реакцій. ________________________________________________________________________________________________________________________________________
Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів. Мета (знати, вміти): – знати різні способи вираження концентрації розчинів і взаємозв'язок між ними; – вміти характеризувати кількісний склад розчинів; – вміти користуватися хімічним посудом для приготування розчинів і готувати розчини із заданим кількісним складом. Основні поняття теми заняття: розчин, розчинник, концентрація, масова частка, об'ємна частка, мольна частка, моляльність, масова концентрація, молярна концентрація, молярна концентрація еквівалента. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [81-93] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [101-119]
Теоретичні питання: Роль розчинів в життєдіяльності організмів. Класифікація розчинів. Механізм процесів розчинення. Термодинамічний підхід до процесу розчинення. Розчинність речовин.
Розчинність газів у рідинах. Залежність розчинності газів від тиску (закон Генрі-Дальтона), природи газу та розчинника, температури. Вплив електролітів на розчинність газів (закон Сєченова). Розчинність газів у крові. Кесонна хвороба. Розчинність рідин та твердих речовин в рідинах. Залежність розчинності від температури, природи розчиненої речовини та розчинника. Розподіл речовини між двома рідинами, що не змішуються. Закон розподілу Нернста та його значення, біологічні мембрани. Величини, що характеризують кількісний склад розчинів. Приготування розчинів із заданим кількісним складом.
Тести та вправи до самостійної роботи: 1. Справжній розчин може бути системою: а) гомогенною; б) гетерогенною; в) мікрогетерогенною.
2. Розчин, що знаходиться в динамічній рівновазі з надлишком розчиненої речовини, називається: а) насиченим; б) ненасиченим; в) перенасиченим?
3. Молярну масу еквівалента речовини вимірюють в: а) г; б) г/моль; в) моль/л; г) моль/кг; д) г/л.
4. Якщо фактор еквівалентності а) 2; б) 3; в) 4; г) 5; д) 6?
5. Рівняння, що виражає зв’язок між молярною концентрацією еквівалента і густиною розчину визначається формулою: а) в)
6. Розчинення супроводжується: а) збільшенням вільної енергії; б) спочатку збільшенням, а потім зменшенням вільної енергії; в) зменшенням вільної енергії; г) спочатку зменшенням, а потім збільшенням вільної енергії.
7. Як буде змінюватися взаємна розчинність рідин з підвищенням температури: а) зменшуватися; б) не змінюється; в) збільшуватися?
8. Розчинність кисню за однакової температури і парціального тиску найбільша у: а) дистильованій воді; б) річковій воді; в) озерній воді; г) морській воді; д) плазмі крові.
9. Якщо налити в склянку холодної води і поставити її на стіл, то через деякий час на її стінках з’являються бульбашки газу. Це пояснюється тим, що при підвищенні температури розчинність газів у воді: а) збільшується; б) зменшується; в) не змінюється; г) спочатку збільшується, а потім зменшується.
10. Як потрібно подіяти на насичений розчин кисню у воді, щоб зробити його ненасиченим: а) підвищити температуру; б) зменшати тиск; в) додати сіль; г) додати воду?
11. В якому водному розчині натрій хлориду концентрація кисню буде найменшою:
а) 0,0001моль/л; б) 0,01моль/л; в) 0,1моль/л; г) 1 моль/л?
12. Максимальна маса речовини, що здатна розчинитися за даної температури в 100г води, називається: а) масовою концентрацією; б)масовою часткою речовини в розчині; в) коефіцієнтом розчинності; г)молярною концентрацією.
13. Процес виділення твердої речовини з розчину при зниженні температури, називається: а) кристалізацією; б) випаровуванням; в) розчиненням.
14. Відносний об’єм внутрішньоклітинної рідини з віком: а) зменшується; б) збільшується; в) не змінюється.
15. Яким математичним рівнянням пов’язані молярна та масова концентрації речовини?
ЛАБОРАТОРНА РОБОТА №3
ГІДРОЛІЗ СОЛЕЙ
За реакцією середовища, визначеною за допомогою кислотно-основних індикаторів, можна зробити висновок про здатність солей до гідролізу. Дослід 1. Зміна забарвлення розчину індикатора метилового червоного в залежності від рН середовища Завдання: - Три пробірки заповнити на чверть дистильованою водою і розчинами сульфатної кислоти та натрій гідроксиду, відповідно. - У кожну з пробірок додати по 3-4 краплі розчину індикатора метилового червоного, перемішати розчини. - Занести спостереження у таблицю.
Дослід 2. Зміна забарвлення розчину індикатора фенолфталеїну в залежності від рН середовища Завдання: - Три пробірки заповнити на чверть дистильованою водою і розчинами сульфатної кислоти та натрій гідроксиду, відповідно. - У кожну з пробірок додати по 3-4 краплі розчину індикатора фенолфталеїну, перемішати розчини. - Занести спостереження у таблицю. Дослід 3. Визначення реакції середовища за допомогою індикатора метилового червоного Завдання: - У три пробірки налити по 5мл дистильованої води, додати по 3-4 краплі індикатора метилового червоного та внести на кінчику шпателя відповідні сухі солі: в першу – Na2CO3, в другу – CuSO4, в третю – NaCl. Вміст пробірок перемішати. - Занести спостереження у таблицю. - Навести іонні та молекулярні рівняння реакцій, зробити на їх основі висновки про рН розчинів відповідних солей. ________________________________________________________________________________________________________________________________________
Дослід 4. Визначення реакції середовища за допомогою індикатора фенолфталеїну Завдання: - У три пробірки налити по 5мл дистильованої води, додати по 3-4 краплі індикатора фенолфталеїну та внести на кінчику шпателя відповідні сухі солі: в першу – Na2CO3, в другу – CuSO4, в третю – NaCl. Вміст пробірок перемішати. - Занести спостереження у таблицю. - Навести іонні та молекулярні рівняння реакцій, зробити на їх основі висновки про рН розчинів відповідних солей. ________________________________________________________________________________________________________________________________________
Таблиця
Заняття 5. Основи титриметричного аналізу.
Мета (знати, вміти): – аналізувати принципи титриметричних методів дослідження; – вміти визначати кількісний вміст розчинів кислот і основ за допомогою методів кислотно-основного титрування. Основні поняття теми заняття: титриметрический аналіз, титрант, аналіт, точка еквівалентності, точка кінця титрування, індикатор. Література: Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [120-129]
Теоретичні питання: Основи титриметричного аналізу. Методи титриметричного аналізу. Метод кислотно-основного титрування. Кислотно-основні індикатори.
Тести та вправи до самостійної роботи: 1. Титрування – це процес: а) поступового додавання робочого розчину до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом; б) додавання буферного розчину та індикатору до проби з метою отримання забарвленого розчину; в) додавання розчину індикатору до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом; г) приготування розчинів з точно відомою концентрацією.
2. В основі титриметричних визначень лежить вимірювання об’єму: а) розчину аналіту; б) розчину титранту, розчину аналіту; в) буферного розчину; г) розчину індикатору.
3. Титрант (робочий розчин) – це: а) розчин, який титрують; б) розчин, молярну концентрацію еквівалента речовини якого визначають в процесі титрування; в) розчин, яким титрують; г) розчин з невідомою концентрацією.
4. Точка еквівалентності – це моменттитруванні, при якому: а) кількість титранту є еквівалентною кількості аналіту; б) маса доданого розчину титранта дорівнює масі розчину алаліту; в) молярна концентрація доданого розчину титранта дорівнює молярній концентрації розчину аналіту; г) кількість молів індикатору є еквівалентним кількості молів речовини в розчині, що титрується.
5. Якщо реагуючі речовини та продукти їх взаємодії безбарвні, то для встановлення точки еквівалентності візуальним методом у розчин аналіту додають: а) буферний розчин; б) індикатор; в) титрант; г) нічого не додають.
6. Для практичного здійснення об’ємно–аналітичного визначення необхідно: а) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єм титранту; б) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єми розчинів реагуючих речовин; в) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єми розчинів аналіту та індикатору; г) мати розчин титранту, точно виміряти об’єми розчинів реагуючих речовин та індикатору.
7. В об’ємному аналізі можна використовувати: а) будь–які хімічні реакції; б) тільки ті реакції, які відбуваються з достатньою швидкістю і проходять практично до кінця; в) тільки ті реакції, які відбуваються з достатньою швидкістю і зміною кольору розчину; г) тільки ті реакції, які проходять практично до кінця.
8. Бюретки – це: а) градуйовані скляні трубки, які використовують для відмірювання розчинів невеликими порціями або окремими краплями; б) спеціально градуйовані скляні трубки, один кінець яких відтягнутий, призначені для вимірювання та перенесення певного об’єму розчину з однієї посудини в іншу; в) кругла плоскодонна скляна посудина з довгою вузькою шийкою з кільцевою рискою, яка показує, до якого рівня необхідно наливати рідину; г) скляний стакан з позначками.
9. Яка кількість титранту витрачається при титруванні: а) рівна за об’ємом аналізованому розчину; б) надлишкова; в) менша, ніж об’єм розчину аналіту; г) еквівалентна кількості аналіту.
10. Вказати величину константи рівноваги для реакцій, які застосовуються в титриметричному аналізі: а) Кр < 1; б) Кр>>1; в) Кр<<1; г) Кр=1.
11. Вкажіть речовину, з якої можна приготувати стандартний розчин за точною масою цієї речовини: а) оцтова кислота; б) натрій гідроксид; в) сульфатна кислота; г) натрій тетраборат.
12. Вкажіть речовину, яка задовольняє вимогам до вихідної речовини: а) СН3СООН; б) Н2С2О4·2Н2О; в) AgNO3; г) HCl.
13. Різка зміна pH системи на кривій титрування в методі нейтралізації спостерігається поблизу точки еквівалентності. Ця ділянка називається: а) кінцем титрування; б) стрибком титрування; в) інтервалом переходу індикатору; г) немає спеціальної назви.
14. Вкажіть метод аналізу до якого належить титрування за реакцією
а) осаджувальне титрування; б) комплексонометрія; в) кислотно–основне титрування; г) оксидиметрія.
15. Який посуд промивають дистильованою водою перед проведенням титрування: а) мірну колбу; б) бюретку; в) колбу для титрування; г) мірний циліндр?
16. Розчин шлункового соку відтитровано розчином натрій гідроксиду з індикатором фенолфталеїном (рТ=9,0) до рожевого забарвлення. Чи правильний отримано результат: а) результат завищений; б) результат занижений; в) титрування неможливе; г) результат правильний?
17. Щавлеву кислоту відтитрували розчином КОН до нейтральної реакції. Чи отримали правильний результат: а) розчин недотитровано; б) правильний; в) розчин перетитровано; г) титрування неможливе?
18. Вкажіть систему, в якій точка еквівалентності відповідає кислому середовищу: а) HCl–NaOH; б) KOH–H2SO4; в) CH3COOH–NaOH; г) NH3∙H2O–HCl.
19. Вкажіть систему в якій титрування неможливе: а) Н2С2О4–NH4OH; б) NH3∙H2O–HCl; в) KOH–H2SO4; г) CH3COOH– NaOH.
20. Вкажіть інтервал переходу індикатору алізаринового синього, константа дисоціації якого дорівнює 10–12 моль/л: а) 10 – 13; б) 11 – 13; в) 10 – 12; г) 12 – 13.
21. Який фактор впливає на величину стрибка титрування: а) рТ індикатору; б) об’єм розчину, який титрують; в) інтервал переходу індикатору; г) вихідні концентрації аналіту та титранту?
22. Вкажіть титрант для визначення амоній гідроксиду: а) NaOH; б) Na2CO3; в) НСl; г) Na2С2О4.
23. Вкажіть фактор еквівалентності fекв оксалатної кислоти у реакції
а)
24. За якою формулою обчислюють молярну концентрацію еквівалента сульфатної кислоти згідно з даними титриметричного аналізу за реакцією
ЛАБОРАТОРНА РОБОТА №5 ДОВІДКОВА ІНФОРМАЦІЯ
МАТЕМАТИЧНІ ОПЕРАЦІЇ Логарифм числа b з основою a – це показник ступеня, в яку необхідно возвести число a, щоб отримати число b.
таблиця десяткових логарифмів
приклад розрахунку pH за значенням [H+] [H+] = 5,3∙10-1 моль/л. pH = - lg [H+] = - lg 5,3 ∙10-1 = -(0,724 - 1) = -(-0,276) ≈ 0,28 приклад розрахунку [H+] за значенням pH pH = 0,42. [H+] = anti lg (-pH) = anti lg (-0,42) = anti lg (0,580 - 1) = 3,8 ∙10-1 моль/л
ТЕРМОДИНАМІЧНІ ВЛАСТИВОСТІ ДЕЯКИХ РЕЧОВИН
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 1217; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.85.59 (0.011 с.) |

 , то для знаходження молярної маси еквівалента речовини необхідно її молярну масу поділити на:
, то для знаходження молярної маси еквівалента речовини необхідно її молярну масу поділити на: ; б)
; б)  ;
; ; г)
; г)  .
. .
.
 відзначається потужною бактерицидною активністю та окислювальною дією і використовується в стоматології для медикаментозної обробки кореневих каналів і дезінфекції порожнини зуба. Обчислити масу натрій гіпохлориту, що міститься в 30мл розчину з масовою часткою
відзначається потужною бактерицидною активністю та окислювальною дією і використовується в стоматології для медикаментозної обробки кореневих каналів і дезінфекції порожнини зуба. Обчислити масу натрій гіпохлориту, що міститься в 30мл розчину з масовою часткою  10%. Густина розчину
10%. Густина розчину  .
.
 .
.
 5%, щоб отримати розчин з масовою часткою 0,9%.
5%, щоб отримати розчин з масовою часткою 0,9%.
 3%, щоб отримати розчин з масовою часткою
3%, щоб отримати розчин з масовою часткою  10%.
10%.
 1%. Який об’єм оцтової есенції з масовою часткою
1%. Який об’єм оцтової есенції з масовою часткою  ) потрібно взяти для приготування 1л 1%-го розчину оцтової кислоти (густина розчину
) потрібно взяти для приготування 1л 1%-го розчину оцтової кислоти (густина розчину  30%, щоб приготувати розчин з масовою часткою
30%, щоб приготувати розчин з масовою часткою  ?
? 
 ?
? 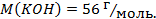
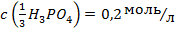 ?
? 

 . Густина розчину
. Густина розчину 
 30%. Густина розчину
30%. Густина розчину  ;
; 
 в розчині з масовою часткою
в розчині з масовою часткою  10,32%. Густина розчину
10,32%. Густина розчину  ;
; 
 в отриманому розчині. Густина розчину
в отриманому розчині. Густина розчину  .
.
 10% застосовується в медицині як протиалергійний та протизапальний засіб. Розрахувати масову та молярну концентрації цього розчину. Густина розчину
10% застосовується в медицині як протиалергійний та протизапальний засіб. Розрахувати масову та молярну концентрації цього розчину. Густина розчину  ,
, 
 :
: :
: ; б) 1; в)
; б) 1; в) 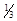 ; г)
; г)  .
. :
: ;
;
 ;
;
 ;
;
 ?
?
 . На титрування 10мл приготованого розчину
. На титрування 10мл приготованого розчину 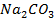 використано 10,2мл розчину
використано 10,2мл розчину  .
.  .
.
 . На титрування 10мл приготованого розчину
. На титрування 10мл приготованого розчину  використано 11,1мл розчину
використано 11,1мл розчину  .
. 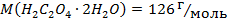 .
.
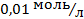 . Визначити: а) масу оцтової кислоти, що міститься в 20мл розчину; б) масу оцтової кислоти, що міститься в 1л розчину;
. Визначити: а) масу оцтової кислоти, що міститься в 20мл розчину; б) масу оцтової кислоти, що міститься в 1л розчину;  .
.
 . Густина нашатирного спирту
. Густина нашатирного спирту  .
.