
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характерні реакції іонів деяких макро – та мікроелементівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Техніка виконання експерименту: Для проведення реакції в пробірку вносять за допомогою піпеток вказаний в інструкції об’єм розчинів, стежачи за тим, щоб кінчик піпетки не торкався стінки пробірки. Піпетку слід повертати у ту склянку, з якої відбирали розчин для досліду. Дослід 1. Реакція карбонат-іонів Завдання: - У пробірку внести по 1-2мл розчинів натрій карбонату та хлоридної кислоти. - Записати спостереження та навести рівняння відповідної реакції. _________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Реакція сульфат-іонів Завдання: - У пробірку внести по 1-2мл розчинів натрій сульфату та барій хлориду. - Записати спостереження та навести рівняння відповідної реакції. ____________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 3. Реакція нітрит-іонів Завдання: - У пробірку внести приблизно 1мл розчину калій нітриту та обережно додати 0,1-0,3мл концентрованого розчину сульфатної кислоти. - Записати спостереження та навести рівняння відповідної реакції. __________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 4. Реакція іонів аргентуму Завдання: - У пробірку внести по 1-2мл розчинів аргентум нітрату та хлоридної кислоти. - Записати спостереження та навести рівняння відповідної реакції. ___________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 5. Реакція перманганат-іонів Завдання: - У пробірку внести приблизно по 1мл розчинів калій перманганату та сульфатної кислоти, додати 0,5-1мл розчину гідроген пероксиду. - Записати спостереження та навести рівняння відповідної реакції. _________________________________________________________________________________________________________________________________________________________________________________________________________
Заняття 2. Комплексоутворення в біологічних системах. Мета (знати, вміти): – пояснювати принципи будови комплексних сполук; – інтерпретувати особливості будови комплексних сполук для їх застосування в хелатотерапіі;
Основні поняття теми заняття: комплексні сполуки, комплексоутворювач, ліганди, дентатність. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [32-39] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [42-52] Теоретичні питання: Реакції комплексоутворення. Координаційна теорія А. Вернера та сучасні уявлення про будову комплексних сполук. Поняття про комплексоутворювач (центральний іон). Природа, координаційне число, гібридизація орбіталей комплексоутворювача. Поняття про ліганди. Координаційна ємність (дентатність) лігандів. Внутрішня та зовнішня сфери комплексів. Геометрія комплексного іону. Природа хімічного зв’язку в комплексних сполуках. Класифікація комплексних сполук за зарядом внутрішньої сфери та за природою лігандів. Внутрішньокомплексні сполуки. Поліядерні комплекси. Залізо-, кобальто-, міді- та цинковмісні біокомплексні сполуки.Поняття про металолігандний гомеостаз. Порушення гомеостазу. Комплексони та їх застосування в медицині як антидотів при отруєнні важкими металами (хелатотерапія) та як антиоксидантів при зберіганні лікарських препаратів.
Тести та вправи до самостійної роботи: 1. Координаційні (комплексні) сполуки – це: а) сполуки, кристалічні решітки яких складаються із комплексних груп, утворених в результаті взаємодії іонів або молекул, що здатні існувати самостійно; б) складні речовини, які містять гідроксильні групи, здатні обмінюватися на кислотні залишки; в) кристалічні речовини, які можна розглядати як продукти повного чи часткового заміщення атомів гідрогену кислот металом; г) речовини, у яких складові частинки (атоми, молекули, іони) чітко чергуються у тривимірному просторі.
2. Ліганди (адденди) – це: а) молекули або іони, які координуються навколо центрального атома чи іона; б) центральні атоми чи іони, до яких приєднуються нейтральні молекули або іони; в) певний вид атомів з однаковим зарядом атомних ядер; г) атом чи група атомів, що має надлишок або недостачу електронів.
3. Координаційне число – це: а) сумарний заряд всіх іонів зовнішньої сфери; б) число місць, які ліганди займають у внутрішній координаційній сфері комплексу; в) число реальних або умовних частинок, які вміщує 1 моль речовини; г) сумарне число атомів у молекулі.
4. Дентатність лігандів – це: а) число зв'язків, за допомогою яких ліганди безпосередньо сполучені з комплексоутворювачем; б) сума зарядів комплексоутворювача та лігандів; в) сумарна кількість лігандів; г) сумарне число нуклонів у ядрі.
5. Координаційне число залежить від: а) природи центрального іона та лігандів; б) зовнішньої сфери; в) температури; г) тиску.
6. Внутрішню координаційну сферу складають: а) комплексоутворювач; б) ліганди та протиіони; в) комплексоутворювач та ліганди; г) комплексоутворювач та протиіони.
7. Заряд внутрішньої координаційної сфери дорівнює: а) сумарному заряду всіх іонів зовнішньої сфери; б) сумі зарядів лігандів; в) сумарному заряду всіх лігандів; г) заряду комплексоутворювача.
8. За природою лігандів комплексна сполука [Al(H2O)6]Cl3 класифікується як: а) ацидокомплекс; б) аквакомплекс; в) гідроксокомплекси; г) амінокомплекс.
9. Хелатні комплекси – це комплекси у яких: а) ліганди разом з комплексоутворювачем утворюють стійкі цикли; б) лігандами є молекули Н2О; в) лігандами є молекули NН3; г) ліганди монодентатні.
10. Який з комплексів є неелектролітом: а) [Pt(NH3)6]Cl4; б) [Pt(NH3)2Cl2]; в) K2[PtCl6]; г) K2[PtCl4]. 11. Комплексоутворювач повинен: а) бути акцептором електронів, мати вільні електронні орбіталі; б) бути нейтральною частинкою; в) містити атоми оксигену; г) бути донором електронних пар.
12. Комплексні сполуки а) сольватними ізомерами; б) іонізаційними ізомерами; в) координаційними ізомерами; г) геометрирчними ізомерами.
13. Комплексні сполуки а) сольватними ізомерами; б) іонізаційними ізомерами; в) координаційними ізомерами; г) геометрирчними ізомерами.
а) сольватними ізомерами; б) іонізаційними ізомерами; в) координаційними ізомерами; г) геометричними ізомерами.
15. Яка з частинок може стати комплексоутворювачем: а) ОН-; б) Cu2+; в) CN-; г) H2O?
16. Яка з частинок може стати лігандом: а) Cu2+; б) Cu+; в) Ag+; г) OH-?
17. З наведених молекул та іонів бідентатним лігандом може стати: а) SO42-; б) NH3; в) H2O; г) OH-.
18. Вказати найбільш ймовірну зовнішню сферу комплексного іона [Fe(CN)6]4-: а) 4K+; б) 4ОН-; в) 3Na+; г) 2SO42-.
19. Назвати тип гібридизації атомних орбіталей комплексоутворювача в комплексному іоні [Cr(H2O)6]3+: а) sp; б) sp2; в) sp3; г) dsp2.
20. Реалізація якого типу зв'язку є обов'язковою в комплексних сполуках: а) іонного; б) донорно-акцепторного; в) водневого; г) металічного?
21. Від яких факторів не залежить величина координаційного числа: а) від ступеня окиснення центрального атома; б) від кількості речовини комплексної сполуки; в) від природи лігандів; д) від кількості вільних орбіталей комплексоутворювача?
22. Які координаційні числа найбільш характерні для комплексних сполук: а) 2,6,8; б) 2,4,8; в) 2,4,6; г) 4,6,8.
23. Найхарактернішою просторовою конфігурацією внутрішньої сфери комплексу з координаційним числом комплексоутворювача 6 є: а) тетраедр; б) квадратна піраміда; в) октаедр; г) плоский квадрат.
24. Яка внутрішня сфера комплексу має тетраедричну просторову будову: а) [Ag(NH3)2]+; б) [Zn(OH)4]2-; в) [Pt(NH3)2Cl2]; г) [Al(OH)6]3-?
25. У комплексі Na3[Ag(S2O3)2] ступінь окиснення і координаційне число центрального атома відповідно дорівнюють: а) +1; 2; б) +2; 3; в) 0; 2; г) +1; 4.
26. У схемі реакції комплексоутворення пропущено формулу реагенту. Напишіть рівняння реакції: AuCl3 +? = H[AuCl4].
27. Яку геометричну фігуру утворюють атоми лігандів, які безпосередньо зв’язані з комплексоутворювачем в макромолекулі гемоглобіну: а) тетраедричну; б) квадратну; в) октаедричну; г) лінійну?
28. Яку геометричну фігуру утворюють атоми лігандів, які безпосередньо зв’язані з комплексоутворювачем в макромолекулі вітаміну В12: а) тетраедричну; б) квадратну; в) октаедричну; г) лінійну?
29. Яка дентатність макроциклічного ліганду порфірину: а) моно-; б) ди-; в) тетра-; г) гекса-?
30. Яка функція характерна для залізовмісних біокомплексів цитохромів: а) зв'язування молекул кисню атомами феруму (ІІ) та перенос його з легень до м'язів; б) передача кисню в м'язах міоглобіну; в) зв'язування молекул вуглекислого газу та перенос його до легень; г) перенос електронів?
31. Який з катіонів є комплексоутворювачем у макромолекулі хлорофілу: а) Fe2+; б) Co3+; в) Mg2+; г) Zn2+?
32. Який з катіонів є комплексоутворювачем у сполуці інсулін: а) Fe2+; б) Co3+; в) Mg2+; г) Zn2+?
33. Написати рівняння реакції: NaOH + Cr(OH)3 →; CuSO4 + NH3 →; KCN + Cu(CN)2 →; CoF3 + KF →.
ЛАБОРАТОРНА РОБОТА №2 КомплексНІ СПОЛУКИ Дослід 1. Одержання катіонного комплексу Завдання: - У пробірку внести приблизно 1мл розчину купрум (ІІ) сульфату, додати декілька крапель водного розчину аміаку. - Після спостереження результату додати ще 1-2мл розчину аміаку. - Записати спостереження та навести рівняння відповідних реакцій. ___________________________________________________________________ ____________________________________________________________________
Дослід 2. Одержання аніонного комплексу Завдання: - У пробірку внести приблизно 1мл розчину ферум (ІІІ) хлориду, додати 0,5-1мл розчину калій тіоціанату. - Записати спостереження та навести рівняння відповідної реакції. ________________________________________________________________________________________________________________________________________
Дослід 3. Одержання внутрішньокомплексної сполуки Завдання: - У пробірку внести 0,1-0,3мл розчину кальцій хлориду, додати декілька крапель розчину амоній оксалату. - Після спостереження результату додати 1-2мл розчину трилону Б. - Записати спостереження та навести рівняння відповідних реакцій. ________________________________________________________________________________________________________________________________________
Заняття 3. Величини, що характеризують кількісний склад розчинів. Приготування розчинів. Мета (знати, вміти): – знати різні способи вираження концентрації розчинів і взаємозв'язок між ними; – вміти характеризувати кількісний склад розчинів; – вміти користуватися хімічним посудом для приготування розчинів і готувати розчини із заданим кількісним складом. Основні поняття теми заняття: розчин, розчинник, концентрація, масова частка, об'ємна частка, мольна частка, моляльність, масова концентрація, молярна концентрація, молярна концентрація еквівалента. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [81-93] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [101-119]
Теоретичні питання: Роль розчинів в життєдіяльності організмів. Класифікація розчинів. Механізм процесів розчинення. Термодинамічний підхід до процесу розчинення. Розчинність речовин. Розчинність газів у рідинах. Залежність розчинності газів від тиску (закон Генрі-Дальтона), природи газу та розчинника, температури. Вплив електролітів на розчинність газів (закон Сєченова). Розчинність газів у крові. Кесонна хвороба. Розчинність рідин та твердих речовин в рідинах. Залежність розчинності від температури, природи розчиненої речовини та розчинника. Розподіл речовини між двома рідинами, що не змішуються. Закон розподілу Нернста та його значення, біологічні мембрани. Величини, що характеризують кількісний склад розчинів. Приготування розчинів із заданим кількісним складом.
Тести та вправи до самостійної роботи: 1. Справжній розчин може бути системою: а) гомогенною; б) гетерогенною; в) мікрогетерогенною.
2. Розчин, що знаходиться в динамічній рівновазі з надлишком розчиненої речовини, називається: а) насиченим; б) ненасиченим; в) перенасиченим?
3. Молярну масу еквівалента речовини вимірюють в: а) г; б) г/моль; в) моль/л; г) моль/кг; д) г/л.
4. Якщо фактор еквівалентності а) 2; б) 3; в) 4; г) 5; д) 6?
5. Рівняння, що виражає зв’язок між молярною концентрацією еквівалента і густиною розчину визначається формулою: а) в)
6. Розчинення супроводжується: а) збільшенням вільної енергії; б) спочатку збільшенням, а потім зменшенням вільної енергії; в) зменшенням вільної енергії; г) спочатку зменшенням, а потім збільшенням вільної енергії.
7. Як буде змінюватися взаємна розчинність рідин з підвищенням температури: а) зменшуватися; б) не змінюється; в) збільшуватися?
8. Розчинність кисню за однакової температури і парціального тиску найбільша у: а) дистильованій воді; б) річковій воді; в) озерній воді; г) морській воді; д) плазмі крові.
9. Якщо налити в склянку холодної води і поставити її на стіл, то через деякий час на її стінках з’являються бульбашки газу. Це пояснюється тим, що при підвищенні температури розчинність газів у воді: а) збільшується; б) зменшується; в) не змінюється; г) спочатку збільшується, а потім зменшується.
10. Як потрібно подіяти на насичений розчин кисню у воді, щоб зробити його ненасиченим: а) підвищити температуру; б) зменшати тиск; в) додати сіль; г) додати воду?
11. В якому водному розчині натрій хлориду концентрація кисню буде найменшою: а) 0,0001моль/л; б) 0,01моль/л; в) 0,1моль/л; г) 1 моль/л?
12. Максимальна маса речовини, що здатна розчинитися за даної температури в 100г води, називається: а) масовою концентрацією; б)масовою часткою речовини в розчині; в) коефіцієнтом розчинності; г)молярною концентрацією.
13. Процес виділення твердої речовини з розчину при зниженні температури, називається: а) кристалізацією; б) випаровуванням; в) розчиненням.
14. Відносний об’єм внутрішньоклітинної рідини з віком: а) зменшується; б) збільшується; в) не змінюється.
15. Яким математичним рівнянням пов’язані молярна та масова концентрації речовини?
ЛАБОРАТОРНА РОБОТА №3
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 1141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.81.47 (0.01 с.) |

 та
та  Сl3 є:
Сl3 є: та
та  є:
є:

 , то для знаходження молярної маси еквівалента речовини необхідно її молярну масу поділити на:
, то для знаходження молярної маси еквівалента речовини необхідно її молярну масу поділити на: ; б)
; б)  ;
; ; г)
; г)  .
. .
.
 відзначається потужною бактерицидною активністю та окислювальною дією і використовується в стоматології для медикаментозної обробки кореневих каналів і дезінфекції порожнини зуба. Обчислити масу натрій гіпохлориту, що міститься в 30мл розчину з масовою часткою
відзначається потужною бактерицидною активністю та окислювальною дією і використовується в стоматології для медикаментозної обробки кореневих каналів і дезінфекції порожнини зуба. Обчислити масу натрій гіпохлориту, що міститься в 30мл розчину з масовою часткою  10%. Густина розчину
10%. Густина розчину  .
.
 .
.
 5%, щоб отримати розчин з масовою часткою 0,9%.
5%, щоб отримати розчин з масовою часткою 0,9%.
 3%, щоб отримати розчин з масовою часткою
3%, щоб отримати розчин з масовою часткою  10%.
10%.
 1%. Який об’єм оцтової есенції з масовою часткою
1%. Який об’єм оцтової есенції з масовою часткою  ) потрібно взяти для приготування 1л 1%-го розчину оцтової кислоти (густина розчину
) потрібно взяти для приготування 1л 1%-го розчину оцтової кислоти (густина розчину  30%, щоб приготувати розчин з масовою часткою
30%, щоб приготувати розчин з масовою часткою  ?
? 
 ?
? 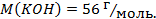
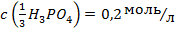 ?
? 

 . Густина розчину
. Густина розчину 
 30%. Густина розчину
30%. Густина розчину  ;
; 
 в розчині з масовою часткою
в розчині з масовою часткою  10,32%. Густина розчину
10,32%. Густина розчину  ;
; 
 в отриманому розчині. Густина розчину
в отриманому розчині. Густина розчину  .
.
 10% застосовується в медицині як протиалергійний та протизапальний засіб. Розрахувати масову та молярну концентрації цього розчину. Густина розчину
10% застосовується в медицині як протиалергійний та протизапальний засіб. Розрахувати масову та молярну концентрації цього розчину. Густина розчину  ,
, 



