
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготування розчину кобальт (ІІ) нітрату розбавленням більш концентрованого розчинуСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Одним із методів приготування розчинів з заданою концентрацією є метод розбавлення більш концентрованого розчину.
Мета: Приготувати 100 мл розчину кобальт (ІІ) нітрату з молярною концентрацією еквівалентів 0,02 моль/л використовуючи більш концентрований розчин з вихідною концентрацією с1[ Лабораторне обладнання: Мірна колба; піпетка; промивалка лабораторна; дозатор. Техніка виконання лабораторної роботи: Під час приготування розчинів користуються мірними колбами та піпетками. Щоб підготувати посуд для приготування розбавленого розчину необхідно: а) піпетку спочатку промити дистильованою водою, втягуючи її за допомогою гумової груші, а потім розчином, який буде нею відмірюватися; б) мірну колбу промити дистильованою водою. Техніка роботи з піпеткою: Набрати розчин у піпетку, рівень рідини має знаходитись вище градуювальної позначки, після чого зняти грушу, швидко закрити вказівним пальцем верхній отвір піпетки; тримаючи піпетку вертикально і послаблюючи натиск пальця, встановити нижній край меніска рідини на позначці.
Завдання: - Розрахувати необхідний об’єм вихідного розчину. - Промити мірну колбу дистильованою водою. - Використовуючи дозатор або гумову грушу промити піпетку дистильованою водою та відповідним розчином, втягуючи рідину вище позначки. - Піпеткою відібрати розрахований об’єм розчину. - Перенести вміст піпетки у мірну колбу ємністю 100мл. - Заповнити колбу дистильованою водою на 1-2 см нижче позначки. - За допомогою промивалки обережно (по краплях) довести рівень рідини до позначки. - Закрити колбу пробкою та декілька разів перевернути перемішуючи розчин.
Розрахунки проводять виходячи з формули: с1(1/z Х)·V1(X) = с2(1/z Х)·V2(X), де
с1(1/z Х) та с2(1/z Х) – молярні концентрації еквівалента речовини Х у вихідному та одержаному розчинах, відповідно; V1(X) та V2(X) – об’єми віхідного розчину та розчину приготованого шляхом розбавлення.
Звідси: с1[1/2 Со(NO3)2]·V1[Со(NO3)2] = с2[1/2 Со(NO3)2]·V2[Со(NO3)2]
V1[Со(NO3)2] = с2[1/2 Со(NO3)2]·V2[Со(NO3)2] / с1[1/2 Со(NO3)2]
V1[Со(NO3)2] = = л = мл.
__________________________________________________________________________________________________________________________________________________________________________________________________________
Заняття 4. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
Мета (знати, вміти): – використовувати знання о концентрації іонів водню для оцінки властивостей розчинів, напрямку протікання хімічних реакцій; – розраховувати рН розчинів сильних і слабких електролітів; – визначати рН розчинів за допомогою індикаторів; – робити висновки про кислотності біологічних рідин на підставі значень водневого показника. Основні поняття теми заняття: ступінь дисоціації, константа дисоціації, активність, водневий показник, гідроліз. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [104-120] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [134-155]
Теоретичні питання: Розчини електролітів. Електроліти в організмі людини. Ступінь та константа дисоціації слабких електролітів. Властивості розчинів сильних електролітів. Активність та коефіцієнт активності. Іонна сила розчину. Водно-електролітний баланс - необхідна умова гомеостазу. Дисоціація води. Іонний добуток води. Водневий показник рН. Значення рН для різних рідин людського організму в нормі та патології. Теорії кислот та основ. Типи протолітичних реакцій: реакції нейтралізації, гідролізу та іонізації. Гідроліз солей. Ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу. Роль гідролізу в біохімічних процесах.
Тести та вправи до самостійної роботи: 1. Електролітами називаються речовини, що: а) добре розчиняються у воді; б) погано розчиняються у воді; в) розпадаються на іони під дією полярних молекул розчинника (води); г) не розпадаються на іони при розчиненні у воді й при нагріванні; д) в розчиненому вигляді не проводять електричний струм.
2. Електролітична дисоціація – це розпад на іони під дією молекул розчинника речовин, які мають тип зв’язку, притаманний речовинам: а) СН4; б) О2, N2; в) NaCl, HCl; г) CO2; д) CO, H2.
3. Кількісними характеристиками сили електроліту є: а) ступінь гідролізу; б) константа гідролізу; в) константа дисоціації та ступінь дисоціації;
г) іонна сила розчину електроліту; д) густина розчину електроліту.
4. Ступінь дисоціації (α) слабкого електроліту залежить від природи електроліту та: а) об’єму розчину; б) не залежить від природи розчинника; в) не залежить від температури; г) природи розчинника, температури, концентрації електроліту; д) маси розчину.
5. Константа дисоціації слабкого електроліту (Кд) - це відношення до рівноважної молярної концентрації молекул електроліту, що не розпалися на іони: а) суми рівноважних молярних концентрацій іонів електроліту; б) різниці рівноважних молярних концентрацій іонів електроліту; в) іонної сили розчину; г) суми рівноважних моляльностей іонів електроліту; д) добутку рівноважних молярних концентрацій іонів електроліту.
6. Константа дисоціації слабкого електроліту (Кд) не залежить від: а) природи електроліту; б) природи розчинника; в) концентрації електроліту; г) температури.
7. Ступінь дисоціації (α) для слабких електролітів при с (електроліту) = 0,1моль/л за температури 250С має значення: а) α = 0; б) α = 1; в) α < 1; г) α > 1; д) α << 1.
8. Вказати константу дисоціації ортофосфатної кислоти, що має найбільшу величину: а) Кд1; б) Кд2; в) Кд3; г) Кд загальна; д) всі константи рівні між собою.
9. Молярна концентрація іонів у водних розчинах сильних електролітів, виміряна за допомогою деяких фізико-хімічних методів, менша за розрахункову, тому що іони: а) гідратуються; б) утворюють молекули; в) зменшують свою рухливість завдяки їх електростатичній взаємодії; г) збільшують свою рухливість завдяки їх електростатичній взаємодії; д) гідролізуються.
10. Активність іонів а (х) – це їх молярна концентрація у: а) концентрованих розчинах сильних електролітів; б) розбавлених розчинах сильних електролітів; в) дуже розбавлених розчинах сильних електролітів; г) будь-яких розчинах сильних електролітів; д) дуже розбавлених розчинах неелектролітів.
11. Активність іонів сильного електроліту а (х) у водному розчині дорівнює їх молярній концентрації с(х) за умови, що: а) f >1; б) f <1; в) f = 1; г) f <<1; д) с(х) = 1 моль/л.
12. Активність іонів сильного електроліту а (х) в розчині дорівнює їх молярній концентрації с(х), якщо с(х) має значення: а) 1 моль/л; б) 0,1 моль/л; в) →0; г) > 1; д) < 1 моль/л.
13. За силою електроліту чиста (дистильована) вода належить до: а) сильних електролітів; б) слабких електролітів; в) неелектролітів; г) електролітів середньої сили; д) дуже слабких електролітів.
14. Константа дисоціації води Кд(Н2О) за температури 250С дорівнює (моль/л): а) 2∙10–18; б) 2∙10–17; в) 1,8∙10–16; г) 2,8∙10–16; д)2,8∙10–17.
15. Константа дисоціації води Кд(Н2О) залежить від: а) присутності кислоти; б) присутності лугу; в) температури; г) присутності солі; д) присутності неелектроліту.
16. Іонний добуток води (Кв) дорівнює: а) Кв = [Н+] + [ОН–]; б) Кв = [Н+] – [ОН–]; в) Кв = [Н+]∙[ОН–]; г) Кв = lg 17. Величина іонного добутку води (Кв )вимірюється в одиницях: а) моль/л; б) г/л; в) моль2/л2; г) кг/моль; д) кг/л.
18. Іонний добуток води за температури 250С в логарифмічній формі дорівнює: а) - 12; б) - 14; в) - 13; г) - 15; д) - 16.
19. Гідроксидний показник рОН дорівнює: а) lg [OH-]; б) –lg Kд; в) –lg [OH–]; г) –lg [Н2O]; д) –ln [OH–].
20. Згідно з теорією Бренстеда і Лоурі кислотами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп; б) донорами протонів (іонів гідрогену); в) акцепторами протонів; г) акцепторами електронної пари; д) донорами електронної пари.
21. Серед наведених реакцій вибрати протолітичну: а) ZnO + 2NaOH + H2O = Na2[Zn(OH)4]; б) 3NaOH + Al(OH)3 = Na3[Al(OH)6]; в) H2O + CH3COOH = CH3COO– + H3O+; г) CaO + Pb(OH)2 + H2O = Ca[Pb(OH)4]; д) CH4 + Cl2 = CH3Cl + HCl.
22. Константа гідролізу (Кг) солі, утвореної залишками слабкої кислоти і сильної основи або слабкої основи і сильної кислоти – це відношення іонного добутку води (Кв) до: а) константи дисоціації слабкого електроліту; б) суми молярних концентрацій іонів гідрогену та гідроксид-іонів; в) добутку молярних концентрацій іонів гідрогену та гідроксид-іонів; г) кількості речовини солі, що прогідролізувала; д) кількості речовини солі, що продисоціювала.
23. Ступінь гідролізу солі (αг) – це відношення до загальної кількості речовини розчиненої солі: а) молярної концентрації солі; б) масової концентрації солі; в) масової частки солі; г) кількості речовини солі, що прогідролізувала; д) кількості речовини солі, що продисоціювала.
24. Ступінь гідролізу солі (αг) не залежить від: а) молярних концентрацій іонів солі; б) природи солі; в) додавання сильної кислоти (або лугу); г) присутності у розчині солі, утвореної сильною кислотою та лугом.
25. Ступінь гідролізу солі (αг) зростає при: а) збільшенні концентрації солі; б) зниженні температури; в) зниженні температури та збільшенні концентрації солі; г) зменшенні концентрації солі; д) додаванні солі, утвореної сильною кислотою та лугом. 26. Посилення гідролізу солей при підвищенні температури пояснюється: а) збільшенням швидкості ендотермічної реакції дисоціації води; б) зменшенням швидкості ендотермічної реакції дисоціації води; в) зменшенням швидкості екзотермічної реакції дисоціації води; г) збільшенням швидкості екзотермічної реакції дисоціації води.
27. Яка реакція середовища сечі, якщо аналізи показали, що в ній містяться такі солі: NН4Сl, (NН4)3РО4, (NН4)2SО4: а) кисла; б) лужна; в) нейтральна; г) слабколужна; д) слабкокисла?
28. Реакція середовища при гідролізі солі, утвореної слабкою основою та слабкою кислотою, якщо а) лужна; б) нейтральна; в) слабкокисла; г) слабколужна; д) кисла.
29. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо а) рН < 7; б) рН ≈ 7; в) рН = 7; г) рН > 7; д) рН = 0?
30. Яка з кислот найсильніша, якщо:
а) рКСН3СOOH = 4,76; б) pKHNO2 = 3,29; в) pKHCOOH = 3,67; г) pKHСlO = 7,30; д) pKHbrO = 8,60?
31. Якій солі відповідає вираз для константи гідролізу а) (NH4)2SO4; б) Na2SO4; в) NaCN; г) (NH4)3PO4; д) CH3COONH4?
32. В яких одиницях виражається Кг для солей, утворених слабкою кислотою та слабкою основою: а) г/моль; б) г/л; в) моль2/л2; г) моль/л; д)безрозмірна величина?
33. Водний розчин якої із солей має найменше значення рН, якщо Кд(NН3∙Н2О) = 1,8∙10‑5 моль/л, Кд2(Zn(ОН)2) = 10–11моль/л: а) амоній хлорид; б) амоній нітрат; в) цинк нітрат; г) амоній сульфат; д) натрій нітрат.
34. Додавання лугу до розчину амоній хлориду призведе до: а) пригнічення гідролізу; б) підсилення гідролізу; в) не вплине; г) не відомо.
35. рН артеріальної крові здорової людини має значення: а) 7,30; б) 7,40; в) 7,50; г) 7,60; д) 7,70.
36. Ацидоз – це відхилення рН до: а) 8,3; б) 8,0; в) 7,7; г) 7,5; д) 7,1.
37. Алкалоз – це відхилення рН крові до: а) 6,5; б) 6,8; в) 7,1; г) 7,0; д) 7,7.
38. Оптимальна дія ферменту травного каналу (шлунку) – пепсину проявляється при рН: а) 1,5 – 2,5; б) 3 – 4; в) 4,5 – 5,0; г) 4,8 – 5,5; д)5,8 – 6,7.
ЛАБОРАТОРНА РОБОТА №4 ГІДРОЛІЗ СОЛЕЙ
За реакцією середовища, визначеною за допомогою кислотно-основних індикаторів, можна зробити висновок про здатність солей до гідролізу. Дослід 1. Зміна забарвлення розчину індикатора метилового червоного в залежності від рН середовища
Завдання: - Три пробірки заповнити на чверть дистильованою водою і розчинами сульфатної кислоти та натрій гідроксиду, відповідно. - У кожну з пробірок додати по 3-4 краплі розчину індикатора метилового червоного, перемішати розчини. - Занести спостереження у таблицю.
Дослід 2. Зміна забарвлення розчину індикатора фенолфталеїну в залежності від рН середовища Завдання: - Три пробірки заповнити на чверть дистильованою водою і розчинами сульфатної кислоти та натрій гідроксиду, відповідно. - У кожну з пробірок додати по 3-4 краплі розчину індикатора фенолфталеїну, перемішати розчини. - Занести спостереження у таблицю. Дослід 3. Визначення реакції середовища за допомогою індикатора метилового червоного Завдання: - У три пробірки налити по 5мл дистильованої води, додати по 3-4 краплі індикатора метилового червоного та внести на кінчику шпателя відповідні сухі солі: в першу – Na2CO3, в другу – CuSO4, в третю – NaCl. Вміст пробірок перемішати. - Занести спостереження у таблицю. - Навести іонні та молекулярні рівняння реакцій, зробити на їх основі висновки про рН розчинів відповідних солей. ________________________________________________________________________________________________________________________________________
Дослід 4. Визначення реакції середовища за допомогою індикатора фенолфталеїну Завдання: - У три пробірки налити по 5мл дистильованої води, додати по 3-4 краплі індикатора фенолфталеїну та внести на кінчику шпателя відповідні сухі солі: в першу – Na2CO3, в другу – CuSO4, в третю – NaCl. Вміст пробірок перемішати. - Занести спостереження у таблицю. - Навести іонні та молекулярні рівняння реакцій, зробити на їх основі висновки про рН розчинів відповідних солей. ________________________________________________________________________________________________________________________________________
Таблиця
Заняття 5. Основи титриметричного аналізу.
Мета (знати, вміти): – аналізувати принципи титриметричних методів дослідження; – вміти визначати кількісний вміст розчинів кислот і основ за допомогою методів кислотно-основного титрування. Основні поняття теми заняття: титриметрический аналіз, титрант, аналіт, точка еквівалентності, точка кінця титрування, індикатор. Література: Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [120-129]
Теоретичні питання: Основи титриметричного аналізу. Методи титриметричного аналізу. Метод кислотно-основного титрування. Кислотно-основні індикатори.
Тести та вправи до самостійної роботи: 1. Титрування – це процес: а) поступового додавання робочого розчину до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом; б) додавання буферного розчину та індикатору до проби з метою отримання забарвленого розчину; в) додавання розчину індикатору до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом; г) приготування розчинів з точно відомою концентрацією.
2. В основі титриметричних визначень лежить вимірювання об’єму: а) розчину аналіту; б) розчину титранту, розчину аналіту; в) буферного розчину; г) розчину індикатору.
3. Титрант (робочий розчин) – це: а) розчин, який титрують; б) розчин, молярну концентрацію еквівалента речовини якого визначають в процесі титрування; в) розчин, яким титрують; г) розчин з невідомою концентрацією.
4. Точка еквівалентності – це моменттитруванні, при якому: а) кількість титранту є еквівалентною кількості аналіту; б) маса доданого розчину титранта дорівнює масі розчину алаліту; в) молярна концентрація доданого розчину титранта дорівнює молярній концентрації розчину аналіту; г) кількість молів індикатору є еквівалентним кількості молів речовини в розчині, що титрується.
5. Якщо реагуючі речовини та продукти їх взаємодії безбарвні, то для встановлення точки еквівалентності візуальним методом у розчин аналіту додають: а) буферний розчин; б) індикатор; в) титрант; г) нічого не додають.
6. Для практичного здійснення об’ємно–аналітичного визначення необхідно: а) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єм титранту; б) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єми розчинів реагуючих речовин; в) мати розчин титранту, встановити точку еквівалентності, точно виміряти об’єми розчинів аналіту та індикатору; г) мати розчин титранту, точно виміряти об’єми розчинів реагуючих речовин та індикатору.
7. В об’ємному аналізі можна використовувати: а) будь–які хімічні реакції; б) тільки ті реакції, які відбуваються з достатньою швидкістю і проходять практично до кінця; в) тільки ті реакції, які відбуваються з достатньою швидкістю і зміною кольору розчину; г) тільки ті реакції, які проходять практично до кінця.
8. Бюретки – це: а) градуйовані скляні трубки, які використовують для відмірювання розчинів невеликими порціями або окремими краплями; б) спеціально градуйовані скляні трубки, один кінець яких відтягнутий, призначені для вимірювання та перенесення певного об’єму розчину з однієї посудини в іншу; в) кругла плоскодонна скляна посудина з довгою вузькою шийкою з кільцевою рискою, яка показує, до якого рівня необхідно наливати рідину; г) скляний стакан з позначками.
9. Яка кількість титранту витрачається при титруванні: а) рівна за об’ємом аналізованому розчину; б) надлишкова; в) менша, ніж об’єм розчину аналіту; г) еквівалентна кількості аналіту.
10. Вказати величину константи рівноваги для реакцій, які застосовуються в титриметричному аналізі: а) Кр < 1; б) Кр>>1; в) Кр<<1; г) Кр=1.
11. Вкажіть речовину, з якої можна приготувати стандартний розчин за точною масою цієї речовини: а) оцтова кислота; б) натрій гідроксид; в) сульфатна кислота; г) натрій тетраборат.
12. Вкажіть речовину, яка задовольняє вимогам до вихідної речовини: а) СН3СООН; б) Н2С2О4·2Н2О; в) AgNO3; г) HCl.
13. Різка зміна pH системи на кривій титрування в методі нейтралізації спостерігається поблизу точки еквівалентності. Ця ділянка називається: а) кінцем титрування; б) стрибком титрування; в) інтервалом переходу індикатору; г) немає спеціальної назви.
14. Вкажіть метод аналізу до якого належить титрування за реакцією
а) осаджувальне титрування; б) комплексонометрія; в) кислотно–основне титрування; г) оксидиметрія.
15. Який посуд промивають дистильованою водою перед проведенням титрування: а) мірну колбу; б) бюретку; в) колбу для титрування; г) мірний циліндр?
16. Розчин шлункового соку відтитровано розчином натрій гідроксиду з індикатором фенолфталеїном (рТ=9,0) до рожевого забарвлення. Чи правильний отримано результат: а) результат завищений; б) результат занижений; в) титрування неможливе; г) результат правильний?
17. Щавлеву кислоту відтитрували розчином КОН до нейтральної реакції. Чи отримали правильний результат: а) розчин недотитровано; б) правильний; в) розчин перетитровано; г) титрування неможливе?
18. Вкажіть систему, в якій точка еквівалентності відповідає кислому середовищу: а) HCl–NaOH; б) KOH–H2SO4; в) CH3COOH–NaOH; г) NH3∙H2O–HCl.
19. Вкажіть систему в якій титрування неможливе: а) Н2С2О4–NH4OH; б) NH3∙H2O–HCl; в) KOH–H2SO4; г) CH3COOH– NaOH.
20. Вкажіть інтервал переходу індикатору алізаринового синього, константа дисоціації якого дорівнює 10–12 моль/л: а) 10 – 13; б) 11 – 13; в) 10 – 12; г) 12 – 13.
21. Який фактор впливає на величину стрибка титрування: а) рТ індикатору; б) об’єм розчину, який титрують; в) інтервал переходу індикатору; г) вихідні концентрації аналіту та титранту?
22. Вкажіть титрант для визначення амоній гідроксиду: а) NaOH; б) Na2CO3; в) НСl; г) Na2С2О4.
23. Вкажіть фактор еквівалентності fекв оксалатної кислоти у реакції
а)
24. За якою формулою обчислюють молярну концентрацію еквівалента сульфатної кислоти згідно з даними титриметричного аналізу за реакцією
ЛАБОРАТОРНА РОБОТА №5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.3.198 (0.013 с.) |

 Со(NO3)2 ] = 0,4моль/л.
Со(NO3)2 ] = 0,4моль/л. ; д) Кв = lg
; д) Кв = lg  .
. (основи) <
(основи) < 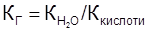 :
: в розчині трихлороцтової кислоти (
в розчині трихлороцтової кислоти ( ) з молярною концентрацією
) з молярною концентрацією 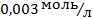 , якщо ступінь дисоціації електроліту 89%.
, якщо ступінь дисоціації електроліту 89%.
 та
та  для розчинів з молярною концентрацією вільних іонів H+
для розчинів з молярною концентрацією вільних іонів H+ 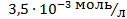 .
.
 ) з молярною концентрацією
) з молярною концентрацією  ; б) барій гідроксиду (
; б) барій гідроксиду ( ) з молярною концентрацією
) з молярною концентрацією  , якщо ступінь дисоціації електролітів 100%. Як зміниться
, якщо ступінь дисоціації електролітів 100%. Як зміниться  .
. 
 .
.
 , враховуючи, що ступінь дисоціації електроліту 100%.
, враховуючи, що ступінь дисоціації електроліту 100%. 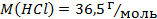 .
.
 .
.
 , враховуючи, що ступінь дисоціації електроліту 100%.
, враховуючи, що ступінь дисоціації електроліту 100%.  ) в водному розчині, якщо значення
) в водному розчині, якщо значення 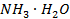 23%; густина розчину 0,998
23%; густина розчину 0,998  .
.
 в розчині, враховуючи, що ступінь дисоціації електроліту 100%.
в розчині, враховуючи, що ступінь дисоціації електроліту 100%.  , якщо
, якщо  ; б)
; б)  , якщо
, якщо 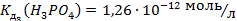 ; в)
; в)  , якщо
, якщо  .
.
 :
: :
: ; б) 1; в)
; б) 1; в) 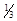 ; г)
; г)  .
. :
: ;
;
 ;
;
 ;
;
 ?
?
 . На титрування 10мл приготованого розчину
. На титрування 10мл приготованого розчину 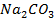 використано 10,2мл розчину
використано 10,2мл розчину  .
.  .
.
 . На титрування 10мл приготованого розчину
. На титрування 10мл приготованого розчину  використано 11,1мл розчину
використано 11,1мл розчину  .
. 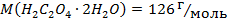 .
.
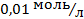 . Визначити: а) масу оцтової кислоти, що міститься в 20мл розчину; б) масу оцтової кислоти, що міститься в 1л розчину;
. Визначити: а) масу оцтової кислоти, що міститься в 20мл розчину; б) масу оцтової кислоти, що міститься в 1л розчину;  . Густина нашатирного спирту
. Густина нашатирного спирту  ;
; 


