
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вчення про розчини. Кислотно-основна рівновага біологічних рідин в організміСодержание книги
Поиск на нашем сайте
Розчин – це гомогенна (однорідна) система, яка складається з розчинника, розчинених речовин і продуктів їх взаємодії. За агрегатним станом розчини поділяються на рідкі і тверді (деякі мінерали, металічні сплави, пластмаси). За співвідношенням між розчинником і розчиненою речовиною розрізняють розчини ненасичені, насичені і перенасичені, а також розведені та концентровані. Розчин у якому речовина більше не розчиняється за даної температури, називається насиченим. Наприклад у воді масою 100 г при t=20 0С розчиняється хлорид натрію масою 36 г. Більше хлориду натрію в цьому розчині розчинитися не може, тобто маємо насичений розчин. Розчин у якому речовина ще може розчинитися за даної температури називається ненасиченим. Пересичені розчини – це нестабільні системи. Їх одержують шляхом повільного охолоджування насичених при більш високій температурі розчинів. Здатність речовин, змішуючись з іншою речовиною, утворювати гомогенні системи називається розчинністю. Основні поняття: Моль (ν) - кількість речовини, що містить стільки певних структурних частинок, скільки атомів міститься в 12 г С12 (Це число 6,02 • 1023). Молярна маса (М)- це маса 1 моля речовини.
ν - кількість молів речовини, m – маса речовини. На практиці молярну масу визначають виходячи із молекулярної формули речовини, як суму мас всіх атомів, які входять до складу молекули. Наприклад М(H2SO4) = 2*1+32+4*16=98 г/моль. Еквівалент (Е) в кислотно-основних реакціях - це умовна частина, яка може приєднати, заміщати чи якимось іншим способом взаємодіяти з одним молем йонів водню. Еквівалент в реакціях окиснення - відновлення - умовна частина, яка може приєднати чи віддавати один електрон. Число еквівалентності (z) - число, яке показує з кількома йонами водню може взаємодіяти дана речовина в кислотно-основних реакціях; або кількість прийнятих чи відданих електронів в окисно-відновних реакціях. Фактор еквівалентності (f) - число, яке показує, яка частка умовної частини речовини еквівалентна або реагує з одним йоном водню в даній кислотно- оcновній реакції чи з одним електроном в даній окисно-відновній реакції. Молярна маса еквівалента (М E ) - це маса одного моля еквівалентів даної речовини яку можна визначити як добуток фактора еквівалентності на молярну масу.
Для елементів z - валентність елементу M E = f .M = Наприклад для А1: M ( Для кислот: z - основність кислоти (кількість Н+, які заміщуються в даній реакції)
Для Н2SO4: М ( Для основ: z - кислотність основи (кількість ОН-)
Для Са(ОН)2: М( Для солей: z - добуток кількості атомів металу на їх валентність
Для Al2 (SO4)3: Концентрації розчинів можна виражати як через масу, так і за кількістю молів розчиненої речовини. Розрізняють такі основні способи вираження концентрації: 1). Масова частка (ω) - величина, що показує скільки грам розчиненої речовини міститься в 100 г розчину і виражається як відношення маси розчиненої речовини до маси розчину: m розчину = m розч.реч. + m розчинника
Виражають в безрозмірних одиницях, частках одиниці або у відсотках:
Для розчинів, які містять дуже мало розчиненої речовини можна виразити масову частку в проміле (‰) - тисячна частка цілого 1 ‰ = 0,1% 2). Молярна концентрація (См) – величина, що показує скільки молів розчиненої речовини знаходиться в 1 л розчину. Визначається як відношення кількості речовини (ν) до об’єму розчину:
визначається в моль/л чи моль/дм3 (в системі СI використовують розмірність моль/м3) враховуючичи, що
або якщо V вимірюється в мл, то 3). В об’ємних методах аналізу при титруванні, а також в науковій літературі використовують спосіб вираження концентрації – молярна концентрація еквівалентів, який в застарілій літературі зустрічається як нормальність (N). Молярна концентрація еквівалентів (СЕ) - це величина, що показує скільки еквівалентів розчиненої речовини міститься в 1 л розчину. Визначається як відношення кількості еквівалентів речовини до об’єму розчину.
або де V - об’єм розчину, мл m - маса розчиненої речовини, г. Виражають молярну концентрацію еквівалентів розчину в моль-екв./л, або в моль/л чи моль/дм3 .
|
|||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 586; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.35.234 (0.009 с.) |

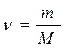 ,
, 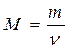

 [ г/моль ]
[ г/моль ] . М
. М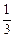 Аl)=
Аl)= 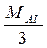 =
= 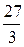 =9 г/моль
=9 г/моль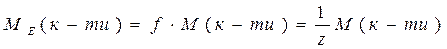
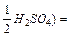
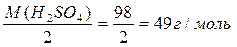
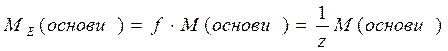
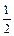 Са(ОН)2)=
Са(ОН)2)= 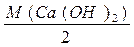 =
= 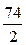 =37 г/моль
=37 г/моль
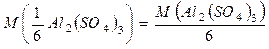 = 57 г/моль
= 57 г/моль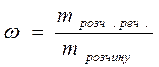

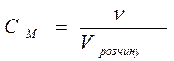
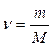
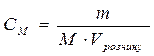
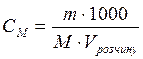
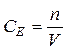
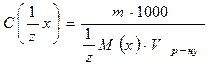
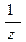 M(x) - молярна маса еквівалентів речовини х
M(x) - молярна маса еквівалентів речовини х


