
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розділ 9. Високомолекулярні сполукиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Високомолекулярними сполуками (ВМС), або полімерами, називають такі сполуки, відносна молекулярна маса яких становить від десятків тисяч до декількох мільйонів атомних одиниць маси. Тобто ВМС – це гігантські молекули, які складаються з великої кількості окремих характерних груп атомів (ланок), зв’язаних між собою ковалентними хімічними зв’язками. Клітини усіх тканин організмів та міжклітинна речовина, що зв’язує їх між собою, побудовані з ВМС – білків, нуклеїнових кислот, полісахаридів та змішаних біополімерів (глюкопротеїдів, ліпопротеїдів, гліколіпідів та ін.) Залежно від специфічних властивостей, біополімери виконують цілий ряд функцій: - каталізують біохімічні реакції (ферменти), регулюють реакції (гормони); - зберігають та передають генетичну інформацію (дезоксирибонуклеїнова кислота, ДНК); - є резервними поживними речовинами (крохмаль, глікоген); - захищають організм (антигенні полімери, цукор, камеді та слиз рослин); - виконують структурну та опорну функцію (колаген, фіброїн, каротин) Природні ВМС утворюються під час біосинтезу у клітинах живих організмів. Вони можуть бути вилучені з рослинної та тваринної сировини за допомогою фізико-хімічних методів - екстракції та фракційного осадження. Кількість ВМС на планеті зараз приблизно дорівнює ~1017 т., що у 2,5 рази перевищує запаси нікелю, хрому, міді, цинку, свинцю, срібла та золота разом узятих. Велике значення у медицині та фармації мають штучні полімери. З них виготовляють протези, корпуси та деталі кісток, які використовують у хірургії для заміни втрачених або ушкоджених органів. Штучні полімери використовують також для виготовлення деталей апаратів “штучна нирка”, “серце-легені”, апарата штучного кровообігу. Зокрема, в апаратах “штучна нирка”; штучного кровообігу з ВМС виготовляють мембрани, що селективно (вибірково) пропускають окремі компоненти крові. У фармації деякі полімери використовують як лікарські речовини та для виготовлення крово- і плазмозамінників (полівінілпіролідон, полівініловий спирт, та ін.). Деякі полімери мають властивість продовжувати дію лікарських речовин в організмі. Полімери є також допоміжними речовинами при виготовленні різних лікарських форм. Наприклад полівініловий спирт є основою водорозчинних мазей та стабілізатором розчинів, суспензій, емульсій і кровоспинних засобів. З полімерів виготовляють капсули для лікарських речовин, а також покриття та складову частину таблеток. З різних модифікацій природних полімерів (наприклад целюлоза) виготовляють бинти та вату з кровоспинними і антимікробними властивостями. ВМС володіють особливими властивостями, що визначаються структкрою макромолекул. Рівні структурної організації можна поділити на декілька груп з огляду збільшення їх розмірів та ускладнення структури. Усі макромолекули ВМС незалежно від будови мономерної ланки мають ланцюгову будову завдяки яким їм притаманні такі властивості, як еластичність, здатність утворювати міцні плівки, нитки, здатність до набухання та інші. Довжина частини ланцюга, у якому внаслідок сумарного обертання атомів здійснюється повне обертання, називається сегментом. Чим менша довжина сегмента, тим більша гнучкість ланцюга, тобто довжина сегмента є мірою гнучкості ВМС. Другою найбільш незвичайною властивістю ВМС є їх здатність до великих оборотних деформацій. Так можуть деформуватися тільки полімери з гнучкими макромолекулами, гнучкість яких обернена до довжини сегмента. Тому каучук, сегменти якого мають 15-20 ланок, оборотньо деформуються на кілька сотень відсотків, тоді як звичайні кристалічні речовини деформуються лише на кілька відсотків. Зі здатністю ВМС до великих деформацій пов’язані еластичність шкіри, м’язів, тканин живих організмів. Третя принципова особливість полімерів – дуалізм властивостей. Він зумовлений тим, що енергія ковалентних зв’язків мономерних ланок полімерного ланцюга значно більша за енергію усіх інших взаємодій, тобто взаємодій ланок полімеру з ланками інших макромолекул та з молекулами розчинника. Ця особливість полімерів обумовлює їх властивість орієнтуватись під дією навантаження і при цьому дуже зміцнюватися. Класифікація ВМС. За походженням: 1. Природні (біополімери) - це речовини, які мають надзвичайно важливе значення – білки, вуглеводи, нуклеїнові кислоти, складні пептиди. Вони утворюються в процесі біосинтезу в клітинах і є важливими складовими всіх живих організмів. 2. Синтетичні - одержують повним синтезом із низькомолекулярних речовин, отримуючи важливі сучасні матеріали – поліетилен, поліпропілен, синтетичні волокна – найлон, поліакрил і багато інших речовин. 3. Штучні - одержанні частковою переробкою природніх ВМС – це каучук, гутаперча, ацетат целюлози. За будовою макромолекул: 1. Лінійні – побудовані з довгих лінійних ланцюгів (каучук), або витягнутих послідовних циклів (целюлоза). 2. Розгалужені полімери – мають ланцюги з боковими розгалуженнями (крохмаль). 3. Сітчасті або просторові полімери – утворюють просторову сітку, яка утворюється при з’єднанні відрізків ланцюга хімічним зв’язком (фенол-формальдегідні смоли, епоксиди, вулканізований каучук.). За розміщенням в просторі навколо певних зв’язків: 1. Стереорегулярні – які складаються з однакових фрагментів ланок, молекули яких розміщенні в просторі в певному порядку (цис-, чи транс-), які регулярно повторюються з певною періодичністю. Це натуральний каучук (цис-ізомер) 2. Нестереорегулярні – в яких ланки чергуються довільно без певного порядку. За хімічним складом: 1. Гомополімери – утворенні з одного мономеру; 2. Співполімери – утворені по меншій мірі із двох різних мономерів; 3. Блокполімери – в яких чергуються великі елементарні ланцюги або блоки. В залежності від будови ланцюга: 1. Гомоланцюгові - утворені з одного виду атомів. Найчастіше карболанцюгові. 2. Гетероланцюгові (утворені ланцюги містять інші атоми елементів (N, Sі, Р) За способом одержання: 1. Полімеризаційні, тобто такі, які утворюються із мономерів без виділення низькомолекулярних побічних продуктів, за реакцією полімеризації:
О O || || R - Н, СН3, ОН, –C–OH, –С–NH3, –C≡N і ін. 2. Конденсаційні полімери, які утворюються при взаємодії мономерів, які мають різні функціональні групи, що здатні взаємодіяти між собою з виділенням низькомолекулярних продуктів (Н2О чи NH3). Наприклад: взаємодія між аміно- і карбоксильними групами.(Реакція поліконденсації).
диамін дикислота Дуже важливе значення мають біополімери утворені при взаємодії аміно- і карбоксильної групи, відомі як білки, що можна віднести до поліконденсаційних біополімерів, а зв’язок, що утворюється при цьому називається пептидним:
Інші біополімери – крохмаль чи целюлоза, утворюються за допомогою ефірних зв’язків через атом кисню при поліконденсації залишків молекул глюкози:
Біополімери відіграють важливу роль в процесах життєдіяльності живих організмів. Синтетичні полімери використовуються для виготовлення протезів, судин, суглобів, серцевих клапанів, вставних щелеп, зубних протезів і ін. Багато ВМС проявляють біологічну активність і використовують як замінники плазми крові (полівінілпіролідон, полівініловий спирт), для стабілізації лікарських препаратів. Значення властивостей ВМС дає ключ до розуміння багатьох фізіологічних процесів: запалення, утворення набряків, регенерації тканин і ін. Крім того, полімери можна поділити за відношенням до води на водорозчинні і водонерозчинні. ВМС можуть утворювати як істинні, так і колоїдні розчини. Характер розчину залежить від спорідненості ВМС до розчинника. В розчинниках, полярність яких відповідає полярності ВМС, проходить істинна розчинність з утворенням молекулярних розчинів (наприклад желатин у воді, чи каучук в неполярному розчиннику.) При невідповідності полярності розчинника і ВМС утворюються золі чи дисперсії. Істинному розчиненню полімерів передує процес набухання. Він полягає у збільшенні об’єму і маси полімерів за рахунок поглинання ним певної кількості розчинника. При контакті полімера з розчинником починається дифузія молекул в полімер, а макромолекул полімеру – в розчинник. Кількісною мірою набухання є ступінь набухання (α), яка може мати об’ємне або масове вираження:
де V0 і m0 – відповідно об’єм і маса вихідного, а V і m – набухаючого полімеру. В залежності від структури полімеру і температури – набухання може бути обмеженим і необмеженим (рис 9.1).
υ 1
υ0
Рис 9.1. залежність необмежаного і обмежаного набухання При необмеженому набуханні (крива 1) α досягає граничного значення, після чого набухання не залежить від часу (так набу хає желатин в холодній воді або гума в бензолі). Для обмежаного набухання характерна залежність (крива 2), що проходить через максимум, після чого падає до нуля в результаті поступового розчинення полімеру (желатин в гарячій воді). Обмеженість чи необмеженість набухання залежить від співвідношення енергії зв’язку в полімері з енергією сольватації і ентропійним фактором. В лінійних і розгалужених полімерах макромолекули зв’язані слабкими ван-дер-вальськими силами, енергія цих сил невелика, тому енергія сольватації і ентропійний фактор вже при кімнатній температурі перевищують їх. При таких умовах набухання йде необмежено. Якщо між ланцюгами полімеру є хімічні зв’язки, то для їх розриву недостатньо енергії сольватації і ентропійного фактора. Набухання проходить обмежено і полімер перетворюється в студень. Тиск набухання. При набуханні полімерів їх об’єм збільшується в 10-15 раз. Виникає тиск набухання, який досягає іноді сотень мегапаскаль, особливо при поглинанні полімером перших порцій розчинника (3-5% маси), потім він зменшується, а при досягненні рівноваги між полімером і розчинником падає до нуля. Тиск набухання можна визначити рівнянням Галлера:
П – осмотичний тиск; С – концентрація; К – коефіцієнт, що враховує відхилення розчину ВМС від ідеального розчину і залежить від природи розчинника і розчиненого ВМС. К зростає із збільшенням ланцюга полімера. За цією формулою, вимірявши осмотичний тиск, можна знайти молекулярну масу ВМС. Осмотичний тиск біологічних рідин залежить від розчинених в них НМС і ВМС, головним чином білків. Неможливість проникнення білка через клітинну мембрану обумовлює явище осмосу, тобто переміщення молекул води через мембрану в розчин білка. Частина осмотичного тиску, обумовленого ВМС, в основному білками, називається онкотичним тиском, який невеликий і складає всього 0,5% від загального осмотичного тиску, і становить 3,5-3,9 кПа. На ступінь набухання полімеру впливають такі фактори: природа розчинника та полімеру, температура, тиск, рН середовища, сторонні речовини, особливо електроліти, ступінь дисперсності полімеру, вік. Температура і тиск впливають на ці процеси за принципом Ле-Шательє. Якщо набухання супроводжується виділенням теплоти, то з підвищенням температури ступінь набухання змешується, але швидкість набухання зростає із збільшенням швидкості дифузії. Вплив рН середовища на набухання добре вивчений для білків. Амінокислоти та білки у водних розчинах знаходяться у формі біополярних йонів:
В кислому середовищі, коли є надлишок йонів Н+, молекула білка має позитивний заряд.
В лужному середовищі, навпаки зменшується йонізація аміногруп і молекула білка поводиться як кислота, тобто має заряд від’ємний:
Таким чином, заряд білка залежить від співвідношення в його молекулах карбоксильних та аміногруп і від рН середовища. Значення рН розчину білка, при якому білок стає електронейтральним називають ізоелектричною точкою даного білка. При цьому значенні рН протилежно зарядженні групи – NH3+ і –СОО - притягуються одна до одної і молекула закручується у спіраль. При зміщенні рН від ізоелектричної точки однойменні заряди відштовхуються і молекула розпрямляється. В ізоелектричній точці набухання мінімальне, а зміна рН в кислий чи лужний бік приводить до зростання ступення набухання:
ізоелектрична точка Рис 9.2 Залежність ступення набухання білку від рН Вплив електролітів на набухання полягає в тому, що аніони нейтральних солей діють на структуру розчинника – воду. Аніони SCN->J->Br->NO3->CI - руйнують структуру води і сприяють набуханню, в той час як аніони SO42->CH3СOO->CI- наближають структуру води до структури льоду (затримують набухання). Цей ліотропний ряд можна записати так: СNS->J->Br->NO3->CI>CH3COO->SO42 - Де йон СІ - займає нейтральне положення і не впливає на набухання. Ізоелектрична точка є важливою характеристикою білків. Її можна визначити: 1. за електрофоретичною рухливістю – тобто піддати електрофорезу в буферних розчинах з різним значенням рН. В ІЕТ при рН =ІЕТ білок електронейтральний і в електричному полі не переміщується; 2. за швидкістю желатинування – в буферні розчини з різним значенням рН вносять концентрований розчин досліджуваного білка. Желатинування пройде найшвидше в розчині рН =ІЕТ. Процес можна спостерігати візуально; 3. за величиною набухання – однакові кількості білка вносять в ряд пробірок до яких доливають рівні об’єми буферів з різними значеннями рН. Найменше набухання в ІЕТ. Присутність в організмі білків, відокремлених клітинною мембраною від розчинів електролітів, приводить до перерозподілу йонів електролітів і відповідно впливає на осмотичний тиск по обидва боки мембрани. Перерозподіл електролітів описується рівнянням рівноваги, яке вивів Доннан. Суть його в тому, що клітина, яка знаходиться в розчині електроліту (NaCI), а всередині клітини білок у вигляді солі, його йони не дифундують через мембрану. PtNaz=Pt- + zNa+ де z – валентність молекул білка. При контакті клітини з розчином в клітину, внаслідок дифузії, переходить деяка кількість відсутніх там йонів СІ- (Х), за ними в клітину перейдуть йони Na+ Рівняння Доннана:
де Св =[ Na +]=[ CI -] – концентрація всередині клітини. Сз =[ Na +]=[ CI -] – концентрація зовні клітини. Можливі 3 варіанти: 1. Якщо до початку перерозподілу концентрація йонів ззовні були більшою, ніж всередині клітини Сз>>Св, то в рівнянні Доннана в знаменнику можна знехтувати величиною Св тоді:
тобто всередину клітини перейде половина йонів електроліту з навколишнього середовища. Електроліт розподілиться порівну між зовнішнім і внутрішнім середовищем системи. 2. Якщо до перерозподілу концентрація в середині була значно більша, ніж зовні, тобто Св<<Сз, то в рівнянні Доннана в чисельнику буде мала величина. При діленні одержимо ще меншу величину. 3. Якщо Св=Сз, то рівняння Доннана набуде вигляду:
Ефект Доннана, тобто нерівномірне розподілення електролітів між клітиною і рідиною, що їх оточує, впливає на життєдіяльність клітин, на величину біопотенціалів, тощо. Специфічною властивістю розчинів ВМС є те, що вони проявляють аномальну в’язкість: вона дуже висока і на відміну від істинних розчинів, зменшується із збільшенням тиску на текучу рідину. Висока в’язкість розчинів ВМС пояснюється їх високою гідрофільністю: сили взаємодії гідрофільних молекул і полісахаридів з молекулами води дуже великі і їх в’язкість навіть у дуже розбавлених розчинах залишається високою. На в’язкість впливає форма молекул. Якщо лінійні частинки розміщені впоперек потоку, то вони протидіють витіканню рідини. При збільшенні зовнішнього тиску ці частинки орієнтуються вздовж потоку і в’язкість зменшується. На в’язкість білків впливає рН розчину. Найменшу в’язкість білки мають в області ізоелектричної точки, тому що в цій точці макромолекули білків утворюють найбільш щільні клубки. Ці клубки чинять найменший опір потоку рідини, зі збільшенням чи зменшенням рН в’язкість розчинів білків зростає. Розчини ВМС є термодинамічно стійкими. Стійкість їх обумовлена: 1. наявністю гідратної (сольватної) оболонки. Гідрофільність природних ВМС, в тому числі білків, обумовлена присутності в молекулі великого числа йоногенних груп: -СООН, NH2, >C=O, -OH, -SH, -CO-NH-, і інші до яких притягуються полярні молекули води, утворюючи навколо них суцільну гідратну оболонку, яка стабілізує молекулу ВМС. 2. електричним зарядом, який виникає в результаті йонізації функціональних груп молекул ВМС. Для руйнування цих систем необхідно зменшити спорідненість ВМС до розчинника шляхом послаблення або видалення сольватних (гідратних) оболонок. Це можна зробити додавши десольватуючих реагентів, наприклад електролітів. При додаванні електролітів до розчину ВМС відбувається десольватація макромолекул, зменшення їх розчинності і виділення останніх із розчину. Це явище називається висолюванням. Механізм висолювання полягає в тому, що йони солей притягують до себе молекули води, яка взаємодіє з полімером. Так як розчинність білків залежить від утворення гідратної оболонки навколо йоногенних груп, то переміщення їх до йонів солей знижує розчинність білка і він випадає в осад. Найкраще висолювання йде в ІЕТ. Застосовуючи розчини солей різної концентрації, можна послідовно розділити білки на фракції. Спочатку осаджуються білки з великою молекулярною масою, а при великих концентраціях солей – осідають найлегші фракції. Висолювання з водних розчинів можна проводити органічними розчинниками (ацетон, етанол і ін.). висолювальна дія не зв’язана з зарядом йону, а визначається його дегідратуючою здатністю. Висолююча дія йону тим більша, чим більший ступінь його гідратації. Висолююча дія аніонів відображається рядом:
Меншаі висолююча дія катіонів:
Коацервація - це процес змішування водних оболонок ВМС без об’єднання самих частинок. Цей процес може відбуватись під впливом зміни температури, рН або при додаванні НМР. Це своєрідна форма коагуляції ВМС. Вона відрізняється від висолювання тим, що речовини дисперсної фази не відділяються від розчинника, а збираються у краплини, які поступово зливаються у більші краплини. Процес закінчується розшаруванням системи. Шар, що вміщує всю ВМС називать коацерватом. Між коацерватами існують тонкі гідратні оболонки і тому цей процес оборотній. Коацервація відіграє важливу роль в біологічних процесах, що відбуваються в протоплазмі. Драглі і драглювання. Здатність розчинів ВМС втрачати текучість і переходити в гелі (драглі) – називається драглюванням. 2 способи утворення драглів: 1. драглювання, тобто утворення просторової сітки за рахунок взаємодії між молекулами. Можливе утворення хімічних зв’язків. 2. обмежене набухання полімеру в розчиннику. Підвищення температури перешкоджає драглюванню, і найкраще драглювання йде при рН близьких ІЕТ, тому що сумарний заряд молекул мінімальний (~ 0), що полегшує виникнення між ними зв’язків різної природи. Специфічні властивості драглів: 1. тіксотропність – здатність гелів оборотно переходити при механічній дії в розчин і повертатись назад у драглі в стані спокою. 2. синерезис – самовільне виділення із драглів розчинника у вигляді окремої рідкої фази. Сам гель зменшується в об’ємі і стає менш прозорим. Синерезис розвивається і в живих клітинах.
ЗАНЯТТЯ № 19 Тема: Властивості розчинів біополімерів. Ізоелектрична точка білка. Актуальність теми: Високомолекулярні сполуки (ВМС) займають важливе місце серед речовин, які відіграють важливу роль в організмі. Це природні ВМС – білки, нуклеїнові кислоти, полісахариди. Широкого застосування набули синтетичні та штучні ВМС, які одержують полімеризацією, поліконденсацією чи хімічною обробкою природних ВМС. Розчини ВМС, містять макромолекули, за розмірами частинок можна віднести до колоїдних (однак ВМС не є міцелами). Знання особливостей розчинів ВМС дозволить розуміти процеси, що протікають в організмі, застосовувати їх в лікувальних цілях. Навчальні цілі: Знати: способи одержання, класифікацію, властивості ВМС та їх розчинів. Вміти: визначати ізоелектричну точку білків, ступінь набухання, визначати стійкість ВМС до електролітів та захисну дію розчинів ВМС. Самостійна позааудиторна робота студентів. 1. Класифікація ВМС за походженням, методами одержання, відношенню до розчинників. 2. Приклади одержання ВМС методом полімеризації. 3. Приклади одержання ВМС методом поліконденсації. 4. Властивості розчинів ВМС. 5. Фактори стійкості ВМС в розчині. 6. Структура і форма макроиолекул, типи зв’язків між ними. 7. Набухання і розчинення полімерів. 8. Фактори, які впливають на набухання. 9. Обмежене і необмежене набухання. Ступінь набухання. 10. Ізоелектрична точка білків. Набухання і в’язкість в ІЕТ. 11. Синтетичні полімери, які застосовуються в стоматології. Контрольні питання. 1. Класифікація високомолекулярних сполук за походженням.Приклади. 2. Класифікація високомолекулярних сполук за способом одержання. 3. Навести приклади реакції полімеризації. 4. Навести приклади реакції поліконденсації. 5. Класифікація за структурою головного ланцюга. 6. Що таке мономери? Привести приклади. 7. Що таке ступінь набухання полімеру? 8. Роль води при розчиненні ВМС.Характерні зв’язки в макромолекулах білків. 9. Характерні зв’язки в макромолекулах полісахаридів. 10. Чим обумовлюється гнучкість ВМС? 11. Вплив електролітів на розчини ВМС. 12. Що таке драглі? 13. Що таке тіксотропія? 14. Що таке синерезис? 15. Білок плазми крові (альбумін) має молекулярну масу 69000. Розрахуйте осмотичний тиск розчину, який містить 2 г цього білка у 100 мл розчину при 25оС. 16. Білок масою 10 г занурили у воду і через певний час після набухання витягнули і зважили. Маса білка після набухання була 16 г. Визначити ступінь набухання білка.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 555; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.016 с.) |





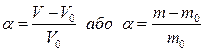
 α
α


 t
t



 α
α












