
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язування задач за темою «Розчини»Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Задача 1. У воді об'ємом 400 мл розчинили сіль масою 80 грам. Визначте відсоткову концентрацію солі в розчині. Розв’язок: 1. Визначимо масу води: m(Н2О)= V • С = 400 • 1 = 400(г). 2. Визначимо масу розчину: mрозчину= m(Н2О) + mречовини = 400 + 80 = 480(г). 3. Розрахуємо відсоткову концентрацію солі в розчині: Задача 2. Скільки глюкози і води необхідно взяти для приготування 500 г 5% розчину для ін'єкцій. Розв’язок: 1. Знайдемо масу глюкози: 2. Знайдемо масу води: m (Н2О)= mрозчину – m(Н2О)= 500 – 25 = 475 г.
Задача 3. Яку масу хромату калію K2CrO4 потрібно узяти для приготування 1,2 л 0,1 М розчину? Розв’язок: m(K2CrO4) = С(K2CrO4) • V • M(K2CrO4)= 0,1 моль/л • 1,2 л • 194 г/моль 23,3 г. Відповідь: Таким чином, для приготування 1,2 л 0,1 М розчину потрібно взяти 23,3 г K2CrO4 і розчинити у воді, а об'єм довести до 1,2 літрів. Задача 4. Скільки хлороводню міститься в шлунковому соку об'ємом 2 літри, якщо молярна концентрація НCl в шлунковому соку дорівнює 0,1 М. Розв’язок: 1. Знайдемо молярну масу НCl: М(HCl)= 1 + 35,5 = 36,5 ( г/моль) 2. Знайдемо масу НCl: m(HCl)= C•M•V = 0,1•36,5•2 = 7,3(г).
Задача 5. Визначити молярність розчину сірчаної кислоти з відсотковою концентрацією 9,8 % (ρ = 1,18 г/мл). Розв’язок: (1 спосіб) 1. Визначимо масу 1 літра розчину кислоти: m розчину = ρ • V = 1,18•1000=1180 г 2. Визначимо кількість молей кислоти в розчині: 3. Знайдемо кількість моль кислоти в 1 літрі розчину, тобто молярність розчину:
Розв’язок: (2 спосіб)
Задача 6. Розрахуйте молярну концентрацію і нормальність 70%-вого розчину H2SO4 (ρ = 1,615 г/мл). Розв’язок: Для обчислення молярності і нормальності треба знати число грамів H2SO4 в 1 л розчину. 70% -ний розчин H2SO4 містить 70 г H2SO4 в 100 г розчину. 1) Ця вагова кількість розчину займає об'єм 2) Отже, в 1 л розчину міститься: 3) Звідси, молярність даного розчину дорівнює: 4) Нормальність цього розчину (вважаючи, що кислота використовується в реакції як двоосновна) дорівнює: Приклад перерахунку концентрації розчину, вираженої в масових частках на молярну концентрацію. Яка молярна концентрація розчину питної соди, якщо його масова частка 2,5%, а густина 1,02 г/см3? Розв’язування задач здійснюється послідовною відповіддю на поставлені питання: 1) Що необхідно знайти? 2) Що дано в умові для цього? Питна сода - це гідрокарбонат натрію NaHCO3. Молярну концентрацію розчину визначють як кількість молів речовини в 1 л розчину Отже, для того, щоб розв’язати цю задачу необхідно визначити кількість молів розчину ν= В умові задачі дано, що ω =2,5 %. Якщо розчин має масову частку 2,5 %, то це означає, що в 100 г розчину міститься 2,5 г соди. Отже, можна прийняти, що m (NаНСОз) =2,5 г, а m розчину =100 г. Знайдемо кількість молів соди: M(NаНСОз) = 23+1+12+3.16= 84 г/моль ν = Знайдемо об’єм 100 г розчину використовуючи, що ρ = V= Отже, тепер можна визначити молярну концентрацію розчину:
Задачу можна розрахувати іншим способом: Масова частка цього розчину:
Молярна концентрація цього розчину:
Знайшовши із рівності (1) m(NaHCO3) і підставивши її у рівність (2), одержимо:
Проведемо обчислення:
Заняття №5 Тема: Розчини. Виготовлення розчинів заданої масової і молярної концентрацій. Актуальність теми: Розчини відіграють дуже важливу роль у різних процесах, у тому числі у життєдіяльності організмів, у техніці і побуті. В медичній практиці розчини використовують для діагностики, лікування, заміни втраченої крові, для наукових досліджень. Використання розчинів різної концентрації в лікарській практиці вимагає знання способів вираження концентрацій розчинів і вміння приготувати розчини необхідної концентрації для практичного використання. Навчальні цілі: Знати: основні положення про розчини і способи визначення концентрації розчинів. Вміти: розрахувати необхідну кількість компонентів і приготувати розчини з заданою масовою часткою, молярною концентрацією та молярною концентрацією еквівалентів. Самостійна позааудиторна робота студентів 1. Розрахувати число еквівалентності та молярну масу еквівалентів для Н2SO4, NaОН, Na2СО3, Н3РО4, Na2SО4, Н3ВО3, Са3(РО4)2, Н2SiO3, Аl2(SО4)3 в реакціях, які йдуть до кінця. 2. Масова частка соляної кислоти в шлунковому соці дорівнює 0,5 % (r =1,007 г/см3). Обчислити молярну концентрацію еквівалента НCl в шлунковому соці. 3. Який об¢єм фізіологічного розчину NaCl (0,9 % розчин, r=1,0 г/см3) можна одержати із ампули фіксаналу (0,1 моль). 4. Яку масу кристалічної соди (Na2СО3.10Н2О) потрібно взяти для приготування 200 мл розчину з молярною концентрацією еквівалентів 0,2? Контрольні питання. 1. Основні поняття про розчини, їх роль в живих організмах. Розчинники, розчинена речовина. 2. Механізм розчинення речовин. 3. Фактори, що визначають розчинність речовини. 4. Розчини насичені, ненасичені і пересичені; розведені і концентровані. 5. Основні способи вираження концентрації розчинів: а) масова частка; б) молярна концентрація; в) молярна концентрація еквівалентів; г) моляльна концентрація. Приклад завдань для тестового контролю: 1. Молярна маса еквіваленту сульфату амонію в реакціях обміну рівна (в г/моль); а. 114; б. 57; в. 342; г. 171; 2. Хлорид натрію розчиняється у воді і не розчиняється в бензолі. Це пояснюється: а. різною природою хімічного зв’язку у молекулах води і бензолу; б. різною густиною води і бензолу; в. різними ступенями окиснення атомів гідрогену у воді і у бензолі; г. різними молярними масами у води і бензолу. 3. Який фактор еквівалентності для сполуки хлориду барію: а). 1/1; б). ½; в). 1/3; г). ¼. 4. Для приготування 200г розчину гідрокарбонату натрію з масовою часткою 1,5 % потрібно: а). 2,5 г Na2CO3 і 197,5 г дист. води; б). 3 г NaHCO3 і 197 дист води; в). 3,5 г NaHCO3 і 196,5 г дист води; г). 5 г Na2CO3 і 195 г. 5. Встановити титр розчину, в 250 мл якого розчинено 3,6 г хлориду барію. Яка молярна концентрація еквівалентів солі в цьому розчині? а). 0,1441г/см3; 0,282 моль-екв/л; б). 0,1441г/см3; 0,280 моль-екв/л; в). 0,1444г/см3; 0,442 моль-екв/дм3; г). 0,0144г/см3; 0,141 моль-екв/дм3;
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1299; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.007 с.) |


 г
г (моль)
(моль)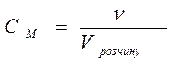
 М.
М. М.
М. мл
мл г (H2SO4)
г (H2SO4) M (моль/л)
M (моль/л) H (моль-екв/л)
H (моль-екв/л)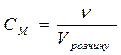
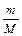 і об’єм розчину V.
і об’єм розчину V.
 =0,03 моль NаНСО3
=0,03 моль NаНСО3 звідки:
звідки: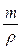 = 100 г: 1,02 г/см3 = 98,04 см3 = 0,098 л
= 100 г: 1,02 г/см3 = 98,04 см3 = 0,098 л
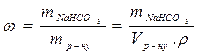 (1)
(1) (2)
(2)





