
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Класифікація реакцій в органічній хіміїСодержание книги
Поиск на нашем сайте Органічні сполуки здатні до різних хімічних перетворень, які можуть проходити як без зміни вуглецевого скелету, так і з таким. Більшість реакцій проходить без зміни вуглецевого скелету. 1) заміщення (S): RH + Br2 → RBr + HBr 2) приєднання (A): CH2=CH2 + Br2 → CH2Br – CH2Br 3) відщеплення (E): CH3–CH2–Cl → CH2=CH2 + HCl
Реакції заміщення характерні для всіх класів органічних сполук. Заміщатися можуть атоми водню або атоми будь-якого іншого елементу, окрім карбону. Реакції приєднання характерні для сполук з кратними зв'язками, які можуть бути між атомами вуглецю, вуглецю і кисню, вуглецю і азоту і т. д., а також для сполук, що містять атоми з вільними електронними парами або вакантними орбіталями. До реакцій відщеплення здатні сполуки, що містять електронегативні групи. Легко відщеплюються такі речовини, як вода, галогеноводні (HCl), аміак (NH3). Насичені вуглеводні (АЛКАНИ) Насичені вуглеводні – це аліфатичнісполуки, в яких атоми вуглецю сполучені одинарними зв'язками, а всі інші валентності насичені атомами водню. Загальна формула алканів CnH2n+2. Назви алканів утворилися від грецьких і латинських числівників з додаванням суфікса –ан. Найпростішим насиченим вуглеводнем є Мет ан:
Гомологічний ряд алканів Алкани утворюють гомологічний ряд. Перший член гомологічного ряду – метан (СН4), тому алкани називають гомологами метану. Гомологи – це речовини, які мають однакову будову, але відрізняються один від одного на одну або декілька груп -СН2-.
Якщо у молекули вуглеводню відняти один атом водню, то одержимо один одновалентний залишок – радикал (алкіл). Назви радикалів утворюються від назв відповідних вуглеводнів з заміною суфікса –ан на –ил (іл.). Наприклад: метан СН4 → мет ил СН3-; пропан С3Н8 → проп іл С3Н7-. Будова молекули Метану Електронна будова атома вуглецю: 1s22s22p2 6С збуджений стан
sp3- ГІБРИДИЗАЦІЯ характерна для атомів вуглецю в насичених вуглеводнях (алканах) – зокрема, в Метані.
Рис.2. Утворення молекули Етану за рахунок перекривання двох гібридних електронних хмар атомів вуглецю. Ізомерія Перші алкани в гомологічному ряді – метан, етан, пропан – не мають ізомерів. Четвертий – Бутан C4H10 має два ізомери: ● з нерозгалуженим вуглецевим ланцюгом
● з розгалуженим ланцюгом
Ізомерія, при якій речовини відрізняються одна від одної порядком зв'язку атомів в молекулі, називається СТРУКТУРНОЮ або ізомерією вуглецевого скелету. Фізичні властивості У звичайних умовах перші чотири алкани – гази, C5–C17 – рідини, а починаючи з C18 – тверді речовини. Таким чином, із збільшенням молекулярної маси підвищується густина алканів, збільшується температура плавлення і кипіння. Всі алкани легші за воду, в ній не розчиняються, але розчиняються в органічних розчинниках. Хімічні властивості Оскільки зв’язки С-Н в насичених вуглеводнях міцні, їх важко розірвати, то для алканів найбільш характерні реакції заміщення водневих атомів, а також реакції розщеплення С-С зв’язку, окиснення та ізомеризації. · Реакції заміщення: 1) галогенування. Алкани легко реагують з галогенами, крім йоду. Реакція проходить при УФ-опроміненні або нагріванні (300°С) за ланцюговим вільно радикальним механізмом. CH4 + Сl2 − һν g CH3Сl + HСl хлорметан CH3Сl + Сl2 − һν g CH2Сl2 + HСl дихлорметан CH2Сl2 + Сl2 − һν g CHСl3 + HСl трихлорметан CHСl3 + Сl2 − һν g CСl4 + HСl тетрахлоретан Тетрахлорметан – продукт повного хлорування метану (всі чотири атоми водню замістилися на атоми хлору. У ланцюговому процесі виділяють три стадії:
2) нітрування (реакція Коновалова). Під дією розбавленої нітратної кислоти атоми водню в алканах заміщаються на нітрогрупу: C3H7−Н + НО−NO2 g C3H7−NO2 + H2O пропан нітропропан · Реакції відщеплення: 3) крекінг – розпад алканів при високій температурі та присутності каталізаторів (утворюються насичені і ненасичені вуглеводні з більш короткими ланцюгами). CH3–CH2–CH2–CH3 − 400° g CH3–CH3 + CH2=CH2 бутан етан етилен 2CH4 − 1500° g H–C≡C–H + 3H2 метан ацетилен 4) дегідрогенізація – реакція відщеплення водню від молекули органічної сполуки в присутності каталізатора, що веде до утворення подвійного або потрійного зв’язку: CH3–CH2–CH2–CH3 − t°,кат g CH3–CH=CH–CH3 бут ан бут ен · Реакції окиснення: В звичних умовах алкани стійкі до дії кисню і окисників. 5) горіння на повітрі CH4 + 2O2 − полум’я g CO2↑ + 2H2O, ∆Н = -890 кДж/моль вуглекислий вода газ Якщо реакція відбувається при недостачі кисню, то утворюється продукт неповного горіння карбон (ІІ) оксид. CH4 + O2 − t° g CO + 2H2O чадний газ вода 6) ізомеризація. При нагріванні в присутності каталізаторів у вуглеводнях нормальної будови відбувається перебудова вуглецевого скелету з утворенням алканів розгалуженої будови:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 565; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.008 с.) |




 ––† 6С*
––† 6С* 
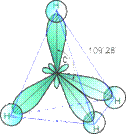 При "змішуванні" чотирьох орбіталей збудженого атома вуглецю (однієї 2s- і трьох 2p- орбіталей) утворюються чотири рівноцінні sp3- гібридні орбіталі.
При "змішуванні" чотирьох орбіталей збудженого атома вуглецю (однієї 2s- і трьох 2p- орбіталей) утворюються чотири рівноцінні sp3- гібридні орбіталі. Рис.1. Схема електронної будови молекули Метану
Рис.1. Схема електронної будови молекули Метану (нормальний Бутан)
(нормальний Бутан) Ізобутан (2-метил-пропан)
Ізобутан (2-метил-пропан)
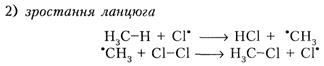

 пентан
пентан
 2- метилбутан
2- метилбутан



