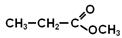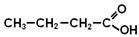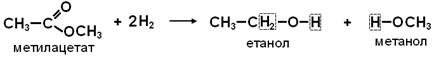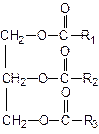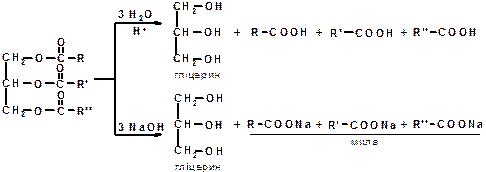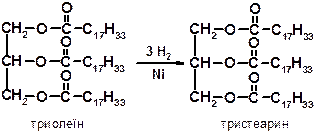Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дикарбоновимі кислотами називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи.Содержание книги
Поиск на нашем сайте НО– У номенклатурі дикарбонових кислот застосовують тривіальні назви. За номенклатурою ІЮПАК назви дикарбонових кислот утворюють з назв відповідних вуглеводнів з додаванням префікса – ди -, суфікса – ова і слова кислота. COOH ½ етандіова кислота (щавлева кислота) COOH Ізомерія дикарбонових кислот обумовлена різною структурою вуглецевого скелету. Одержують дикарбонові кислоти тими ж методами, що і монокарбонові, використовуючи як початкові речовини біфункціональні сполуки. За хімічними властивостями дикарбонові кислоти схожі до монокарбонових, але утворюють два ряди похідних (дисоціюють ступінчасто – утворюють солі кислі і середні, естери повні і неповні, галогенангідриди та аміди). Крім того, дикарбонові кислоти проявляють ряд специфічних властивостей: а) при нагріванні декарбоксилюються по одній карбоксильній групі і перетворюються на монокарбонові; б) починаючи з янтарної кислоти при нагріванні утворюють циклічні ангідриди (янтарний та глутаровий, у випадку нагрівання гександіової кислоти - циклопентанон). Ненасичені дикарбонові кислоти містять в своєму складі дві карбоксильні групи і кратний вуглець-вуглецевий зв'язок. Представниками даних кислот є малеїнова і фумарова кислоти, які є геометричними цис- і транс- ізомерами. Так, малеїнова і фумарова кислоти відрізняються розташуванням карбоксильних груп відносно площини, яка проходить через середину π-звязку.
Геометричні ізомери: а) малеїнові кислота (цис-ізомер), б) фумарола кислота (транс-ізомер) За хімічними властивостями ці кислоти схожі до насичених мононокарбонових кислот і ненасичених вуглеводнів. Ароматичні дикарбонові кислоти містять дві карбоксильні групи безпосередньо сполучені з ароматичним ядром. Найважливішими представниками є фталева кислота і її ізомери. ЕСТЕРИ (СКЛАДНІ ЕФІРИ) – це сполуки, що складаються із залишку карбонової кислоти і спирту. Загальна формула СnH2nO2 – або Номенклатура Естери можна розглядати як похідні кислот, в яких атом гідрогену заміщений на радикал. Назву естеру записують одним словом: • естери, утворені мінеральними кислотами
• естери, утворені спиртами та карбоновими кислотами
Види ізомерії 1) Ізомерія карбонового скелету.
2) Міжкласова ізомерія (з карбоновими кислотами).
Фізичні властивості Естери нижчих карбонових кислот та спиртів – леткі рідини, мають приємний фруктовий запах, малорозчинні у воді, добре розчинні в органічних розчинниках, легкозаймисті, на повітрі горять з утворенням СО2 і Н2О. Між молекулами естерів відсутній водневий зв'язок. Наприклад, метилпентаноат має запах вишень, метилетаноат – рому, етилпентаноат – бананів, бутилетаноат – абрикосів, бутилбутаноат – ананасів, ізопентилетаноат – яблук. Естери вищих карбонових кислот та спиртів – високомолекулярні речовини. Наприклад, бджолиний віск складається з мірицилпальмітату С15Н31СООС31Н63. Поширення в природі. Містяться у квітах, фруктах, ягодах, визначають їх специфічний запах. Бджолиний віск переважно складається із складних ефірів вищих жирних кислот і високомолекулярних одноатомних спиртів. Одержання Реакція ЕСТЕРИФІКАЦІЇ – кислота + спирт.
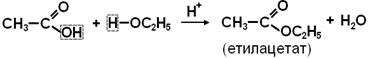
Хімічні властивості 1. ГІДРОЛІЗ (в кислому середовищі) або ОМИЛЕННЯ (в лужному середовищі). Ця реакція є зворотною до реакції ЕСТЕРИФІКАЦІЇ. Гідроліз у кислому середовищі оборотний.
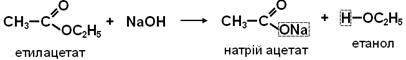
У лужному середовищі утворюється сіль і гідроліз стає необоротним.
2. ГІДРУВАННЯ - взаємодія з воднем:
Застосування 1. Як розчинник для лаків і фарб. 2. Для виготовлення штучних фруктових есенцій та ароматизаторів. 3. У виробництві парфумів. 4. У виробництві вибухових речовин. ЛІПІДИ (ЖИРИ)
Класифікація Ліпіди ділять на омилювані і неомилювані залежно від здатності до гідролізу. Утворюють в лужному середовищі (рН>7) солі вищих жирних кислот (ВЖК). НЕОМИЛЮВАНІ ліпіди однокомпонентні. ОМИЛЮВАНІ ліпіди можуть бути дво компонентними (ПРОСТІ ліпіди) або складатися з трьох і більше компонентів (СКЛАДНІ ліпіди). Тобто при гідролізі вони утворюють органічні сполуки відповідно двох, трьох і більше класів. ПРОСТІ ліпіди – це складні ефіри вищих жирних кислот і спиртів (гліцерину), які під час гідролізу (кислотного або ферментативного) утворюють спирт і вищі жирні кислоти (С16-С24). Номенклатура
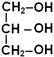
Насичені жирні кислоти входять до складу твердих (тваринних) жирів (баранячий, яловичий): C17H35COOH (C18:0) - стеаринова кислота: С15H31COOH (C16:0) - пальмітинова кислота Ненасичені жирні кислоти входять до складу рідких (рослинних) жирів, які називають оліями, наприклад: оливкова, соєва, арахісова, соняшникова тощо. C17H33COOH – олеїнова кислота C18:1 CH3-(CH2)7-CH=CH-(CH2)7-COOH C17H31COOH – лінолева кислота C18:2 CH3-(CH2)4-(CH=CH-CH2)2-(CH2)6-COOH C19H30COOH – арахідонова кислота C20:4 CH3-(CH2)4-(CH=CH-CH2)4-(CH2)2-COOH У природних жирах залишки кислот містять у молекулі парне число атомів Карбону (від 12 до 18) і нерозгалужений ланцюг. Найчастіше зустрічаються кислоти з 16 і 18 атомами вуглецю в молекулі. Такі кислоти утворюють тверді жири. Фізичні властивості ліпідів Ліпіди (жири), утворені граничними кислотами – тверді речовини, а неграничними – рідкі. Всі жири є легшими за воду. У воді вони не розчинні, але можуть утворювати стійкі емульсії (молоко). Жири добре розчиняються в багатьох органічних розчинниках (бензолі). Поширення в природі. Ліпіди широко поширені в природі і поряд з вуглеводами і білками є основним компонентом харчування людини. У рослинах вони накопичуються переважно в насіннях, у плодовій м'якоті, у тваринних організмах - у сполучній, підшкірній і жировій тканині. Головною складовою частиною рослинних і тваринних жирів є складні ефіри гліцерину і вищих жирних кислот Жири - висококалорійні продукти. Деякі жири містять вітаміни A, D (наприклад, риб'ячий жир, особливо трісковий жир), Е (бавовняна, кукурудзяна олія). Жири володіють рядом своєрідних специфічних властивостей. 1. Усі жири мають маслянисту консистенцію. 2. Температура плавлення жиру визначається процентним вмістом твердих граничних кислот. 3. Температура затвердіння жирів на 5-10°С нижча за їх температури плавлення. 4. Жири не розчинні у воді, але розчинні в ряді органічних розчинників (ефірі, бензині). 5. Жири погані провідники тепла. 6. Для жирів характерна здатність до емульгування, тобто утворенню з водою емульсій. Багато продуктів харчування є емульсіями: молоко, вершкова олія, маргарин, майонез, морозиво й ін. В організмі людини ліпіди містяться теж переважно у вигляді емульсій. Одержання Синтез жирів поки економічно не вигідний. Практично жири одержують із природної сировини. При цьому використовуються одним з наступних способів: Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
Хімічні властивості Найбільш важливими, що мають промислове значення хімічними властивостями жирів є здатність піддаватися гідролізу чи омиленню, гідрогенізації й окиснення. 1. ГІДРОЛІЗ (в кислому середовищі) або ОМИЛЕННЯ (в лужному середовищі), або під дією ферментів:
У лужному середовищі утворюється МИЛО – сіль вищих жирних кислот (натрієва сіль – тверде мило, калієве – рідке). Звичне мило погано пере у твердій воді і зовсім не пере в морській воді, оскільки йони кальцію і магнію, які вона містить, дають з вищими кислотами нерозчинні у воді солі: 2RCOO- + Ca → (RCOO)2Ca↓ 2. ГІДРУВАННЯ (ГІДРОГЕНІЗАЦІЯ) – процес приєднання водню до залишків ненасичених кислот, що входять до складу жиру. При цьому залишки неграничних кислот переходять в залишки граничних, і рідкі рослинні жири перетворюються на тверді (маргарин).
3. Рідкі жири містять залишки ненасичених кислот. Кількісною характеристикою ступеня ненасиченості жирів служить ЙОДНЕ ЧИСЛО, що показує скільки грам йоду може приєднатися по подвійних зв'язках до 100 г жиру. 4. При контакті з повітрям відбувається гіркнення жирів, в основі якого лежить ОКИСНЕННЯ по подвійних зв'язках (утворюються альдегіди і кислоти з коротким ланцюгом) і гідроліз під дією мікроорганізмів. Застосування 1) Основні продукти харчування. Краще засвоюються рідкі жири і жири з більш низькою температурою плавлення. Жири в організмі можуть утворюватися не тільки з жирів, що надходять з їжею, але й у результаті синтезу з вуглеводів і білків 2) Сировина для добування мила, стеарину, гліцерину. 3) Жирні кислоти, які входять до складу ліпідів визначають їх физико-хімічні і біологічні властивості. Складні ліпіди – основа подвійного шару біологічних мембран. 4) Жири мають велике значення в народному господарстві. Вони використовуються в парфумерії, шкіряної і лакофарбової промисловості, у виробництві мила, маргарину і т.п.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 669; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.01 с.) |

 –R–
–R– 
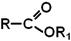 , де
, де  залишок кислоти,
залишок кислоти,  залишок спирту.
залишок спирту.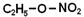 - етилнітр АТ
- етилнітр АТ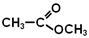 - метилетан ОАТ (метилацетат, метиловий естер оцтової кислоти)
- метилетан ОАТ (метилацетат, метиловий естер оцтової кислоти)