Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гідроліз солей. Ступінь та константа гідролізуСодержание книги
Поиск на нашем сайте ГІДРОЛІЗ СОЛЕЙ Більшість реакцій гідролізу – оборотні: Pb(NO3)2 + H2O → Pb(OH)(NO3) + HNO3 Na2HPO4 + H2O →NaH2PO4 + NaOH У результаті гідролізу в розчинах багатьох солей утворюється кисле або лужне середовище. Деякі солі повністю розкладаються у воді, тобто повністю гідролізують і не можуть існувати у вигляді розчинів. В таблиці розчинності солей вони позначені знаком ( þ Реакція ГІДРОЛІЗУ
Ця реакція є зворотною до реакції утворення солей.
þ Реакція НЕЙТРАЛІЗАЦІЇ
Основи і кислоти можуть бути сильними і слабкими, тому солі можна розділити на чотири типи. þ ТИПИ СОЛЕЙ
Розглянемо реакції гідролізу цих типів солей. 1. Солі, утворені сильними основами і слабкими кислотами, гідролізують за аніоном, їх розчини мають лужне середовище (рН >7). Приклади солей: Na2CO3; CH3COONa; KCN; Na2S; K2SiO3 Приклад рівняння гідролізу: K2SiO3 +2H2O = 2КОН + H2SiO3 2K+ + SiO32 SiO32 Висновок: 1. В реакції гідролізу бере участь АНІОН солі. 2. рН>7, середовище розчину солі стає лужним. ü Якщо ліки гідролізують за аніоном і утворюють лужне середовище, приймати їх треба перед їжею, інакше вони нейтралізуються шлунковим соком. 2. Солі, утворені слабкими основами і сильними кислотами гідролізують за катіоном, їх розчини мають кисле середовище, рН<7. Приклади солей: A12(SO4)3; FeCl3; CuBr2; NH4C1; Zn(NO3)2; (NН4)2Cr2O7. Приклад рівняння реакції гідролізу: FeCl3 + 3Н2О = Fe(OH)3 + 3НCl Fe3+ + 3Сl Fe3++ 3H2O = Fe(OH)3¯ + 3H+ Висновок: 1. В реакції гідролізу бере участь КАТІОН солі 2. рH<7, середовище розчину солі стає кислим. ü Ліки, які гідролізуютьза катіоном і утворюють кисле середовище приймати треба після їжі, щоб не викликати подразнення слизової шлунку. 3. Солі, утворені слабкими основами і слабкими кислотами гідролізують за катіоном і аніоном, розчини цих солей мають нейтральне, слабокисле або слаболужне середовище, рН≈7. Приклади солей: A12S3; Cr2S3; CH3COONH4; (NH4)2CO3. Приклад реакції гідролізу: (NН4)2СО3 + 2Н2О = 2NH4OH + Н2СО3 2NH4+ + СO32 Висновок: 1. В реакції гідролізу бере участь КАТІОН і АНІОН солі 2. рН = 7. розчин має нейтральне середовище. Якщо утворюється два слабкі електроліти, то гідроліз протікає необоротно. A12S3 + 6H2O = 2А1(ОН)3¯ + 3H2S Тому сульфід алюмінію не може існувати у вигляді водних розчинів, може бути одержаний тільки "сухим способом", наприклад, взаємодією елементів при високій температурі: 2A1 + 3S = A12S3 і повинен зберігатись в герметичних посудинах, в які не потрапляє волога. ü Якщо ліки піддаються повному гідролізу, вони вміщуються в капсули, які повинні розчинитися у визначеному місці шлунково-кишкового тракту. 4. Якщо сіль утворена сильною основою і сильною кислотою гідроліз не відбувається, середовище завжди (!) нейтральне, рН=7. Наприклад в розчинах NaCl, K2SO4, К2Сr2О7, Ba(NO3)2 гідроліз не відбувається. NaCl + Н2О = NaOH + HC1 Na+ + Сl Н2О = Н+ + ОН ü Якщо лікарські речовини не гідролізують, їх можна приймати у будь-який час і вводити у вигляді ін'єкцій безпосередньо в кров. Буферні розчини. Буферними називають розчини, які здатні зберігати значення рН при розведенні або при додаванні невеликих кількостей кислоти чи лугу, а також при їх концентруванні. До таких розчинів належать: 1) розчини, що містять слабку кислоту і сіль цієї кислоти з сильною основою: СН3СООН + СН3СООNa - ацетатний буфер рН (3,72-5,57) (4,65) 2) розчини, що містять слабку основу і сіль цієї основи з сильною кислотою NН40Н + NH4Cl - аміачний буфер pН (8,43-10,28) (9,37) 3) розчини, що містять солі багатоосновних слабких кислот Nа2НР04 + NаН2P04 - фосфатний буфер pН(5,91-7,73) (6,81) рН для даного складу буферу є величина постійна, однак змінюючи співвідношення в концентрації кислоти і солі можна одержувати в кожному випадку інше значення pН буферної системи, яка може бути в деяких певних границях. Механізм дії буферних розчинів. В ацетатному буфері кислота і сіль піддаються дисоціації
СНзСООNа СНзСОО- + Nа+ Якщо до такого розчину додати кислоту, яка в розчині протолізується НСІ + Н2О = СІ- + Н3О+ то в розчині буде проходити реакція нейтралізації.
Отже, H+ сильної кислоти зв’язуються з аніонами слабкої кислоти, яка є малодисоційованою і тому реакція середовища майже не змінюється. Якщо ж до цього самого розчину додати сильну основу NаОН, то будуть відбуватись такі процеси: електролітична дисоціація NаОН = Na+ + ОН- протоліз СНзСООН+Н2О = СН3СОО- +Н3О+ нейтралізація Н3О++ ОН- = 2Н2О Отже, реакція середовища майже не змінюється. Для розрахунку pН кислотного буферного розчину використовують формулу:
а для основних буферів рівняння Гендерсона-Гассельбаха:
Здатність буферних розчинів протидіяти зміні pН називають буферною дією. Межі, в яких проявляється ця дія називається буферною ємністю. Буферна ємність - це розрахункова величина, яка визначається кількістю еквівалентів сильної кислоти п (1/1 НСІ) або п (1/2 Н2S04) або сильної основи п (1/1 NаОН), п (1/2 Вa(ОН)2) що треба додати до 1 л. буферного розчину, щоб pН змінився на одиницю. Якщо В - буферна ємність, а п (Н3О+) і п (ОН-) — молярні концентрації еквівалентів відповідно кислоти і основи, то
Із досліджувальної пари співвідношення концентрацій кислоти до солі =1: 10 pН = pКA ± 1 Якщо С солі = С кислоти, то pН = pКA Біохімічні буферні системи. В організмі є 4 біохімічні буферні системи: гідрокарбонатна, фосфатна, гемоглобінова і білкова, кожна з них має в своєму складі слабку кислоту і її сіль з сильною основою. Гідрокарбонатні буферні системи - найбільш сильний буфер плазми крові і позаклітинної рідини. Значення рН плазми залежить від співвідношення компонентів буферної системи, яке для рН =7,4 складає: [ НСО3-]: [ Н2СО3] = 20: 1 Робота гідрокарбонатної буферної системи спрямована на нейтралізацію кислих і лужних продуктів. Якщо у систему надходять кислі продукти (наприклад НСІ), то відбуваються такі протолітичні реакції: НСІ + Н20 = Сl + НзO+ NаНСО3 = Nа+ + НСО3 - Н3О+ + НСО3- = Н2СО3 + Н2О Таким чином надлишкова концентрація йонів нейтралізується з утворенням слабкої карбонатної кислоти, надлишок якої в присутності ферменту карбоангідрази (КА) розкладається: Н2СО3 = СО2 + Н2О СО2 вилучається через легені і рівновага знову відновлюється. При надходженні лужних продуктів у реакцію вступає кисла частина буферної системи: NаОН = Nа+ +ОН- Н2СО3 + ОН- = НСО3- + Н2О У цьому випадку сильна основа зaмінюється йонами НСО3-, які виводяться нирками. Фосфатна система - найбільш сильний внутршньоклітинний фактор.Складається з: Н2PO4-+ НPO4-2. pН = 7,4 Білкова буферна система складається в основному з альбумінів плазми, які є амфолітами, бо містять всередині самої молекули як кислотні групи – СООН, які можуть взаємодіяти з основними факторами, так і аміногрупи - NH2, які маючи основні властивості взаємодіють з кислотними факторами.
Буферна система оксигемоглобін – гемоглобін характеризується рівновагою між йонами гемоглобіну Нb- і гемоглобіном ННb, який є досить слабкою кислотою (КHHb =6,3 . 10 -9) Нb- + Н3О+ = ННb + Н2О Нb- + Н2О = ННb + ОH - Гемоглобін HНb приєднює кисень і утворює оксигемоглобін HНb02 HНb + О2 = HНbО2 При цьому йони Нb02 - теж взаємодіють з кислотними і основними факторами. HbО2- + Н3О+ = HНbО2 + Н2О HbО2- + Н2О = HНbО2 + ОН- Таким чином всі рівноваги гемоглобінової системи пов’язані між собою. Частка цієї буферної системи становить ~ 75% буферної ємності крові. Наявність таких буферних систем в організмі дозволяє нам переносити кислі і лужні продукти, які потім нейтралізуються і в цілому система людини має постійний кислотно-основний баланс. Особливо важливе значення кислотно-основний баланс має для стану зубів, які приймають на себе вплив з навколишнього середовища кислотних і основних факторів. Приклади роз’язування задач. Задача 1. Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл хлориду амонію з молярною концентрацією еквівалентів 0,2 моль/л. ( Розв'язок: Так як аміачна буферна система при дисоціації NH4OH = NH4+ + OH- утворює йони ОН-, то їх концентрацію можна розрахувати за формулою:
Якщо до даного розчину додати кислоти, то кількість основи в ньому зменшиться і згідно попереднього рівняння можна визначити концентрацію [OH-] в даному буфері:
Отже, рН системи зміниться із 9,25 до 9,16 Задача 2. Розрахуйте які об’єми розчинів гідрофосфату і дигідрофосфату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 100 мл буферного розчину з рН 6,8. ( Розв'язок: Якщо буферний розчин має рН 6,8 то можна визначити концентрацію [ H+ ] визначивши антилогарифм числа –6,8. -6,8=-7+0,2 10-6,8=100,2*10-7=1,59*10-7 Використавши попередню формулу:
Розв’язок рівняння
2,56(100- х) = х 256 =,56* х х = 72 Отже, для приготування 100 мл фосфатного буферу необхідно взяти 72 мл розчину NaH2PO4 і 100-72 = 28 мл розчину Na2HPO4 з молярною концкнтрацією еквівалентів 0,1 моль/л. Заняття №6 Тема: Йонний добуток води. Водневий показник. Актуальність теми: Біохімічні процеси в організмі людини проходять у водних розчинах. При цьому водне середовище може бути нейтральним, кислим чи основним. Організм успішно справляється з кислотно-основною рівновагою і рН біологічних рідин залишається сталим, що забезпечує його нормальний життєвий рівень. Знання рН біологічних рідин дозволяє виявити патологічні зміни в організмі, попереджувати хвороби. Навчальні цілі: Знати: Значення рН шлункового соку, слини і інших біологічних рідин, від чого залежить значення рН різних розчинів. Вміти: Визначати рН розчинів за допомогою індикаторів. Розраховувати теоретичне значення рН різних розчинів. Самостійна позааудиторна робота студентів. 1. Напишіть рівняння гідролізу соди. 2. Концентрація водневих йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище. 3. Концентрація гідроксильних йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище. 4. Обчисліть рН розчину оцтової кислоти, хлоридної кислоти та гідроксиду амонію з молярною концентрацією еквівалентів 0,01 моль/л. Контрольні питання. 1. Сильні і слабкі електроліти. Ступінь і константа дисоціації. 2. Кислотно-основні індикатори. Універсальний індикатор. 3.Як визначити ступінь дисоціації? 4.Що таке константа дисоціації? Напишіть її вираз для карбонатної кислоти. 5.Закон розведення Оствальда. 6.Напишіть рівняння і константу дисоціації води. 7.Що таке йонний добуток води? 8.Що таке водневий показник розчину? 9.Які значення рН в кислих, лужних і нейтральних розчинах? 10.Що таке активність розчину? 11. Дайте визначення кислот і основ з точки зору протонної теорії. Приклад завдань для тестового контролю: 1. Що таке ацидоз? а) зміщення рН середовища в організмі у лужну сторону; б) розрідження крові внаслідок плазмолізу; в) зміщення рН середовища в організмі у кислу сторону; г) підвищене згортання крові. 2. Значення рН крові людини в нормі: а) 7,63; б) 7,36; в) 7,46; г) 7,56. 3. Розрахувати рОН розчину гідроксиду амонію з концентрацією 0,2 моль/л, якщо ступінь дисоціації α=0,042 а) 4,2; б) 2,08; в) 4,16; г) 3,06. 4. При розчиненні якої із солей середовище нейтральне: а) Na2CO3; б) NН4Cl; в) ВaCl2; г) CuSO4.
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1656; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.007 с.) |





 СН3СОО- + Н3О+ СН3СООН + Н2О
СН3СОО- + Н3О+ СН3СООН + Н2О звідси
звідси або
або 
 або
або 






 ). Визначити рН даної системи. Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.
). Визначити рН даної системи. Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.

 , звідси
, звідси 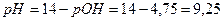

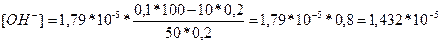


 )
) приймемо за VК=
приймемо за VК=  = х, а VC =
= х, а VC =  =100 -x
=100 -x дасть
дасть