
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинникаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Метод визначення молярної маси сполук за зниженням температури замерзання називається кріоскопією, відповідно за підвищенням температури кипіння - ебуліоскопією. Визначення депресії біологічних рідин (крові, лімфи, сечі) дає можливість розрахувати їх "осмотичну" концентрацію, тобто сумарну концентрацію всіх частинок, які неможливо визначити звичайними методами кількісного аналізу. Для розчинів неелектролітів, які перебувають у вигляді молекул осмотична концентрація дорівнює молярній. Сосм. = С мол. Осмотичний тиск можна визначити за експериментальною депресією:
де R = 8,314 Дж/моль *К К =1,86 Для розчинів електролітів, які містять суміш дисоційованих йонів. Сосм=іСм де і =1+α(п -1) і - ізотонічний коефіцієнт; п - число продисоційованих частинок; α- ступінь дисоціації. Більш точно осмотичний тиск можна визначити експериментально за депресією температури плавлення: Отже, осмотичний тиск визначають за формулою:
Заняття №9 Тема: Колігативні властивості розчинів. Осмос і осмотичний тиск. Актуальність теми: Осмос має важливе значення для рослинних і тваринних організмів, створюючи необхідні умови для нормального протікання біофізичних і біохімічних процесів. В людському організмі необхідне постійне значення осмотичного тиску крові і інших біологічних рідин. Значення осмотичних властивостей розчинів, їх залежність від різних речовин, робить можливим регулювання і підтримання необхідних параметрів стану організму. Навчальні цілі: Знати: залежність осмотичного тиску від концентрації розчинених електролітів і неелектролітів. Знати осмотичний тиск різних біологічних рідин і вплив на нього різних факторів. Вміти: визначати і розраховувати осмотичний тиск розчинів і основних біологічних рідин. Самостійна позааудиторна робота студентів 1. Обчислити осмотичний тиск розчину глюкози з концентрацією 0,287 моль/л. Контрольні питання 1. Дифузія в розчинах і її значення для біологічних систем. 2. Закон Фіка. 3. Осмос і осмотичний тиск. 4. Закон Вант-Гоффа для осмотичного тиску. 5. Осмотичні властивості розчинів неелектролітів. 6. Осмотичні властивості розчинів електролітів. Коефіцієнт Вант-Гоффа. 7. Гіпер-, гіпо- і ізотонічні розчини. 8. Процеси плазмолізу і гемолізу. 9. Дайте визначення поняттю дифузія, осмотичний тиск, ізотонічний коефіцієнт, осмос, осмотична концентрація. Приклад завдань для тестового контролю: 1. Дифузія – це процес: а) переходу речовини із твердого стану в рідкий; б) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації; в) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації; г) переходу речовини із рідкого стану в газоподібний; д) переходу речовини із одного стану в інший; 2 Кількісно величину осмотичного тиску розчиненого у воді неелектроліту можна визначити законом Вант-Гоффа за формулою: а) д) 3. Еритроцит вміщений в 10 % розчин NaCl. При цьому протікає процес: а) плазмолізу; б) гемолізу; в) ендосмосу; г) не проходить; д) дифузії. 4. Розчин NaCl при 310 К має осмотичний тиск 750 кПа. Скільки грамів солі міститься в 200 г такого розчину? а) 3,4 г; б) 1,7 г; в) 0,85 г; г) 0,95; д) 3,5 г.
Самостійна робота на занятті. Виконати лабораторні роботи: 1. Визначити осмотичний тиск розчину сахарози. 2. Виростити “штучну клітину”. 3. Одержати деревоподібні утворення. Методика виконання роботи Робота 1. Осмос і осмотичний тиск. Пробірку без дна із закріпленою на ній напівпроникною мембраною наповнюють 70 %-ним розчином сахарози, закривають корком з отвором, в якому вставлена скляна трубка з зігнутим кінцем. Осмометр закріпляють в штативі, а розчин відділений мембраною опускають в склянку з дистильованою водою. Внаслідок ендоосмосу рідина в трубці підіймається на певну висоту. Стовпчик рідини в трубці показує величину осмотичного тиску. Намалювати осмометр і зробити відповідні висновки. Робота 2. Ріст "штучної клітини" Траубе. В пробірку поміщають кілька кристалів калій гексаціано-(ІІ)-феррату (жовта кров'яна сіль) К4[Fе(СN)6]. Доливають 4-5 мл 5%-ного розчину сульфату міді. Кристалики солі, розчиняючись, взаємодіють з сульфатом міді. При цьому утворюється напівпроникна мембрана гексаціано-(ІІ)-феррату міді, Сu2[Fе(СN)6], яка пропускає воду, але не пропускає йони солі. Зобразити малюнком ці утворення і зробити відповідний висновок. Робота 3. Одержання деревоподібних утворень. В чотири пробірки наливають по 4-5 мл розведеного силікатного клею і опускають в кожну пробірку відповідно кристали хлоридів кобальту, марганцю, нікелю, міді. Через деякий час з кристаликів виростають деревоподібні утворення. Зробити відповідні малюнки і пояснити ці явища.
РОЗДІЛ 7 Термодинаміка - це наука про взаємні переходи форм енергії. Хімічна термодинаміка - вивчає зміни енергії при хімічних реакціях та фазових переходах. Вона встановлює стійкість хімічних речовин, можливість, напрямок і межі протікання реакцій, вплив основних факторів: тиску, температури, концентрації на здійснення хімічного процесу. В живих організмах постійно проходить обмін речовин (метаболізм). Це сукупність багатьох хімічних реакцій, які супроводжуються виділенням і поглинанням енергії. Цей процес обміну речовин і енергії є характерною ознакою життя. Тому для медиків важливо знати основні закони термодинаміки, її методи, які допомагають зрозуміти і вивчити процеси життєдіяльності. Основні поняття: Система - частина фізичного світу (речовина чи сукупність тіл), що має реальну чи уявну границю від навколишнього середовища і характеризується певними властивостями (клітина, нервова система живого організму, серцево-судинна система, система травлення і т.д). Системи діляться на: гомогенні (однорідні), які не мають границі поділу фаз; гетерогенн і (неоднорідні), які мають границю поділу фаз. Системи можуть бути: ізольовані (ідеальні) які не обмінюються з навколишнім середовищем ні масою ні енергією; закриті, що обмінюються енергією але не обмінюються масою; відкриті, які обмінюються із навколишнім як енергією так і масою. Всі живі організми - відкриті гетерогенні системи. Стан системи - сукупність фізичних і хімічних властивостей системи, які описуються за допомогою термодинамічних факторів, які вона має в даний момент. Cтан системи може змінюється. Якщо система не змінюється в часі, то такий стан називається рівноважний. Рівновага найчастіше буває динамічною, тобто коли процеси протікають з однаковою швидкістю так, що в цілому система не змінюється. Фаза - це сукупність всіх однорідних по складу і фізико-хімічних властивостях частин системи відокремлених чіткою границею розділу. Так гомогенна система складається із однієї фази (однофазна), а гетерогенна із кількох фаз.
Компоненти системи - це її незалежні складники. Кожен компонент - індивідуальна речовина, яка може бути виділена і може існувати самостійно. Наприклад: фізіологічний розчин, який є 0,9 % NaCІ - це система гомогенна, однофазна і двохкомпонентна, яка складається із NaCІ і Н2О. Параметри стану системи - це величини, які можна визначити безпосередньо вимірюванням. Такими параметрами є температура, тиск, об’єм, концентрація речовин. Функції стану системи - величини які кількісно описують систему і залежать від параметрів. Функціями стану системи є: -внутрішня енергія - U -ентальпія системи - H -ентропія - S -вільна енергія - G Закони термодинаміки. Перший закон. Це закон збереження енергії, який має кілька формулювань, що визначають його суть: 1) В ізольованій системі сума всіх видів енергії стала, а отже не може збільшуватись без взаємодії з навколишнім середовищем. 2) Вічний двигун першого роду неможливий. Сталість енергіії ізольованої системи не виключає можливості переходу одного з видів енргії в інший. 3) Переходи енергії здійснюються в строго еквівалентних співвідношеннях. Для реальних систем підведення деякої кількості теплоти (Q - тепловий ефект) може бути використано на збільшення внутрішньої енергії системи( Q = де Внутрішня енергія залежить від природи речовини і її маси. Неможливо визначити абсолютне значення внутрішньої енергії системи, визначається лише зміна внутрішньої енергії при переході з одного стану в інший.
Формами передачі енергії є теплота і робота. Теплота - це форма передачі енергії, що здійснюється в системі шляхом безпосереднього контакту мікрочастин, що хаотично рухаються. Робота (А) є формою передачі енергії. В організмі всі процеси протікають при постійному тиску тобто є ізобарними р=const A=p отже Qp = так як Qp = (U2+ pV2) - (U1+pV1) якщо прийняти, що U+pV=H - ентальпія, то Q p= H2-H1= Ентальпія - це функція стану, що чисельно рівна сумі внутрішньої енергії системи та роботи по зміні об’єму системи. Ця величина чисельно характеризує міру перетворення енергії в хімічних реакціях в тепло (тепловміст). Для кожної конкретної речовини значення Конкретні значення Це випливає із наслідку відомого закону Гесса, який дозволяє реально визначити на практиці тепловий ефект, що визначається початковим і кінцевим енергетичним станом речовини і не залежить від шляхів переходу або проміжних стадій реакцій. Одним із наслідків закону Гесса є те, що
а це значить, що Q = - Харчові продукти виділяють таку ж кількість енергії, як і при спалюванні їх у калориметрі. Так при біологічному окислені виділяється: 1 г білків 17,6 кДж 1 г вуглеводів 19,6 кДж 1 г жирів 38,9 кДж Людина при легкому фізичному навантаженні потребує 8370-10500 кДж на добу при середньому 12000-15000 кДж при важкій праці. 16700-25000 кДж Звідси можна розрахувати, що добова потреба дорослої людини при нормальних фізичних навантаженнях: в білках - 80-100 г в жирах - 60-70 г у вуглеводах - 380-390 г Основні енергетичні затрати організму людини покриваються за рахунок вуглеводів. Акумулятором енергії харчових продуктів в енергію біосистеми є молекули АТФ. Знаючи склад окремих харчових продуктів і теплоти окислення їх компонентів, можна розрахувати маси необхідних для людини харчових продуктів при різному фізичному навантаженні і при призначенні функціональної та лікувальної дієт.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 931; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.25.130 (0.009 с.) |

 звідки
звідки 
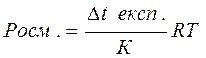


 б) π=iCRT в) Δp=po x2 г) π=CRT
б) π=iCRT в) Δp=po x2 г) π=CRT
 U) здійснення роботи проти зовнішніх сил (А), що можна виразити таким співвідношенням:
U) здійснення роботи проти зовнішніх сил (А), що можна виразити таким співвідношенням: U+A
U+A


