
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концентрований та розбавлений розчиниСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Не слід плутати поняття насичений і ненасичений розчини з поняттями концентрований і розбавлений. Назви концентрований і розбавлений вказують лише, на ступінь розчиненості речовини, що міститься в даній кількості розчинника, і нічого не вказують на ступінь його насичення. Концентрований розчин може бути і насиченим і ненасиченим. Наприклад, якщо в 100 г води при 100 °C розчинити 200 г нітрату калію KNO3, то такий розчин буде досить концентрованим, але ненасиченим, бо для одержання насиченого розчину при цих умовах потрібно розчинити не 200, а 245 г цієї солі. Другий приклад: якщо в 100 г води при звичайній температурі розчинити в одному випадку 0,10 г Ca(OH)2, а в другому — 0,16 г, то обидва розчини будуть дуже розбавлені і разом з тим перший з них буде ненасиченим, а другий — насиченим. Якшо в одній речовині(у середовищі) розподілена у вигляді найдрібніших частинок інша речовина (фаза), така система називається дисперсною системою. Речовина, у якій розподіляється інша речовина, називається дисперсійним середовищем, або розчинником. Речовина, що розподіляється в розчиннику, називається дисперсійною фазою або розчиненою речовиною. Так, найдрібніші частинки крейди у воді утворюють дисперсну систему, у якій вода є дисперсійним середовищем, а частинки крейди- дисперсійною фазою. Найбільше значення мають дисперсні системи, у яких середовищем є рідина, часто вода. Залежно від розмірів чатинок фази, дисперсні системи поділяють на три класи: грубо дисперсні, колоїдні і іонно-молекулярні системи. 1) грубодисперсні системи або зависі – це дисперсні системи, що містять частинки фази діаметром більше 100 нм. Частинки зависів можна побачити за допомогою мікроскопа. Зависі що складаються з рідкого середовища і твердої фази, називаються суспензіями (вода-крейда). Зависі що складаються з рідкого середовища і рідкої фази, називаються емульсіями (вода-олія). 2) Колоїдні системи (колоїдні розчини, золі)- це дисперсні системи, що містять частинки фази розміром від 1 до 100 нм. 3) Іонно-молекулярні системи(істинні розчини)- це дисперсні системи, що містять частинки фази розміром менше 1 нм. Розчин - це однорідна (гомогенна) система, що складається з розчинника, розчиненої речовини і продуктів їхньої взаємодії. 1. За агрегатним станом речовини розчини поділяють на рідкі, тверді і газоподібні. Розчин складається з орозчинника і розчиненої речовини. Але не завжди очевидно, яка речовина є розчиненою і яка розчинником. Якщо обидві речовини до розчинення перебували в однаковому агрегатному стані (наприклад, ацетон і вода), розчинником вважають речовину, якої у розчині більше. Якщо до розчинення речовини перебували в різних агрегатних станах, розчинником вважають речовину в рідкому стані. Найпоширенішим рідким розчинником є вода. 2. Розчини мають подібність з хімічними сполуками. Однак між ними є відмінності. Так, розчини немають постійного складу, у розчині можна виявити властивості його окремих компонентів. Розчинність- це властивість речовини розчинятись у воді або іншому розчиннику. Розчинність виражають максимальною кількістю грамів речовини, яку можна розчинити в 100 г розчинника при даній температурі. Розчинність іноді називають коефіцієнтом розчинності. Розчинність залежить від природи речовини. За розчинністю у воді всі речовини поділяють на 3 групи: 1) добре розчинні(CuSO4 ,NaOH, CH3, OH та ін.); 3) малорозчинні речовини (BaSO4, N2, та ін.); 3) практично нерозчинні речовини (Ag, Au, Ar та ін.). розчин у якому речовина за даних умов більше не розчиняється, називається начиченим. У насиченому розчині міститься менше речовини, а в пересиченому розчині- більше, ніж у насиченому (пересичний розчин приготовляються з насиченого спеціальними засобами). Розчинність речовин у воді залежить від температури. 4. Звичайно розчинність твердих речовин і рідин з підвищенням температура зростає. Розчинність газів з підвищенням температури зменшується, а з підвищення тиску- збільшується. Виділення речовини з розчину при зниженні температури називається кристалізацією. Речовина кристалізується очищеною від домішок. Якщо в розчині містяться домішки вони не випадають з розчині навіть при зниженні температури, оскільки розчин для домішок є ненасиченим. На цьому заснований метод очищення речовин, які називаються прекристалізацією. 5. Розчиненя речовин супроводжується тепловим ефектом: виділення або поглинанням теплоти що залежить від природи речовини. Так, при розчиненні калій гідроксиду KOH відбувається виділення теплоти а при розчинені амоній нітрату NH4NO3 поглинається теплота. Розчиненя калій гідроксиду- це екзотермічний процес (△Н У результаті хімічної взаємодії розчинника з розчиненою речовиною утворюються сполуки,що називаються сольватами(а для водних розчинів-гідратами).При утворенні сольватів(гідратів) властивості розчиненої речовини часто змінюються. Значення розчинів Водні розчини відіграють величезну роль у природі і практичній діяльності людини. Досить сказати, що рослини беруть з ґрунту всі потрібні для їх росту поживні речовини лише у вигляді водних розчинів. Тому своєчасне надходження води до ґрунту має таке велике значення для нормального розвитку рослин і забезпечення високого врожаю сільськогосподарських культур. Процеси травлення і засвоєння їжі людиною і всіма тваринами теж зв'язані з переведенням поживних речовин у розчин. Розчини відіграють величезну роль у техніці. Більшість хімічних процесів у промисловості проводять у розчинах. Такі галузі техніки, як шкіряне і паперове виробництво, виробництво цукру, мінеральних добрив, лікувальних речовин і багато інших, нерозривно пов'язані з широким застосуванням водних розчинів. Завдання для самоконтролю: 1.Дати загальну характеристику розчинів. 2. Основні властивості розчинів. 3. Класифікація розчинів. 4. Реакції в розчинах. 5.Яку роль розчини відіграють в поліграфічному виробництві?
Рекомендована література: 1. В.П.Басов.Хімія:Навчальний посібник:К.:Каравела,Львів,2003 р.- ст.53-59. 2. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст. 129-131. 3.Н.М.Буринська. Основи загальної хімії, 11клас:Підручник з поглибл. Вивченням хімії.-Київ;Ірпінь:ВТФ «Перун»,1997.- ст.113-121. 4.Н.В. Романова.Основи хімічного аналізу:Навч.посібник.-К.:Освіта,1992.-ст.7-13. Лекція.
|
||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1311; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.011 с.) |

 0). Розчинення амоній нітрату – це ендотермічний процес (△Н
0). Розчинення амоній нітрату – це ендотермічний процес (△Н 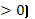 . Отже, при розчинені проходять хімічні процеси, утворюються хімічні зв’язки.
. Отже, при розчинені проходять хімічні процеси, утворюються хімічні зв’язки.


