Лабораторна робота №1.
1.Тема: Теорія електролітичної дисоціації.
2.Мета: провести реакції між розчинами електролітів, що ідуть до кінця з утворенням осаду; газоподібної речовини і малодисоціюючої речовини; дослідити зміни у кольорі індикаторів в кислому, лужному і нейтральному середовищі; довести що солі, утворені хоч би одним слабким електролітом у водному розчині гідролізують, змінюючи колір індикаторів.
3.Хід роботи.
3.1. Реакції обміну між розчинами елекролитів.
3.1.3. Для роботи необхідні: штатив з пробірками; розчини натрій сульфату, барій хлориду, натрій карбонату, купрум(ІІ) сульфату, сульфатної і хлоридної кислот, натрій гідроксид.
3.1.4. Виконання досліду: Користуючись таблицею розчинності солей і основ у воді, підберіть з розчинів солей, кислот, лугів, що запропоновані, такі розчини, які під час взаємодії одна з одною утворили б: а) осад;
Молекулярне рівняння:______________________________________________________________
Іонне рівняння:____________________________________________________________________
Скорочене іонне рівняння:___________________________________________________________
б) виділення газоподібної речовини;
Молекулярне рівняння:______________________________________________________________
Іонне рівняння:_____________________________________________________________________
Скорочене іонне рівняння:____________________________________________________________
в) речовину, яка мало дисоціює.
Молекулярне рівняння:_______________________________________________________________
Іонне рівняння:____________________________________________________________________
Скорочене іонне рівняння:____________________________________________________________
3.2. Зміна забарвлення індикаторів в розчинах кислот і лугів.
3.2.2. Для роботи необхідні: розчини хлоридної кислоти, натрій гідроксиду, лакмусу, фенолфталеїну, метилоранжу, води.
3.2.3. Виконання досліду: а)Налийте в три пробірки дистильованої води, додайте розчин лакмусу до помітного забарвлення. В одну пробірку з розчином лакмусу додати декілька крапель кислоти, а в іншу лугу. Спостерігайте зміни забарвлення. Зробіть висновок: які індикатори краще підходять для визначення кислот, а які для лугів?Те ж саме зробіть з фенолфталеїном замість лакмусу. Дослідить таким чином, як вище, метилоранж.
Спостереження оформіть в вигляді таблиці:
Рівняння дисоціації лугів:___________________________________________ Рівняння дисоціації кислот:_________________________________________ | ||||||||||||||||||
| ЗГЕК 5.092112__. ЛР01 | ||||||||||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 1 | Літ | Аркуш | Аркушів | ||||||||||||
| Студент | Іваненко | 1.01.09. | у | 1 | ||||||||||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-КОІ-10 | ||||||||||||||||
3. Випробування розчинів солей індикатором.Гідроліз солей. 3.3.3. Для роботи необхідні: розчини натрій карбонату, натрій сульфату, алюміній хлориду. 3.3.4. Виконання досліду: налийте у пробірку розчину солі і випробуйте його на лакмусі інші
Примітка: Середовище розчину в таблиці позначати знаком +. Напишіть реакції гідролізу досліджений солей молекулярній і іонній формах. ________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________ ____________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 6.Контрольні запитання: 1. Які речовини вважають електролітами? Визначте поняття «катіон», «аніон». 2. На які іони дисоціюють у воді розчини кислот, лугів, солей? 3. Що таке ступінь дисоціації? Яке значення приймає він у розчинах сильних, слабих, середньої 4. Які рівняння реакцій називають іонними? Коли іонні реакції ідуть до кінця? 5. Що таке рН водневий показник води? Які значення він приймає в кислому, лужному, 6. Яких іонів: Н + чи ОН- " більше: а) в лужному; б) в кислому; в) в нейтральному розчині. 7. Що таке гідроліз солей? Які солі можуть гідролізувати, а які ні? Напишіть рівняння гідролізу і визначить рН для солей: а) літій хлорид; б) натрій сульфіт; в) хром(ІІІ) хлорид. 6.Висновок:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ | |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 1 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 | |||||||||
Лабораторна робота №2
І.Тема:Властивості металів. Корозія.
2. Мета: Ознайомитись з електрохімічною корозією металів, хімічною корозією та методами захисту від них за допомогою катодного та анодного покриття, з окисними властивостями сполук d-елементів, де вони проявляють найвищі ступені окислення.
3. Обладнання: Штатив з лапкою, пробірки, два стакани на 100 мл з водою;
реактиви:розчин сірчаної кислоти розведений, шматки Цинку, 2% розчин сульфату міді, шматок оцинкованого заліза і заліза покритого оловом чи міддю, 3% розчин Натрій хлориду, розчин роданіду амонію NH4SCN, розчин Калій гексаціонаферату (III) K3[ Fe(CN)6], 0,5% розчин Калій діхромату. К2Сl2О7, 0,5% розчин Калій хромату К2СО4, 1 М розчин сірчаної кислоти, 2 М розчин Калій гідроксиду, 1 М розчин Калій сульфіту, чи Натрій сульфіту Na2SО3.
4. Хід роботи:
4.1 Взаємодія активних металів з кислотами
В пробірку налийте розчин хлоридної кислоти і киньте туди шматочок цинку. Який газ виділяється? Зберіть його у перевернуту пробірку. Підпаліть його. Як він згорає? Напишіть обидва рівняння реакцій:
_________________________________________________________________________________
4.2 Окислення металів неметалами.
4.2.1. У невеликий тигель насипте товчене деревинне вугілля і залізний пил. Закріпіть тигель у штативі і нагрійте на полум`ї спиртівки. Що спостерігаєте?
Напишіть рівняння реакції:
___________________________________________________________________________________
4.2.2 На стальну пластину насипте приблизно 0,2 г порошку магнію. Обережно підпаліть його довгою лучиною. Що спостерігаєте? Напишіть рівняння реакції:
__________________________________________________________________________________
4.3 Якісні реакції на солі заліза. (дослід проводить вчитель!)
4.3. 1 Якісна реакція на ферум (ІІІ).
Внесіть в пробірку 2-3 краплі розчину Ферум(ІІІ) хлориду, додайте 1-2 краплі розчину роданіду амонію. Зверніть увагу на утворення розчину кров`яно - червоного кольору. Напишіть рівняння реакції.
 Fe3+ + NH4SCN ____________________________________________________________
4.3.2. Якісна реакція на ферум (ІІ).
В несіть в пробірку 2-3 краплі розчинуФерум(ІІ) сульфату, додайте таку ж кількість гексаціаноферату (III) калію (червоної кров'яної солі). Утворюється синій осад. Напишіть рівняння реакції в молекулярному і іонному вигляді.Напишіть рівняння реакції: Fe3+ + NH4SCN ____________________________________________________________
4.3.2. Якісна реакція на ферум (ІІ).
В несіть в пробірку 2-3 краплі розчинуФерум(ІІ) сульфату, додайте таку ж кількість гексаціаноферату (III) калію (червоної кров'яної солі). Утворюється синій осад. Напишіть рівняння реакції в молекулярному і іонному вигляді.Напишіть рівняння реакції:
 Fe2+ + [Fe(CN)6] 3+ _________________________________________________________
4.4 Заміщення пасивного металу активним в його солі.
В розч. мідного купоросу(Купрум(ІІ) сульфату) опустить залізний дріт чи цвях. Через деякий час у розчині з'являються іони Fe2+, які можна виявити розч. гексаціоноферрату калію, з'являється синій колір. А на дроті чи цвяху виникає мідний шар червоного кольору. Напишіть рівняння реакції:
___________________________________________________________________________________
__________________________________________________________________________________ Fe2+ + [Fe(CN)6] 3+ _________________________________________________________
4.4 Заміщення пасивного металу активним в його солі.
В розч. мідного купоросу(Купрум(ІІ) сульфату) опустить залізний дріт чи цвях. Через деякий час у розчині з'являються іони Fe2+, які можна виявити розч. гексаціоноферрату калію, з'являється синій колір. А на дроті чи цвяху виникає мідний шар червоного кольору. Напишіть рівняння реакції:
___________________________________________________________________________________
__________________________________________________________________________________
| |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 2 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 | |||||||||
| 4.5 Катодні та анодні покриття і корозія металів. Два стакани наповніть дуже розведеним розчином хлоридної кислоти і додайте до них 10 крапель гексацїоноферату (ПІ) калію. Покладіть металеві пластинки в стакан. Розчин перемішайте скляними паличками подряпайте металевим предметом пластинку так, щоб оголилась поверхня заліза. Через час в стакані з металевою пластинкою, яка покрита міддю чи оловом, помітне посиніння в місцях ушкодження покриття внаслідок корозії заліза (переходу іонів Fe3+ в розчин). Це реакція утворення турнбулевої сині- якісна реакція на іони заліза (ІІ).Це катодне покриття Fe окислюється. У стакані з оцинкованою залізною пластиною посиніння спостерігається значніше, доки не розчиниться активніший ніж залізо Zn. Це анодне покриття: цинк окислюється. Замість пластинок оцинкованого заліза та покритого оловом можна взяти сталеве перо, в розщеп якого вставлені шматки олова та цинку. Процес корозії під час руйнування катодного покриття(Cu/Fe чи Sn/Fe) ідуть за рівняннями: Анод(-) Fe - 2е = Fe2+ Катод(+)Сu чи Sn О2 + 2Н2О + 2е = 4ОН- Поява забарвлення: 3Fe2+ + 2[Fe(CN)6 ]3+ = Fe3[Fe(CN)6]2 Під час руйнування анодного покриття (Fe/Zn) відбуваються такі процеси: Анод (-) Zn - 2е = Zn: Катод (+)Fe О2 + 2Н2О + 2е - 4ОН- Забарвлення відсутнє. Після розчинення цинку виникає нова гальванопара, наприкладО/Fe Анод(-) Ре - 2е -Fe2+ Катод (+) О2 + 2Н?О + 2е = 4ОИ- З'являється синє забарвлення - турнбулева синь. 1. Висновок. 2. Контрольні запитання. Які особливості електронної будови металів вам відомі? Перелічите особливості фізичних властивостей металів, обумовлених металічним зв`язком. Який розмір, форму мають кристали металів? Що таке вакансії і дислокації? Які хімічні властивості характерні для лужних, лужноземельних металів, тобто для s-елементів, і для металів, які відносять до d-елементів? Які види корозії вам відомі і у яких умовах вони проходять? Які методи захисту від корозії вам відомі? | |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 2 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 | |||||||||
| Лабораторна робота № 3 1. Тема:Властивості алюмінію і його сполук. Окислювально-відновні властивості сполук хрому, марганцю. 2.Мета: Вивчити хімічні властивості алюмінію і його сполук; окислювально-відновні властивості сполук марганцю. 4. Обладнання:спиртівка, утримувач пробірок, 14-15 пробірок; реактиви: шматочки алюмінію, розчин соляної кислоти (1:3), розчин сульфатної кислоти (1:5), розчини гідроксиду натрію (калію) і хлориду алюмінію, хрому(ІІІ) сульфату, ферум (ІІІ) сульфату, розчин перманганату калію, сульфіту натрію чи тіосульфату натрію. 5. Хід роботи. 4.1. Взаємодія алюмінію з кислотами. (експеримент проводиться демонстраційно) В дві пробірки положіть по 2 маленьких шматочки алюмінію (проволоки, стружки). Прилийте в одну пробірку 0,5 мл (10 крапель) розчину соляної кислоти, а іншу - стільки ж розчину сірчаної кислоти. Якщо не спостерігаєте реакції в якій-небудь пробірці - підігрійте її. З якою кислотою більш бурхливо проходить реакція? Спробуйте визначити газ, що виділяється: підпаліть його від палючої лучини. Який газ виділяється? Напишіть рівняння реакцій: . 4.2. Взаємодія алюмінію з лугами. (експеримент проводиться демонстраційно) У пробірку з двома маленькими шматочками алюмінію налийте 0,5 мл (10 крапель) розчину лугу (гідроксиду натрію чи калію). Якщо не спостерігаєте реакції, пробірку трохи підігрійте. Що помічаєте? З'ясуйте, який газ виділяється в процесі реакції. Напишіть її рівняння: ____________________________________________________________________________________ 4.3. Отримання гідроксиду алюмінію, взаємодія його з кислотами і лугами. Налийте в пробірку трохи розчину алюміній хлориду та додайте 2 мл розчину гідроксиду натрію чи калію до утворення білого осаду. Напишіть рівняння реакції: . _________________ Отриманий осад розділить на три пробірки. В першу налийте розчину лугу, в другу – розчин хлоридної кислоти. Що спостерігаєте? Напишіть рівняння реакцій: __________________________________________________________________________________ Як називається властивість металу реагувати і з кислотами і з лугами? __________________________________________________________________________________ 4.4. Перетворення дихроматів в хромати і навпаки. Налийте в чотири пробірки no 2 мл. розчину хромату калію. Першу і четверту пробірки залишіть для порівняння, а в другу і третю додайте розчин сірчаної кислоти. Яку зміну забарвлення спостерігаєте? Підпишіть кольори під іонами хромату і дихромату в рівнянні: 2Н+ + 2СгО42- = Сг2О72- + Н2О Долийте в першу і другу пробірку достатню кількість розчину натрій гідроксиду. Яку зміну забарвлення спостерігаєте? Підпишіть кольори під іонами хромату і дихромату в рівнянні: Сґ2О72- - 2ОН+ = 2СгО42- + 2Н2О 4.5 Відновлення калію дихромату натрій сульфітом. У пробірку налийте 2-3 мл розч. Калій дихромату, 1 мл розчину сульфатної кислоти, 2 мл розчину натрій сульфіту. Як змінився колірі? Напишіть рівняння реакції і розставте коефіцієнти методом електронного балансу: | ||||||||
| ЗГЕК 5.092112__. ЛР01 | ||||||||
| № документа | Підпис | Дата | Лабораторна робота № 3 | Літ | Аркуш | Аркушів | ||
| Студент | Іваненко | 1.01.09. | у | 1 | ||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-КОІ-10 | ||||||
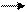 K2Cr2O7 + Na2SO3 + H2 SO4 Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________
4.5. Окислення сульфіту натрію розчином перманганату калію в кислому, нейтральному і лужному середовищі.
4.6. В 3 пробірки з 2-Змл розчину перманганату калію додають:
а) в першу - сульфатну кислоту;
б) в другу - воду;
в) в третю - луг.
Таким чином, розчини перманганату калію мають кисле, нейтральне і лужне середовище в цих пробірках. В кожну з пробірок доливають по декілька мл розчину сульфіту натрію. Спостерігайте за обезбарвленням в пробірці (а), за утворенням коричневого осаду і обезбарвленням розчину в пробірці (б); за появою зеленого ізумрудного забарвлення в третій пробірці (в).
Напишіть молекулярні рівняння реакцій, спостереження і розставте коефіцієнти методом електронного балансу у рівняннях:
а) KMnO4 + K2SO3 + H2SO4 = MnSO4 + K2SO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) KMnO4 + K2SO3 + H2O = MnO2 + K2SO4 + KOH
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) KMnO4 + K2SO3 + KOH = K2SO4 + K2MnO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Висновок.
6.Контрольні запитання.
1. Які фізичні властивості мають алюміній, хром, марганець?
2. Яке застосування знаходять ці метали ї їх сплави в техніці?
3. Що таке амфотерність?
4. Чому сполуки марганцю і заліза проявляють окисно-відновні властивості?
5. До яких сполук відновлюється калію перманганат в кислому, нейтральному, лужному середовищі?
6.Які властивості, відновника чи окисника проявить елемент у певному ступеню окислення?
Mn7+, Mn 4+ , Mn2+ , Mn0
Cr6+, Cr3+, Cr0 . K2Cr2O7 + Na2SO3 + H2 SO4 Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________
4.5. Окислення сульфіту натрію розчином перманганату калію в кислому, нейтральному і лужному середовищі.
4.6. В 3 пробірки з 2-Змл розчину перманганату калію додають:
а) в першу - сульфатну кислоту;
б) в другу - воду;
в) в третю - луг.
Таким чином, розчини перманганату калію мають кисле, нейтральне і лужне середовище в цих пробірках. В кожну з пробірок доливають по декілька мл розчину сульфіту натрію. Спостерігайте за обезбарвленням в пробірці (а), за утворенням коричневого осаду і обезбарвленням розчину в пробірці (б); за появою зеленого ізумрудного забарвлення в третій пробірці (в).
Напишіть молекулярні рівняння реакцій, спостереження і розставте коефіцієнти методом електронного балансу у рівняннях:
а) KMnO4 + K2SO3 + H2SO4 = MnSO4 + K2SO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) KMnO4 + K2SO3 + H2O = MnO2 + K2SO4 + KOH
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
в) KMnO4 + K2SO3 + KOH = K2SO4 + K2MnO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Висновок.
6.Контрольні запитання.
1. Які фізичні властивості мають алюміній, хром, марганець?
2. Яке застосування знаходять ці метали ї їх сплави в техніці?
3. Що таке амфотерність?
4. Чому сполуки марганцю і заліза проявляють окисно-відновні властивості?
5. До яких сполук відновлюється калію перманганат в кислому, нейтральному, лужному середовищі?
6.Які властивості, відновника чи окисника проявить елемент у певному ступеню окислення?
Mn7+, Mn 4+ , Mn2+ , Mn0
Cr6+, Cr3+, Cr0 .
| ||||||||
| ЗГЕК 5.092112__. ЛР01 | ||||||||
| № документа | Підпис | Дата | Лабораторна робота №3 | Літ | Аркуш | Аркушів | ||
| Студент | Іваненко | 1.01.09. | ||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 |
Лабораторна робота №4.
1. Тема:Властивості сполук азоту і фосфору.
2. Мета: Вивчити властивості сполук азоту та фосфору.
3. Обладнання: штатив з пробірками;
4. Реактиви: індикатори (фенолфталеїн, лакмус), хлорид амонію, гашене вапно Са(ОН)2, розчини гідроксиду натрію, хлориду кальцію, фосфату натрію, гідрофосфату натрію,дігідрофосфату натрію, розчини концентрованої та розбавленої азотної кислоти, шматочки свинцю, цинку.
4.1 Хід роботи.(всі досліди проводяться демонстраційно у витяжній шафі!)
4.1 Отримання аміаку і досліди з ним.
В пробірку насипте хлорид амонію і гашене вапно. Зверніть увагу на появу запаху аміаку. Закрийте пробірку пробкою з газовідвідною трубкою. Її кінець опустіть в пробірку з водою. Обережно нагрівайте пробірку з сумішшю. Спостерігайте за виділенням бульбашок у пробірці з водою. Це виділяється газ аміак, який відразу ж розчиняється у воді. По скінченні досліду перевірте індикатором середовище у пробірці з водою. Про що говорить зміна забарвлення індикатора.Напишіть рівняння реакцій: __________________________________________________________________________________
а) що відбувається під час нагрівання суміші хлориду амонію з вапном?;
б ) під час розчинення аміаку у воді.
4.2. Лужні властивості гідроксиду амонію. Водний розчин аміаку розділить на дві пробірки:
а) в першій пробірці визначте середовище розчину фенолфталеїном. На наявність якого іону вказує зміна забарвлення фенолфталеїну?
Напишіть рівняння реакцій: _____________________________________________________________
б) прокип'ятіть декілька крапель водного розчину аміаку в другій пробірці і визначте реакцію рідини на індикатор. Пояснить, чому колір не змінився?
Напишіть схему дисоціації гідроксиду амонію: __________________________________________
4.3. Нейтралізація гідроксиду амонію соляною кислотою.
В пробірку з розчином аміаку додайте по краплях соляну кислоту. Реакцію перевірте індикатором. Коли розчин зробиться нейтральним, випарте його на невеликому полум'ї. Який колір має отримана речовина, який вигляд? Напишіть в молекулярній і іонній формах рівняння реакції нейтралізації гідроксиду амонію соляною кислотою.Напишіть рівняння реакцій: ____________________________________________________________________________________
4.4. Окислювальні властивості азотної кислоти.
Досліди проводити у витяжній шафі під тягою!!!
4.4.1. а) У пробірку налийте розбавлений розчин азотної кислоти і помістить туди шматочок магнію. Спостерігайте виділення бурого газу. Напишіть рівняння реакції, розставте коефіцієнти методом електронного балансу: HNO3 + Mg Mg(NO3)2+H2O + NH3 ________________________________________________________________________________________________________________________________________________________________________
б) Проведіть цей же дослід із концентрованою азотною кислотою, напишіть рівняння реакції, розставте коефіцієнти методом електронного балансу:
HNO3 + Mg Mg(NO3)2+H2O + N2O  ________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________
| |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 4 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 | |||||||||
4.4.2. а) Проведіть реакцію між розведеною азотною кислотою і купрумом. Якого кольору газ, що виділяється? Чому розчин у пробірці під час реакції став зелений? Напишіть рівняння реакції і розставте коефіцієнти методом електронного балансу.
 HNO3 + Сu Сu (NO3)2+H2O + NO
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
б) Проведіть реакцію між концентрованою азотною кислотою і купрумом. Що спостерігаєте? якого кольору розчин? Напишіть рівняння реакції, розставте коефіцієнти методом електронного балансу. HNO3 + Сu Сu (NO3)2+H2O + NO
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
б) Проведіть реакцію між концентрованою азотною кислотою і купрумом. Що спостерігаєте? якого кольору розчин? Напишіть рівняння реакції, розставте коефіцієнти методом електронного балансу.
 HNO3 + Сu Сu (NO3)2+H2O + NO2
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Висновок.
6.Контрольні запитання:
1.Чому азот має валентність III, а фосфор III та V на підставі електронної будови атомів?
2. Які фізичні властивості мають азот, оксиди азоту NO, NO 2, аміак, азотна кислота, фосфорна кислота, солі азотної кислоти, фосфорної кислоти? Які з цих сполук отруйні, які потрібно зберігати під витяжкою?
3. Де застосовуються перелічені речовини?
4. Поясніть зміст терміну «донорно-акцепторний хімічний зв'язок», як він утворюється в іоні амонію?
5. Чому для осушення аміаку не можна використовувати сірчану кислоту, яка добре зв'язує воду? HNO3 + Сu Сu (NO3)2+H2O + NO2
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Висновок.
6.Контрольні запитання:
1.Чому азот має валентність III, а фосфор III та V на підставі електронної будови атомів?
2. Які фізичні властивості мають азот, оксиди азоту NO, NO 2, аміак, азотна кислота, фосфорна кислота, солі азотної кислоти, фосфорної кислоти? Які з цих сполук отруйні, які потрібно зберігати під витяжкою?
3. Де застосовуються перелічені речовини?
4. Поясніть зміст терміну «донорно-акцепторний хімічний зв'язок», як він утворюється в іоні амонію?
5. Чому для осушення аміаку не можна використовувати сірчану кислоту, яка добре зв'язує воду?
| |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 4 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-КОІ-10 | |||||||||
| Лабораторна робота № 5 1 Тема:Гідроліз солей. Властивості сполук Карбону(ІV). 2 Мета: вивчити гідроліз солей, добути вуглекислий газ, провести якісну реакцію на вуглекислий газ 3 Обладнання та реактиви: - штатив з пробірками, спиртівка, пробіркоутримувач, штатив, предметне скло, сірники; - сіль амоній хлориду, розчини аміаку, індикаторів, хлоридної кислоти, ферум(ІІІ) хлориду, натрй гідроксиду; розчини натрій сульфату і натрій хлориду у пронумерованих пробірках. 4 Хід роботи: 4.1 Добування вуглекислого газу і проведення якісної реакції СО2 з кальцій гідроксидом. У велику пробірку помістіть кілька кусочків мармуру чи крейди. В іншу пробірку налийте розчин кальцій гідроксиду (вапняної води). Добавте до мармуру кілька мілілитрів розбавленого розчину хлоридної кислоти, пробірку відразу закрийте пробкою з газовідвідною трубкою. Вільний отвір трубки занурте у розчин Са(ОН)2. Напишіть два рівняння реакцій, які відбуваються у першій і другій пробірці у молекулярному, іонному і скороченому іонному вигляд. Що спостерігаєте в першій пробірці? У пробірці з вапняною водою? CaCO3 + HCl = _________________________________________ ________________________________________________________________________ CO2 + Ca(OH)2 = __________________________________________ ________________________________________________________________________ 4.2 Перетворення кальцій карбонату на кальцій гідрогенкарбонат. У пробірку з осадом кальцій карбонату продовжуйте пропускати вуглекислий газ протягом 1-2 хв. Що відбувається з осадом? Напишіть рівняння реакції. CaCO3 + CO2 + H2O =________________________________________ ____________________________________________________________________________________ 4.4 Перетворення кальцій гідрогенкарбонату на кальцій карбонат. Половину розчину, добутого в досліді 3, відлийте в іншу пробірку, До першої частини розчину долийте трохи розчину кальцій гідроксиду, а другу частину розчину нагрійте. Що спостерігаєте? Напишіь рівняння двох хімічних реакцій в молекулярній, іонній і іонно-молекулярній формах. Ca(HCO3)2 + Ca(OH)2 = _______________________________________________ ________________________________________________________________________ t Ca(HCO3)2 = _______________________________________________________ | |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 5 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-CТС-10 | |||||||||
| 5.Висновок. 6.Запитання для самоконтролю. 1.Чому валентність Карбону у сполуках дорівнює ІІ і ІV? 2.Що таке гідроліз, чому гідроліз не відбувається в розчинах солей, які утворені сильними електролітами? 3.Якою якісною реакцією можна визначити карбонат-іон, вуглекислий газ? 4.Що таке непостійна жорсткість води і як її позбутися? Як утворюється накип? 5.Де застосовуються сполуки карбону? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________________________________________________________________________ | |||||||||||
| ЗГЕК 5.092112__. ЛР01 | |||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 5 | Літ | Аркуш | Аркушів | |||||
| Студент | Іваненко | 1.01.09. | у | 1 | |||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-КОІ-10 | |||||||||
Лабораторна робота № 6
1. Тема:Розпізнавання пластмас та волокон.
2. Мета: навчитися визначати хімічний склад пластмас та волокон за їх фізичними і хімічними властивостями.
3. Обладнання і матеріали:сірники, пінцети, зразки пластмас та волокон в пакетиках під номерами, папір, вода в стакані, ацетон.
4. Хід роботи:
4.1 Отримайте у вчителя пакетики з невідомими полімерами. Кожен зразок уважно
роздивіться. Підпаліть зразок пластмаси чи волокна, утримуючи їх пінцетом. Спостерігайте за полум'ям. Витягніть з полум'я зразок, чи продовжує він горіти?
4.2 Матеріал визначають за таблицею:
Заповніть таблицю:
| ||||||||||||||||||||
| ЗГЕК 5.092112__. ЛР01 | ||||||||||||||||||||
| № документа | Підпис | Дата | Лабораторна робота № 6 | Літ | Аркуш | Аркушів | ||||||||||||||
| Студент | Іваненко | 1.01.09. | у | 1 | ||||||||||||||||
| Перевірив | КиящукГ. Л ЛЛ. В.В. | 2-СТС-10 | ||||||||||||||||||
| п/п | Назва полімеру | запропоновані зразки, опис |
1. Пластмаса чи волокно...
2. Колір...
 3. Тверда чи еластична речовина...
4. Чи змочується водою...
5. Як горить і з яким запахом...
6. Чи витягуються в нитки (розплавлений зразок приліпіть до паперу і потягніть)
7. Чи залишається попіл, який він? 3. Тверда чи еластична речовина...
4. Чи змочується водою...
5. Як горить і з яким запахом...
6. Чи витягуються в нитки (розплавлений зразок приліпіть до паперу і потягніть)
7. Чи залишається попіл, який він?
| ||
6.Висновок.
7. Контрольні запитання:
1. Що таке полімер, мономер, структурна ланка, ступінь полімеризації?
2. Визначте структурну ланку в полімерах:
а) СН2-СН-СН2-СН-СН2-СН б) - СН2 -СН2 -СН2 -СН2 -
1 І
Сl СІ СІ
в) - СН2 - СН - СН2 – СН –
  СНз СНз
3. Напишіть рівняння, вкажіть, які з них відносяться до полімеризації і які до поліконденсації? Назвіть вихідні речовини і продукти. СНз СНз
3. Напишіть рівняння, вкажіть, які з них відносяться до полімеризації і які до поліконденсації? Назвіть вихідні речовини і продукти.
| ||
|
| Поделиться: |






