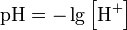Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічну рівновагу можна визначати як такий стан системи реагуючих речовин, за якого швидкості прямої і зворотної реакції дорівнюють одна одній.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
У стані рівноваги пряма та зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною рівновагою. А оскільки дія обох реакцій взаємно знищується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин – як вхідних, так і тих, що утворюються, - залишаються сталими. Концентрації реагуючих речовин, які встановлюються при хімічній рівновазі, називаються рівноважними. Вони позначаються формулами реагуючих речовин, узятими у квадратні дужки, наприклад [Н2], [N2], [NН3 ], в той час як нерівноважні концентрації позначають так: СН2 , СN2 СNН3 . На стан хімічної рівноваги впливають концентрація реагуючих речовин, температура, а для газуватих речовин – і тиск. При зміні одного з параметрів стан рівноваги порушується, і концентрація всіх реагуючих речовин змінюється доти, доки не встановлюється новий стан рівноваги, але вже з іншими значеннями рівноважних концентрацій. Такий перехід реакційної системи з одного стану в інший називається зміщенням (або зсувом) хімічної рівноваги. Якщо при зміні умов концентрація кінцевих речовин збільшується, то говорять про зміщення рівноваги в бік продуктів реакції. Якщо ж збільшується концентрація вихідних речовин, то рівновага зміщується в бік їх утворення. Напрямок зміщення хімічної рівноваги при зміні концентрації реагуючих речовин, температури і тиску (для газових реакцій) визначається загальним положенням, що відоме під назвою принципу рухомої рівноваги, або принципу Ле Шательє: Якщо на систему, що перебуває в стані рівноваги, чиниться який-небудь зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу тієї з двох протилежних реакцій, яка послаблює цей вплив. Приклад: 3 Н2 + N2 = 2 NН3, ΔН0=-46,2 кДж/моль. Якщо зовнішній вплив виявляється в збільшенні концентрації Нітрогену або Гідрогену, то він сприяє реакції, що спричиняє зменшення концентрації цих речовин, і отже, рівновага зміщується у бік утворення амоніаку. Відповідно збільшення концентрації амоніаку зміщує рівновагу в бік вихідних речовин. Оскільки пряма реакція, як це випливає з рівняння, відбувається з виділенням теплоти, то підвищення температури суміші сприяє перебігу реакцій з поглинанням теплоти, і рівновага зміщується в бік вихідних речовин, зниження температури спричиняють зміщення рівноваги в бік продукту реакції. Щоб визначити вплив тиску на зміщення рівноваги, необхідно підрахувати число молекул у лівій і правій частинах рівняння. У наведеному прикладі в лівій частині містяться дві молекули, а в правій – одна. Оскільки підвищення тиску повинно сприяти процесу, що викликає зменшення числа молекул, то в цьому випадку рівновага зміститься в бік продукту реакції. Очевидно, зниження тиску змістить рівновагу в бік вихідних речовин. Якщо ж у рівнянні оборотної реакції число молекул у лівій частині дорівнює числу молекул у правій частині, то зміна тиску не спричинить змішення хімічної рівноваги. Слід зазначити,що всі каталізатори однаковою мірою прискорюють як пряму, так і зворотну реакції, і тому на зміщення рівноваги не впливають. Вода як слабкий електроліт незначною мірою дисоціює на іони Н+ та ОН-, що перебувають у рівновазі з недисоційованими молекулами: Н2О = Н+ + ОН-. Концентрацію іонів звичайно виражають у молях іонів в 1л. Як видно з рівняння дисоціації води, в ній величини [Н2] і [ОН-] однакові. Експериментально встановлено,що в1л води за кімнатної температури(22оС)дисоціації піддається лише 10-7моль води і при цьому утворюється 10-7 моль/л іонів Н+ і 10-7моль/л іонів ОН-. Добуток концентрації іонів Гідрогену і гідроксид-іонів у воді називається іонним добутком води (позначається Кв). За певної температури Кв – величина стала, чисельно дорівнює при 22оС 10-4 : Кв=[Н+]·[ОН-]=10-7·10-7=10-14. Сталість добутку [Н+] · [ОН-] означає, що в будь-якому водному розчині ні концентрація іонів Гідрогену, ні концентрація гідроксид-іонів не може дорівнювати нулю. Іншими словами, будь-якому водний розчин кислоти, основи або солі містить як Н+, так і ОН- іони. Дійсно, для чистої води [Н+]=[ОН-]=10-7моль/л. Якщо до води додати кислоту, то [Н+] стане більшою ніж 10-7, а [ОН-] - меншою ніж 10-7моль/л. Навпаки, якщо до води додати луги, то [Н+] стає меншою ніж 10-7, а[ОН-] – більшою ніж 10-7моль/л. Зі сталості добутку [Н+] [ОН-] випливає, що при збільшенні концентрації одного з іонів води відповідно зменшується концентрація іншого іона. Це дає змогу обчислити концентрацію Н+ - іонів,якщо відома концентрація ОН- іонів, і навпаки. Наприклад, якщо у водному розчині [Н+]=10-3моль/л, то [ОН-] визначається так: [ОН-] = Кв ⁄ [Н+] = 10-14 ⁄ 10-7моль/л. Отже, кислотність і основність розчину можна виражати через концентрацію або іонів Н+, або іонів ОН-. На практиці користуються першим способом. Тоді для нейтрального розчину [Н+]=10-7моль/л, для кислого [Н+] › 10-7, для лужного [Н+] ‹ 10-7моль/л. Концентрацію іонів Гідрогену прийнято виражати через водневий показник, позначається – рН. Водневим показником рН називається десятковий логарифм концентрації водневих іонів, взятий з протилежним знаком: рН = - lg[Н+] [Н+] = 10-рН, де [Н+] – концентрація іонів Гідрогену. Поняття «водневий показник» введене датським хіміком С.Серенсеном у 1909р.(літера «р»-початкова літера датського слова potenz-математичний ступінь, буква «Н» - символ Гідрогену). За допомогою рН реакція розчинів характеризується так: нейтральна – рН =7, Кисла - рН ‹ 7, лужна – рН › 7. Наведемо значення рН деяких найвідоміших розчинів і зазначимо відповідну їм реакцію середовища: - шлунковий сік – рН=1,7 (сильнокисла реакція), - дощова вода – рН=6 (слабкокисла), - водопровідна вода – рН=7,5 (слабколужна), - кров – рН=7,4 (слабколужна), - слина – рН=6,9 (слабкокисла), - сльози – рН=7 (нейтральна). Винятково значна роль рН в найрізноманітніших явищах і процесах – в природі, в техніці, в поліграфії. Багато виробничих процесів у хімічній, харчовій, текстильній та інших галузях промисловості відбувається лише за певної реакції середовища. Для практичного визначення рН розчинів найчастіше користуються індикаторами. Індикаторний метод визначення рН ґрунтується на тому, що різні індикатори при різних значеннях рН неоднаково змінюють своє забарвлення: метиловий оранжевий змінює забарвлення при рН=4, лакмус – при рН=7, фенолфталеїн – при рН=9 тощо. Існують індикатори, які моють властивості змінювати свій колір при послідовній зміні рН. Це такі індикатори, як м-нітрофенол, н-нітрофенол тощо, які можна використовувати для кількісного визначення рН. pH, Водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для розведених розчинів можна користуватись терміном «концентрація» замість «активність» у цьому визначенні. У водних розчинах активність іонів водню визначається константою дисоціації води (Kw=1.011 × 10−14 при 25 °C) та взаємодією з іншими іонами в розчині. Завдяки такому значенню константи дисоціації нейтральний розчин (де активність іонів водню дорівнює активності гідроксильних груп ОН-) має значення рН, що дорівнює 7. Водні розчини із значенням рН, меншим ніж 7, вважаються кислотними, із значенням рН більшим 7 — лужними. Формула для обчислення величини рН (що не має одиниць розмірності) є наступною:
[H+] показує концентрацію іонів Н+ (або, якщо казати точніше, для водних розчинів — іонів гідроксонію [H3O+]), вимірених в молях налітр (одиниця концентрації, що називається «молярність»). В розчинах невисокої концентрації активність іонів збігається з величиною їхньої концентрації. рН абсолютно чистої води мусить мати значення 7. Але в реальності такого майже ніколи не трапляється — наприклад завдяки тому, що, при розчинюванні у воді вуглекислого газу (СО2) з повітря, утворюється вугільна кислота Н2СО3, яка при дисоціації на іони Н+ та СО32- може зменшувати значення рН води до величини 5,7-6. pH більшості відомих розчинів коливається між значеннями 0 та 14. Відомі розчини із значенням рН меншим нуля та більшим 14, але у таких випадках замість pH, як характеристики кислотності розчину, зазвичай користуються концентрацією кислоти або лугу. Значення pH для слабких та сильних кислот можна розрахувати, використовуючи деякі припущення. Процес розчинення сильної кислоти, наприклад соляної, у воді можна записати, як: HCl(aq) → H+ + Cl− Тобто приймаєтся, що в 0.01 M розчині HCl концентрація іонів гідроксонію також становить 0.01 M. Отже: pH = −log10 [H+]: pH = −log (0.01) що дорівнює 2. Для слабких кислот реакція дисоціації не йде до кінця. Між іонами водню, молекулами кислоти та її спорідненої основи досягається рівновага. Наступне рівняння ілюструє цю рівновагу між мурашиною кислотою та її іонами: HCOOH(aq) ↔ H+ + HCOO− Щоб мати можливість розрахувати pH необхідно знати константу рівноваги для цієї кислоти, яка визначається за наступним рівнянням: Ka = [іони водню][іони кислоти] / [кислота] Для HCOOH, K a = 1.6 × 10−4 При розрахунку pH не дуже слабкої кислоти у незанадто розведеному розчині зазвичай приймається, що вода не постачає іонів водню (до речі таке саме припущення було зроблено для розрахунку кислотності сильної кислоти вище). Це спрощує розрахунок і достатньо правомірно, тому, що концентрація іонів водню, що є наслідком дисоціації води складає 1×10−7 М, що зазвичай несуттєво. Для 0.1 М розчину мурашиної кислоти (HCOOH), константа кислотності дорінює: K a = [H+][HCOO−] / [HCOOH] Приймаючи, за x кількість дисоційованих молекул кислоти, заувжимо, що [HCOOH] зменшиться на цю кількість, у той час як [H+] та [HCOO−] збільшаться на це число. Таким чином, [HCOOH] можна замінити на 0.1 − x, а [H+] та [HCOO−] на x. В результаті маємо вираз:
Розв'язуючи відносно x одержуємо 3.9×10−3, що і є концентрацією іонів водню. Таким чином pH = −log(3.9×10−3), або приблизно 2.4. Завдання для самоконтролю: 1. Що називають водневим показником? 2. Чому різний рН в кислих, нейтральних та лужних розчинах? 3. Які ви знаєте способи визначення рН? 4. Іонний добуток води. 5.Вода як слабкий електроліт. 6. Значення рН деяких розчинів. 7.В яких поліграфічних процесах необхідно контролювати значення рН? Задача 1 Обчислити рН 0,1н. розчину хлоридної кислоти. Розвязування У виразі рН = - lg[Н+] підставляємо значення вмісту іонів Гідрогену в 0,1н. розчині хлоридної кислоти, виходячи з того,що ступінь дисоціації (α)→1. Отже, [Н+]= С кислоти, тобто [Н+]= 1 · 10-1моль/л. Звідси рН = - lg1 ·10 -1 =1. Задача 2 Обчислити рН 0,01н розчину NaOH. Розвязування рН = - lg[Н+] Вміст іонів Гідрогену в 0,01н розчині NaOH знаходимо, виходячи із іонного добутку води: І Н2О = [Н+] · [ОН-] = 1 · 10-14, звідси [Н+] = 1 · 10-14 / [ОН-]. Вміст гідроксид-іонів в 0,01н. розчині NaOH (α)→1 дорівнює загальній концентрації лугу, тобто [ОН-] =1· 10-2 моль/л, тоді: [Н+] =1 · 10-14/ 1· 10-2 = 1· 10-12 моль/л, а рН = - lg1· 10-12=12. Задача 3 Обчислити рН 0,2 н розчину хлоридної кислоти. Задача 4 Обчислити рН 0,02 н розчину NaOH, при умові (α)→1.
Рекомендована література: 2. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст. 145-147. 3.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.142-143. 4.І.А.Гройсман.Хімія.Закони, схеми, формули, рівняння.Київ: «Логос»,1998р.- 28-29. 5.Мала гірнича енциклопедія. В 3-х т. / За ред. В. С. Білецького. — Донецьк: «Донбас», 2004. — ISBN 966-7804-14-3. 6 Матеріали з Інтернету. . Самостійне вивчення. Тема: Буферні розчини. План: 1.Буферні розчини. 2.Класифікація кислотно-основних буферних систем. 3.Механізм буферного дії.
Теоретичні відомості. У хімії, біології, медицині, у промисловому виробництві для перебігу тих або інших процесів часто потрібно забезпечувати сталість значень рН, в ході ж реакцій йони Гідрогену можуть зв'язуватись або виділятись. Щоб процес відбувся за сталого значення рН, у розчин вводять так звані буферні розчини, які здатні зв'язувати йони Гідрогену або гідроксид-іони і підтримувати рН розчину практично незмінним. Буферні розчини — це суміші розчину слабкої кислоти (або слабкої основи) та її солі, наприклад, суміш ацетатної кислоти й ацетату натрію СН3СООН + СН3СОONa, суміш гідроксиду і хлориду амонію NН4ОН + NH4Cl тощо. У разі добавляння до буферних розчинів розчину сильної кислоти або сильної основи відбуваються такі реакції:
Отже, під дією на буферний розчин розчину сильної кислоти або сильної основи змінюється концентрація розчину слабкої кислоти або слабкої основи. Проте рН буферного розчину практично не змінюється. Це пояснюється тим, що слабка кислота або слабка основа взагалі мало дисоціює, а за наявності однойменних йонів її солі дисоціація відбувається ще меншою мірою. Тому рН буферного розчину під дією сильної основи або сильної кислоти практично залишається сталим. Не змінюється рН буферного розчину й під час розбавляння, оскільки його рН залежить лише від співвідношення концентрації солі сс та кислоти ск і не залежить від ступеня розбавляння, що підтверджується формулою, за якою обчислюють рН буферного розчину:
За формулою
можна обчислити рОН буферного розчину, що складається з розчину слабкої основи та її солі. Буферні розчини часто використовують у хімічній промисловості в якісному та кількісному аналізах, коли потрібно провести реакцію за певного значення рН. У хімічному аналізі використовують також і інші буферні розчини, такі як суміш боратної кислоти і борату натрію, гідроген- і дигідрогенфосфатів калію, тартратної кислоти та її солі, цитратної кислоти та її солі тощо. Кожен буферний розчин має певну буферну ємність. Буферною ємністю називається здатність буферного розчину зберігати сталою величину рН у разі добавляння до нього розчинів кислот або лугів. Буферна ємність визначається кількістю еквівалентних мас кислоти (або лугу), яку слід добавити, щоб величина рН 1 л буферного розчину змінилась на одиницю. Розчин буферний (рос. раствор буферный, англ. buffer solution, нім. Pufferlösung f) – розчин з певним сталим значенням рН, окисно-відновного потенціалу або іншого параметру системи при зміні її складу. Це значення залежить від співвідношення концентрацій компонентів розчину, що знаходяться у хімічній рівновазі та слабко змінюється при незначному концентруванні, розбавленні, додаванні невеликих кількостей кислот або лугів. У крові є чотири буферні системи:
Кожна система складається з двох сполук — слабкої кислоти та солі цієї кислоти і сильної основи. Буферний ефект зумовлений зв’язуванням і нейтралізацією іонів, які надходять, відповідною сполукою буфера. У зв’язку з тим, що в природних умовах організм частіше зустрічається з надходженням у кров недоокислених продуктів обміну, антикислотні властивості буферних систем переважають порівняно з антиосновними. Буферні розчини відіграють велику роль у життєдіяльності. До числа виняткових властивостей живих організмів належить їх здатність підтримувати сталість рН біологічних рідин, тканин і органів - кислотно-основний гомеостаз. Ця сталість обумовлено наявністю декількох буферних систем, що входять до складу цих тканин. Буферні системи можуть бути чотирьох типів: СН 3 СООН, область дії рН = 3, 8 - 5, 8. Механізм буферного дії можна зрозуміти на прикладі ацетатної буферної системи СН 3 СОО - / СН 3 СООН, в основі дії якої лежить кислотно-основну рівновагу:
З рівняння (1) випливає, що концентрація водень-іонів дорівнює
У присутності другого компонента буферного розчину - сильного електроліту СН 3 СООNa кислотно-основну рівновагу оцтової кислоти СН 3 СООН зрушено вліво (принцип Ле Шательє). Тому концентрація недіссоціірованних молекул СН 3 СООН практично дорівнює концентрації кислоти, а концентрація іонів СН 3 СОО - - концентрації солі. У такому випадку рівняння (2) приймає наступний вигляд:
де з (кислота) і з (сіль) - рівноважні концентрації кислоти і солі. Звідси отримують рівняння Гендерсона-Гассельбаха для буферних систем 1-го типу:
У загальному випадку рівняння Гендерсона-Гассельбаха для буферних систем 1-го типу:
Для буферної системи 2-го типу, наприклад, аміачної, концентрацію іонів Н + у розчині можна розрахувати, виходячи з константи кислотно-лужної рівноваги сполученої кислоти NH 4 +:
Звідси отримують рівняння Гендерсона-Гассельбаха для буферних систем 2-го типу:
Рівняння (7) для буферних систем 2-го типу можна представить і в наступному вигляді:
Значення рН буферних розчинів інших типів також можна розрахувати за рівнянням буферного дії (4), (7), (8). Наприклад, для фосфатної буферної системи НРО 4 2 - / Н 2 РО 4 -, що відноситься до 3-го типу, рН можна розрахувати за рівнянням (4):
де р К а (Н 2 РО 4 -) - негативний десятковий логарифм константи дисоціації фосфорної кислоти по другому щаблі р К а (Н 2 РО 4 - слабка кислота);
Кислотно-основна рівновага в крові людини забезпечується водородкарбонатной, фосфатної і білкової буферними системами. НСО 3 - + Н + = Н 2 СО 3 Завдання для самоконтролю: 1. Які розчини називають буферними? 2. Наведіть приклади буферних розчинів. 3. Чому розведення водою буферні суміші не змінюють рН розчину?
Рекомендована література: 1. В.П.Басов.Хімія:Навчальний посібник:К.:Каравела,Львів,2003 р.- ст.53-56.. 2.Н.М.Буринська. Основи загальної хімії, 11клас:Підручник з поглибл. Вивченням хімії.-Київ;Ірпінь:ВТФ «Перун»,1997.- ст.113-117. 3.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.118-121. 4.Нормальна фізіологія / Кол. авторів; За ред. В.І. Філімонова. - К.: Здоров’я, 1994. - 608 с., іл.: 3,71 арк. іл. ISBN 5-311-00736-2 5.Н.В. Романова «Основи хімічного аналізу».-К. Освіта., 1992р. ст.27-28. 6.Матеріали з Інтернету.
Лекція. Тема: Гідроліз солей. План 1.Специфіка поведінки солей у розчинах. 2.Різновиди гідролізу солей. Теоретичні відомості У водному розчині відбувається взаємодія молекул розчиненої речовини з молекулами води.У результаті молекули розчиненої речовини зазнають хімічних перетворень.Зі складних речовин такі перетворення є характерними для солей. Взаємодія іонів солі,що утворюються в результаті електролітичної дисоціації,з молекулами води називається гідролізом солі.
1.Інтенсивність гідролізу залежить від величини поляризувальної дії іонів солі.Чим більше заряд і менше розмір іонів,тим більше їхня поляризуальна дія на молекули води.При сильній поляризувальній дії катіона М+ відбувається розпад молекули води на іони.Такий випадок гідролізу називається гідролізом за катіоном: М+(рз)+НОН(рд)⥂МОН(рз)+Н+(рз) (у дужках позначено:рз-розчин,рд-рідина). При гідролізі за катіоном у розчині підвищується концентрація іонів Гідрогену,встановляється кисле середовище (pH<7).Якщо молекули води зазнають сильної поляризувальної дії аніона А-,то відбувається гідроліз за аніоном:А-(рз)+НОН(рд)⥂НА(рз)+ОН-(рз).У розчині збільшується концентрація гідроксид-іонів(pH>7),установляється лужне середовище.При гідролізі завжди утворюються сполуки(іони або молекули),що мало дисоціюють.
1.1. Солі,утворені сильною основою і сильною кислотою, гідролізу не піддаються. Іони таких солей(NaCI, KNO3, Na2SO4 тощо)не можуть утворювати з водою слабких електролітів.У цьому випадку іони солі в реакції не беруть участі і рівновага дисоціації води не порушується.Концентрація іонів Н+ і ОН- така,як учистої води.розсин матиме нейтральне середовище(рН=7). 1.2. Гідроліз за катіоном є характерним для солей.утворених слабкою основою і сильною кислотою(NH4CI, CuCI2, Zn(NO3)2 тощо).Що слабкіше основа,то інтенсивніше відбувається процес гідролізу.Водні розчини солей,утворених слабкою основою і сильною кислотою,мають кисле середовище (рН<7)внаслідок накопичення в розчині катіонів Гідрогену як продукту гідролізу.
Приклад 1. Гідроліз хлориду амонію: NH4CI + HOH ⥂ NH4OH + HCI,у повному іонно-молекулярному вигляді: NH4 + + CI- + HOH ⥂ NH4OH + H+ + CI-,у скороченому іонно-молекулярному вигляді: NH4 + + HOH ⥂ NH4OH + H+. Якщо катіон солі багатозарядний,гідроліз проходить ступінчасто.Однак другий і наступні можливі ступені гідролізу практично не виявляються(у силу електростатичних причин заряджених частинок,що послабляють дисоціацію). Приклад 2. Гідроліз Купрум хлориду: CuCI2 + HOH ⥂ CuOHCI + HCI, в іонному вигляді: Cu2+ +2CI- + HOH ⥂ CuOH+ + 2CI- + H+, у скороченому іонно-молекулярному вигляді: Cu2+ + HOH ⥂ CuOH+ + H+.
1.3. Гідроліз за аніоном є характерним для солей,утворених сильною основою і слабкою кислотою(KCN, Na2CO3, CH3COOK тощо). Що слабкіше кислота,то інтенсивніше відбувається процес гідролізу.Водні позчини солей,утворених сильною основою і слабкою кислотою,мають лужне середовище(pH>7)унаслідок накопичення в розчині іонів ОН-.
Пиклад 3. Гідроліз Калій ціаніду: KCN + HOH ⥂ KOH + HCN, у повному іонно-малекулярному вигляді: K+ + CN- + HOH ⥂ K+OH- + HCN, у скороченому іонно-молекулярному вигляді: CN- + HOH ⥂ OH- + HCN.
Якщо сіль утворена багатоосновноюкислотою,гідроліз проходить ступінчасто.Однак другий і наступні можливі ступені гідролізу практично не виявляються(через електростатичний вплив заряджених частинок,що послабляють дисоціацію). Приклад 4. Гідроліз Натрій карбонату: Na2CO3 + HOH ⥂ NaHCO3 + NaOH, у повному іонно-молекулярному вигляді: 2Na+ + CO32- + HOH ⥂ 2Na+ + HCO3- + OH-.
1.4. Гідроліз за катіоном і аніоном характерний для солей,утворених слабкою основою і слабкою кислотою.Іони таких солей одночасно зв’язують іони H+ і ОН-,утворюючи слабкі електроліти-кислоту і основу.Залежно від значень констант дис
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 595; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.218.219 (0.02 с.) |